6株H9N2亚型禽流感病毒厦门分离株全基因序列测定与分析
2020-01-09蔡振鸿张丹英陈永锋何扬州
蔡振鸿,赵 冉,陈 琼,杨 涛,张丹英,陈永锋,何扬州
(1.厦门市思明区市政管理中心,厦门 361005;2.厦门市动物疫病预防控制中心,厦门 361009)
禽流感(avian influenza,AI)流行病学调查发现,近几年H9N2亚型流感病毒(Avian influenza virus,AIV)检出率居高不下。虽仍为低致病流感病毒特征,但宿主范围广,不仅可以感染家禽野禽,还突破种间屏障感染人和多种哺乳动物。早在1998年,就从猪体内分离到H9N2亚型病毒[1],1998~1999年香港、广州出现4例人感染H9N2病例报道。不仅如此H9N2病毒还在流感病毒的进化中扮演重要角色,1997年香港暴发的感染人H5N1、2013年国内暴发的感染人H7N9及2014年感染人H10N8等亚型流感病毒,其内部基因均来源于H9N2[2-4]。这种基因重组现象在H9N2亚型很普遍,很有可能形成新型流感病毒,成为下个流行的隐患。
2017年福建省厦门地区活禽屠宰场监测数据显示,H9N2亚型AIV检出率位居首位。为掌握现行流行毒株的遗传进化特点,本研究将分离到的6株H9N2病毒进行全基因测序、遗传进化及关键基因位点分析,旨在进一步了解当地H9N2流行株毒力特点,并为今后的禽流感防控提供科学依据。
1 材料和方法
1.1 分离毒株6株分离株,其中5株分离自健康鸡群,包括2015年9月分离自某活禽交易市场的A/Chicken/Xiamen/09/2015(H9N2)(简称XM09),2015年10月分离自某养殖场的A/Chicken/Xiamen/10/2015(H9N2)(简称XM10),以及2017年分离自某活禽屠宰场A/Chicken/Fujian/SD037/2017(H9N2)(简称FJ37)、A/Chicken/Fujian/SD056/2017(H9N2)(简称FJ56)和A/Chicken/Fujian/SD070/2017(H9N2)(简称FJ70);1株分离自环境,为A/Environment/Fujian/S1XA35/ 2017(H9N2)(简称XA35)。
1.2 主要试剂与仪器HA禽流感病毒通用诊断试剂盒购自QIAGEN,H1-H16亚型分型诊断试剂盒购自硕世生物科技有限公司和深圳澳东检验检测科技有限公司,核酸提取试剂(MagMAXTM-97Viral RNA)购自Thermo Fisher Scientific。荧光定量PCR仪购自RoCho,全自动核酸提取仪购自TECAN,SPF鸡胚购自北京梅里亚维通实验动物技术有限公司,特异性引物由宝生物工程(大连)有限公司合成。
1.3 病毒的分离与测序2015年分离株XM09和XM10由本研究室荧光定量PCR分型检测、鸡胚分离纯化,全基因扩增,送上海生工生物工程技术服务有限公司测序。2017年分离株FJ37、FJ56、FJ70、XA35由中国农业科学院哈尔滨兽医研究所鉴定、分离纯化及测序。
1.4 遗传进化分析利用Lasergene MegAlign软件对同源性及关键位点进行分析;采用MEGA5.2软件对8个基因片段的遗传分类进行分析。
2 结果
2.1 病毒的鉴定经荧光PCR分型检测及测序分析,6株分离株均为AIV H9N2亚型,全基因序列已上传GenBank,其登录号分别为MG204043~MG204058、MG192148~MG192178。
2.2 HA基因序列分析6株分离株的HA裂解位点位于氨基酸序列第333~338位,序列PSRSSRGL,符合低致病性禽流感病毒特征。受体结合位点分别位于氨基酸序列第109、161、163、191、198、202、203位,依次是Y、W、T、N、T、L、Y。这6株分离株与2000年以前的4个亚群代表株和2个疫苗代表株比较,存在多个位点的氨基酸突变,其中裂解位点第334位的氨基酸由非极性氨基酸A突变成极性氨基酸S;受体结合位点第198位氨基酸由A/E/V突变为T;受体结合位点左侧缘第234位氨基酸(相当于H3 第226位氨基酸)由Q突变为L,第235位氨基酸由Q突变为M,这种突变有向人类感染的嗜性;右侧缘第149位点均有突变,3株由K(R)突变为T,另外3株由K(R)突变为A,见表1。
糖基化位点见表2,可见29、141、298、305、492、551位点高度保守,表中的12株H9N2亚型HA均具有这6个糖基化位点,而105、206、313位点容易发生突变。6株分离株均有7个潜在糖基化位点,且完全相同,与2000年以前的6株参考毒株比较,均缺失218位点,增加了313位点。
抗原位点分析见表3,2017年的4株分离株与2015年的2株分离株的7个抗原位点完全相同,但与目前疫苗株的抗原位点比较发现,位于第234(相当于H3亚型第216位)、285、334位的抗原位点发生突变。
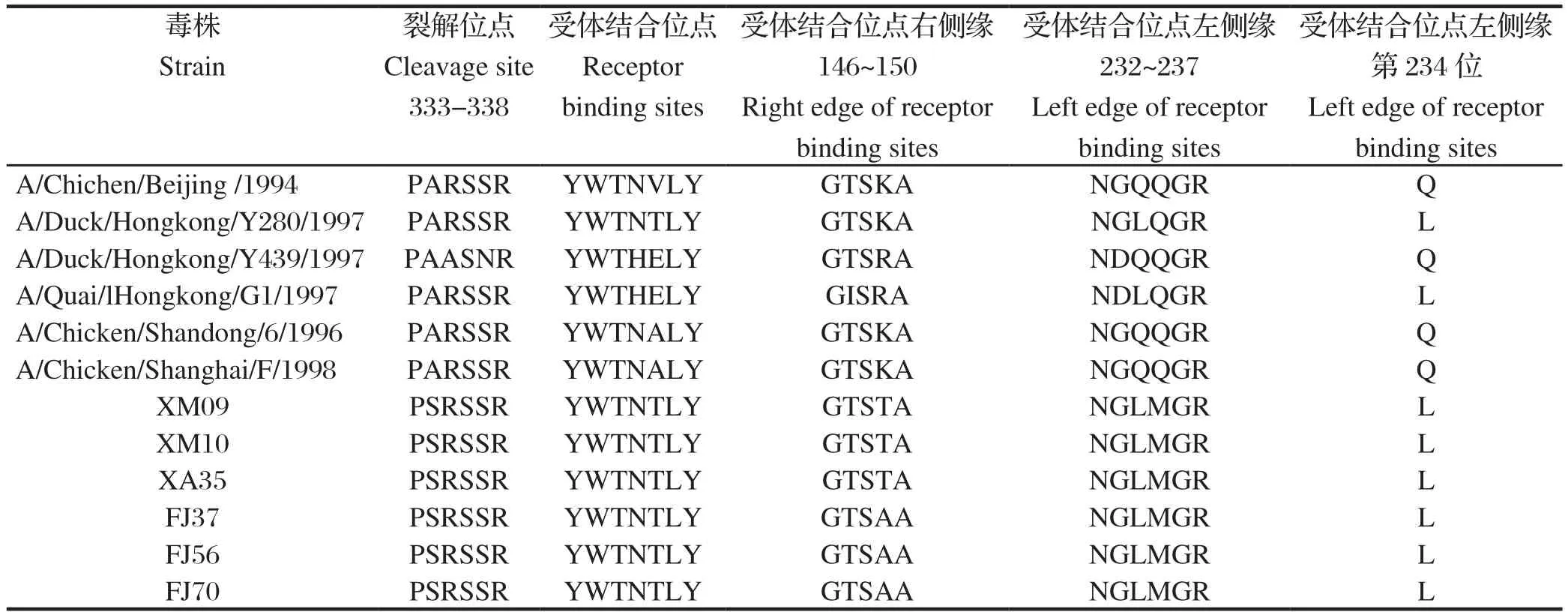
表1 HA裂解位点和受体结合位点的比较分析Table 1 Comparison of HA cleavage sites and receptor binding sites
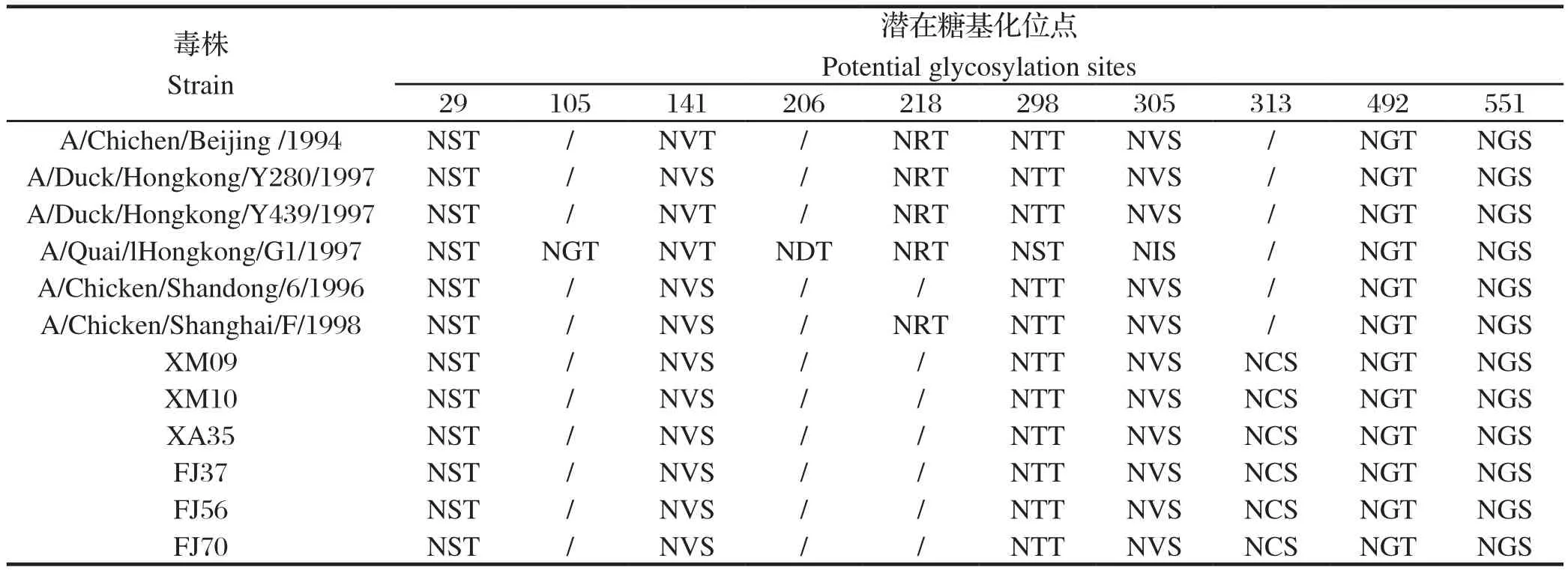
表2 HA潜在糖基化位点的比较分析Table 2 Comparison of HA potential glycosylation sites
2.3 NA基因序列分析6株分离株NA基因编码区全长均为1401 bp ,共编码467个氨基酸,颈部均缺失9个核苷酸,分别编码 63、64、65位T、E、I,属于高致病性NA标志。糖基化位点见表4,可见86、146、200、234位的糖基化位点高度保守,表中的12株H9N2亚型的NA均具有这4个糖基化位点;而61、69、70、264、306、368、402位的糖基化位点容易发生突变。本地的6株分离株与2000年前的参考毒株比较,均缺失61位的糖基化位点,增加了368位的糖基化位点。6株分离株之间的糖基化位点存在差异。2015年XM09株与2017年XA株35位糖基化位点相同,共6个糖基化位点;2017年FJ37、FJ56、FJ70株位糖基化位点相同,共7个糖基化位点,多出402位糖基化位点;而2015年XM10株有8个糖基化位点,缺失402位糖基化位点,多出70和264位糖基化位点。
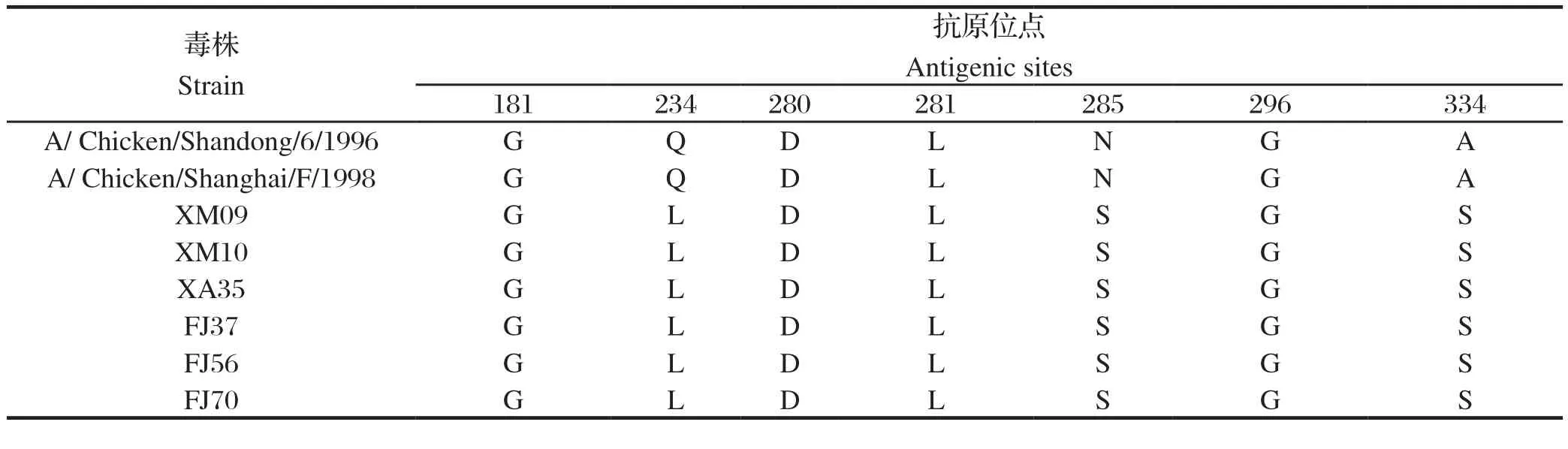
表3 HA抗原位点的分析Table 3 Analysis of HA antigenic sites
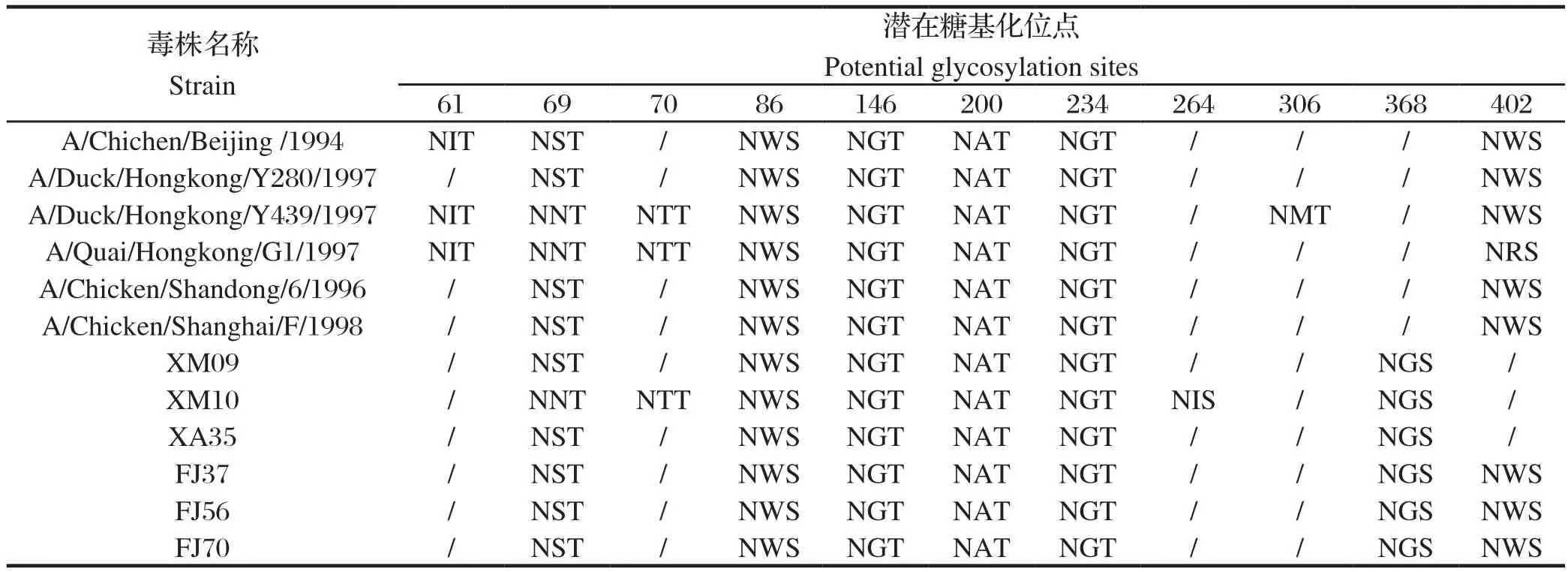
表4 NA潜在糖基化位点分析Table 4 Analysis of NA potential glycosylation sites
2.4 分离株毒力相关位点的分析PB2、PB1-F2、PA、M1、NS1、NP基因与AIV的致病性相关,其中某些特定位点的突变,可提高H9N2亚型AIV的毒力及哺乳动物嗜性。通过对分离株这些位点分析发现,M1基因N30D、T215A突变,NS1基因P42S突变,PB1-F2基因仅FJ37和FJ56出现N66S突变,见表5。
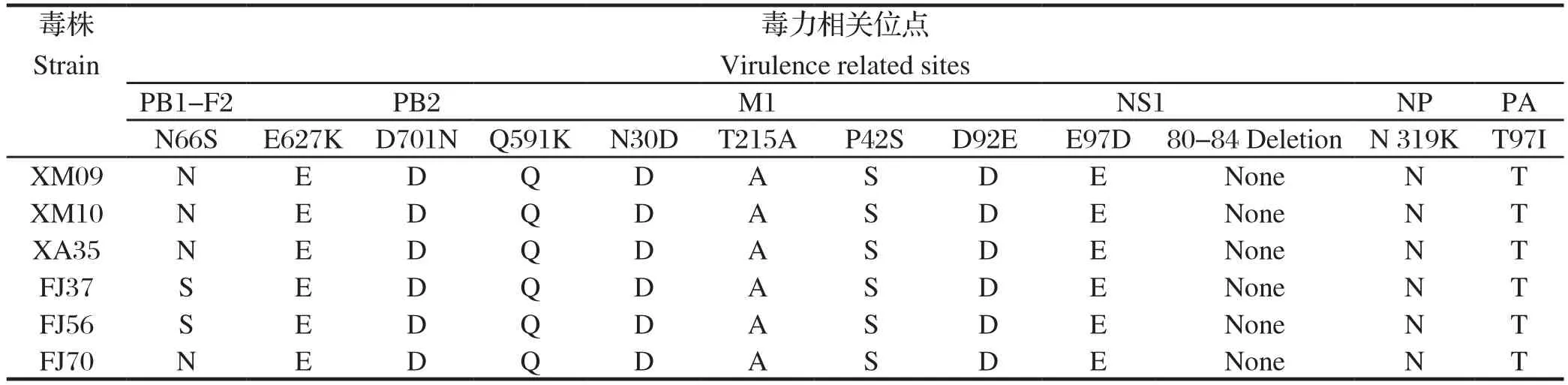
表5 分离株毒力相关位点分析Table 5 Analysis of virulence related sites
2.5 分离株耐药性相关位点的分析M2发挥离子通道的作用,与病毒的耐药性相关,26、27、30、31、34位点的突变可使病毒产生金刚烷胺类药物的耐药性。分离株耐药性位点中均出现S31N位点突变,见表6。
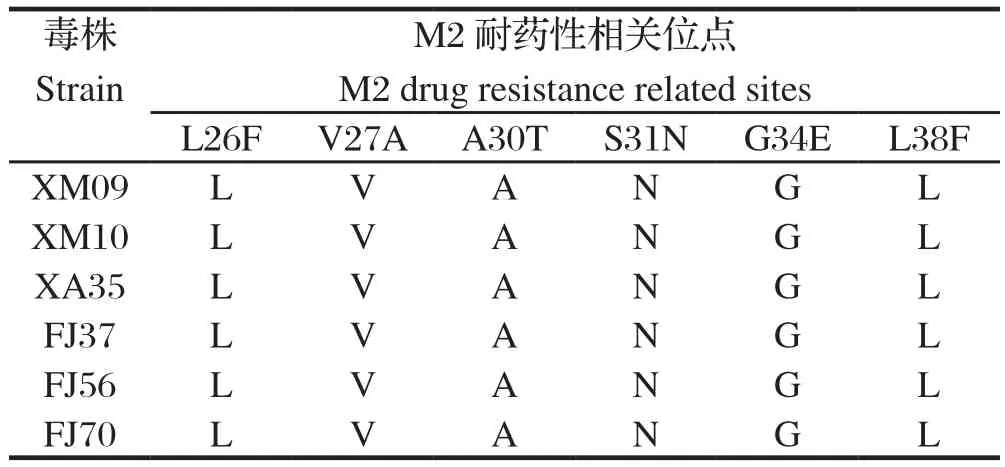
表6 分离株耐药性相关位点分析Table 6 Analysis of drug resistance related sites
2.6 分离株基因之间同源性分析6株分离株HA同源性95.9%~99.9%;NA同源性96.9%~100%;M同源性97.1%~100%;NP同源性95.2%~100%;NS同源性98%~100%;PA同源性在97.1%~100%;PB1同源性在93.1%~99.6%;PB2同源性在98.3%~100%。2017年分离株FJ37、FJ56和FJ70间同源性高,其中前2株NA、M、NP、NS、PA、PB2基因同源性100%,环境分离株XA35虽然也是2017年分离但与同年其他3株同源性关系较远,其中PB1基因同源性低至93.1%。2015年2株分离株之间同源性较远,其中NP基因同源性低至95.7%。2017年与2015年分离株之间同源性较远,其中HA、NP、PB1同源性低至95.9%、95.2%、93.1%。
2.7 与分离株同源性最高的毒株6株分离株与近两年周边省份的H9N2分离株高度同源,其内部基因与2016年浙江鸡(NS)、2015年上海鸡(M、NP)、2015年日本鸭(PA、PB1、PB2)H9N2亚型毒株同源性最高,同时部分内部基因还与H7N9、H10N8、H10N6、H5N6、H4N2、H7N3,H3N2、H6N2亚型AIV高度同源(同源性高达99%),详见表7。推测这些高同源性基因可能最初来源于同一毒株,也可能是基因重组的结果。

表7 与分离株核苷酸序列同源性最高的GenBank中的毒株Table 7 The strains with highest nucleotide sequence homology with isolates in GenBank

(续上表)

(续上表)
2.8 全基因的遗传进化分析6株分离株均属于欧亚分支。遗传进化表现为多样性,其中HA属于Y280-like分支;M和PB2属于G1-like分支;NA属于SD/96-like分支;其余4个内部基因均属于F/98-like分支,详见图1~8。6株分离株主要与近两年吉林省、山东省、广西壮族自治区、浙江省等地流行的H9N2亚型AIV毒株同源性近,与2005年以前各地的分离株亲缘关系远,与福建分离株A/Duck/Fujian/MH/2003、A/Duck/Fujian/FQ107/2007和野生水禽A/Wild/Waterfowl/ Dongting/ C2203/ 2011、A/Wild/Waterfowl/Dongting/PC2562/2012亲缘关系较远。

图1 HA基因的进化树Fig.1 Phylogenetic tree of HA gene

图2 NA基因的进化树Fig.2 Phylogenetic tree of NA gene
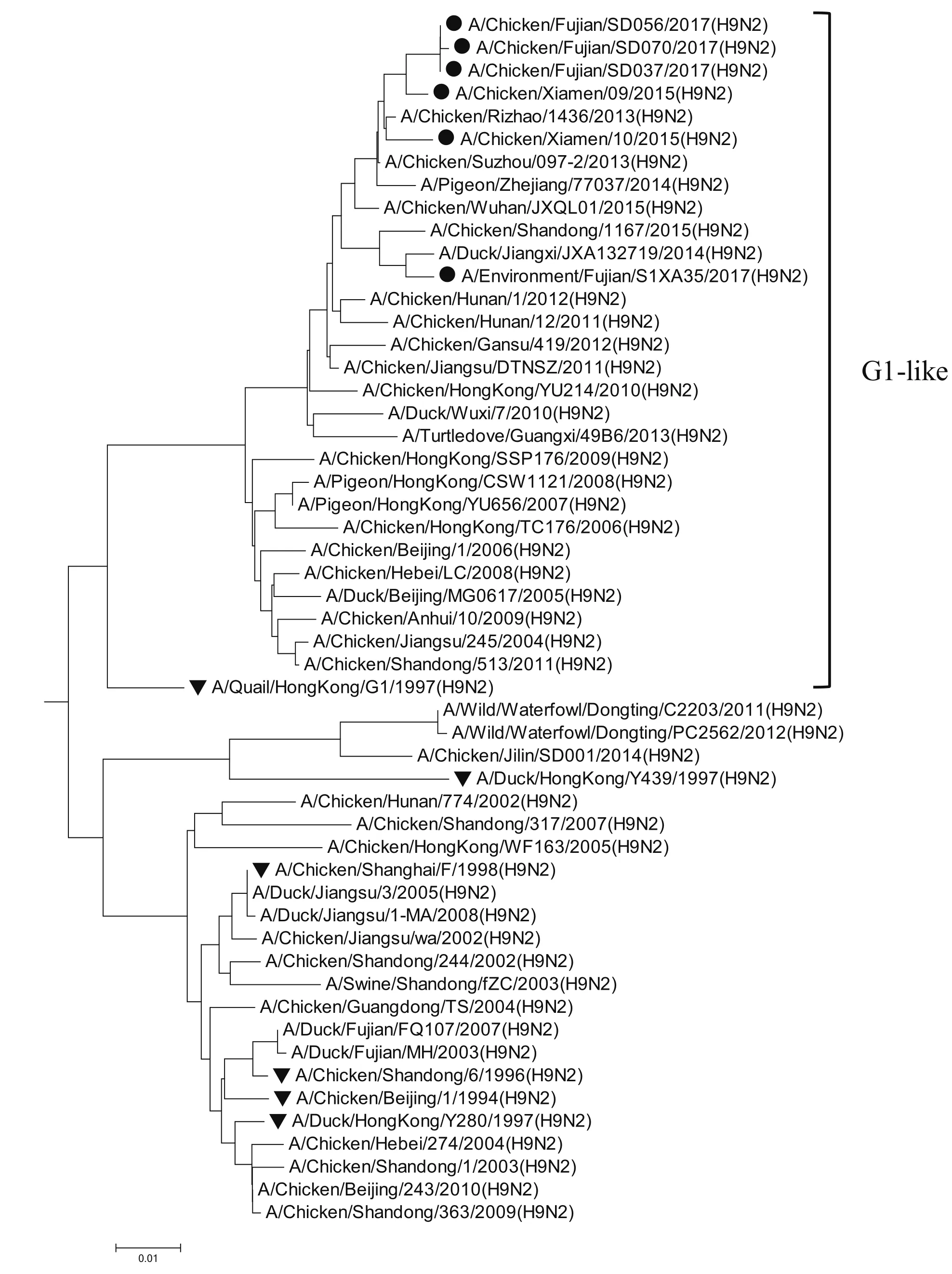
图3 M基因的进化树Fig.3 Phylogenetic tree of M gene
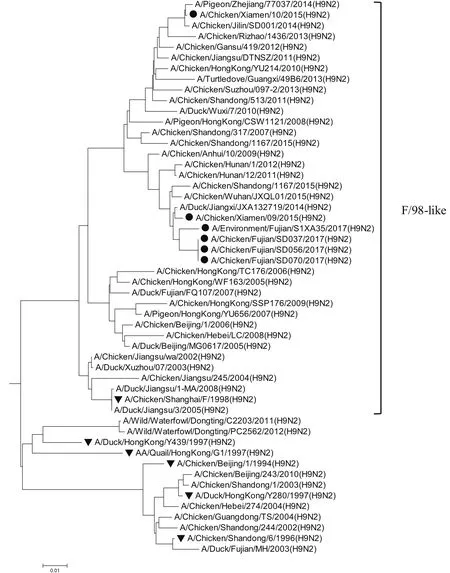
图4 NP基因的进化树Fig.4 Phylogenetic tree of NP gene

图5 NS基因的进化树Fig.5 Phylogenetic tree of NS gene
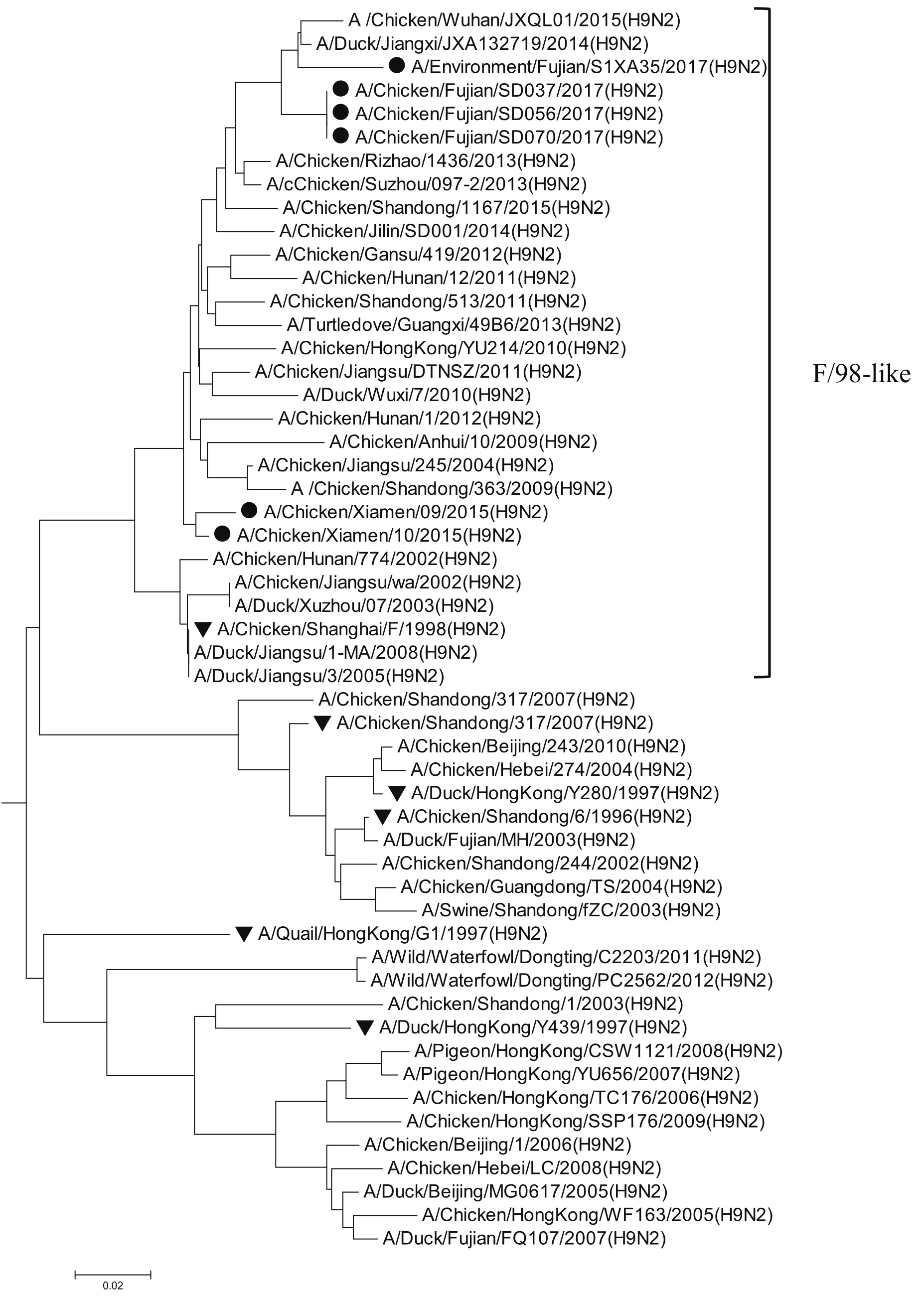
图6 PA基因的进化树Fig.6 Phylogenetic tree of PA gene
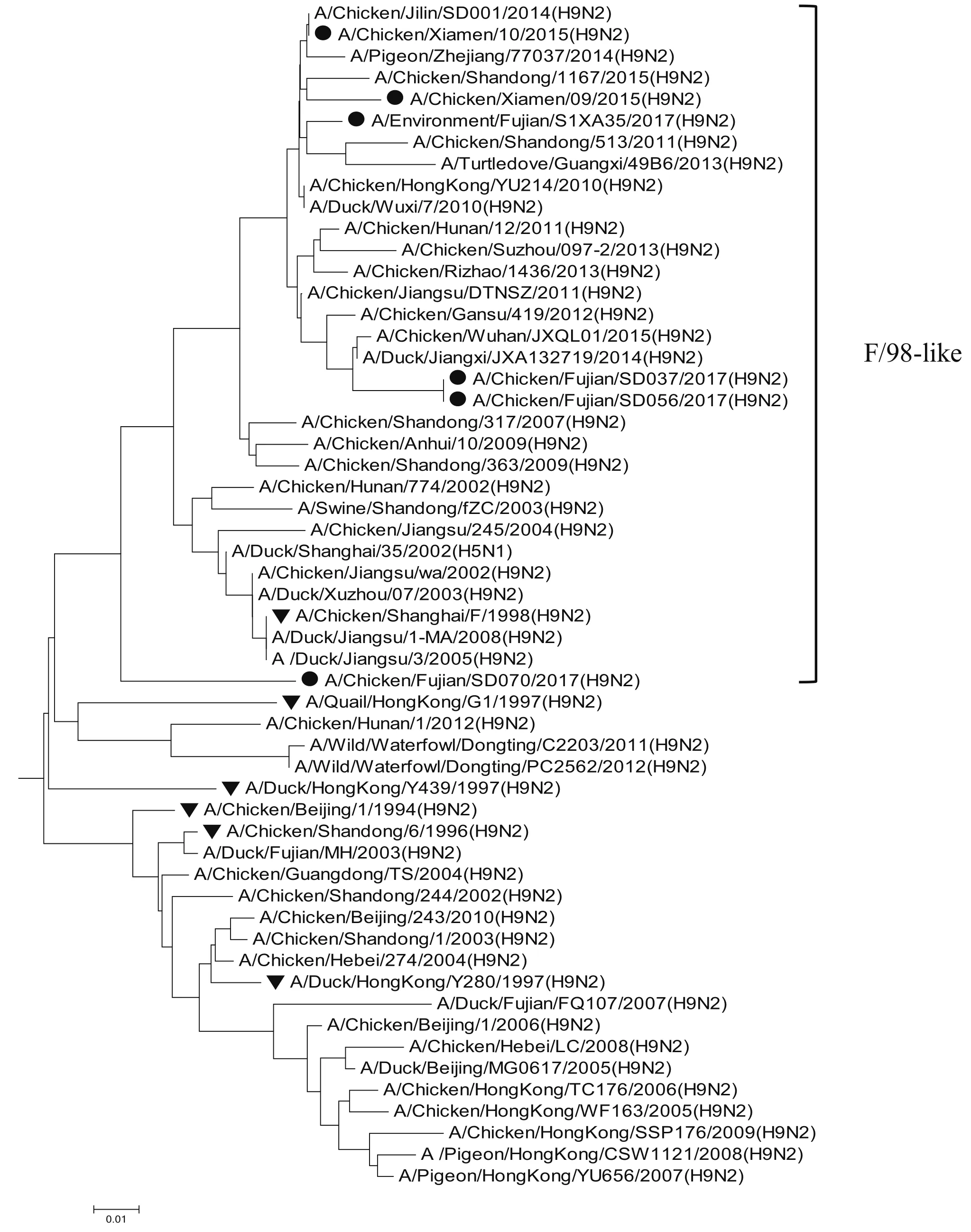
图7 PB1基因的进化树Fig.7 Phylogenetic tree of PB1 gene

图8 PB2基因的进化树Fig.8 Phylogenetic tree of PB2 gene
3 讨论
H9N2亚型AIV最早于1966年分离自北美火鸡[5],我国最早于1994年分离自广东省鸡群[6]。1998~2000年在我国家禽中出现H9N2第一次大流行,以BJ/94亚群为主,随着H9N2疫苗的推广使用疫情得以控制。2008年出现第二次大流行,此时H9N2亚型以Y280亚群为主。目前H9N2 在国内的检出率居高不下,多为隐性感染[7]。2017年厦门市活禽屠宰场流行病学调查显示,H9N2亚型的检出率位居首位,主要分离自鸡,在鸭群常与H6等亚型混合感染。
H9N2亚型在遗传进化上可分为北美和欧亚 2个分支。欧亚分支中又可分为A/Duck/HongKong/Y280/97(Y280-Like)、A/Quail/HongKong/G1/97(G1-Like)、A/Duck/ HongKong/ Y439/97(Y439-Like)3个亚分支[8]。2017年的4株H9N2 亚型分离株与2015年厦门分离到的2株H9N2亚型位于同一进化分支,HA属于Y280-like分支;M和PB2属于G1-like分支;NA属于SD/96-like分支;其余4个内部基因均属于F/98-like分支,表现为遗传多样性。
同源性分析显示,2017年禽源分离的FJ37、FJ56和FJ70与同年环境分离株XA35之间同源性关系较远,其中PB1基因同源性低至93.1%;2017年与2015年分离株之间同源性较远,其中HA、NP、PB1同源性分别低至95.9%、95.2%、93.1%。提示HA、NP、PB1这3个基因在进化中更为活跃。分离株的内部基因与2010年前福建流行的H9N2亚型毒株差异显著,却与H7N9、H10N8、H10N6、H5N6、H4N2、H7N3,H3N2、H6N2亚型高度同源(同源性高达99%),提示目前流行的毒株是多种亚型基因重组的结果。
基因序列分析发现,6株分离株HA第234位氨基酸(相当于H3第226位氨基酸)由Q突变为L,与2012年报道的上海发病鸡群中分离的3株H9N2亚型AIV毒株变异情况相符[9],这种突变有向人类感染的嗜性[10];HA的7个抗原位点与疫苗株比较,3个位点发生突变,提示免疫压力促进毒株的突变;NA基因颈部均出现9个核苷酸的缺失,这种分子特征属于高致病性NA标志;内部基因均同时出现M2基因S31N突变,M1基因N30D、T215A突变,NS1基因P42S的突变;FJ37和FJ56毒株还出现PB1-F2基因N66S的突变,这些内部基因关键位点的突变,提示当前分离株已出现耐药性、致病性增强的变化[11-14]。
文中针对H9N2亚型的主要毒力突变位点进行分析,除了这些位点外,有学者在其他亚型流感病毒中证实PB2基因中M147L、E158G、D253N、T271A、I504V、T588I、G590S、Q591R、S714R位点[15-23],PA基因中T85I、S224P、L336M、N383D、I550L、T552S、K615N位点[23-29]以及20、55、100、225、268、85、186、336位点[30-31],PB1基因中13、113、198、317、678位点[32-33],NP基因中184位点[34],NS基因中39、70、71、86位点的突变亦与毒株毒力增强相关[35]。除了M2基因相关位点突变,可以使毒株出现对金刚烷胺类药物耐药性外,有学者证实H5N1亚型NA蛋白中V116A、I117V、E119A、Y252H、H274Y和N294S的突变与达菲类流感病毒药物耐药性相关[36-39]。这些位点的突变是否在H9N2亚型中发挥同样作用,有待于进一步研究。
H9N2一直被定义为弱毒株,但越来越多的动物实验和临床实验证明该亚型具备潜在的感染哺乳动物和人的能力,加上其高检出率和在流感病毒进化中的重要地位,该亚型的防疫工作中应引起足够的重视,有必要定期开展监测及分子生物学分析工作。
