白粉菌诱导下小麦 TaNHO1基因的克隆、表达分析及亚细胞定位
2020-01-08徐晓敏罗腾丽吉万全
王 晖,徐晓敏,罗腾丽,吉万全,张 宏
(西北农林科技大学农学院/农业部作物基因资源与种质创制陕西科学观测实验站,陕西杨凌 712100)
小麦白粉病是小麦生长中后期的主要病害之一,由禾本科布氏白粉菌小麦专化型(Blumeriagraminisf. sp.tritici,Bgt)侵染所引起,导致小麦(Triticumaestivum)叶绿素降解,光合速率降低,产量受损[1]。实践证明,利用抗病品种无疑是防控白粉病危害最经济、便利的方法。目前,在小麦中已经有64个抗白粉病基因被正式命名[2]。但是,多数品种携带的抗性基因(resistance gene,R)为专一抗性基因,其抗病谱窄,面对变异频繁的病菌,其抗性容易丧失。因此,育种实践中,对抗病基因,尤其是广谱抗性基因的需求和研究显得更加迫切[3-4]。
在长期的协同进化中,植物对大多数的微生物入侵产生了免疫力[5-6]。其中非寄主抗性是植物对大多数病原微生物最普遍的抗病形式之一,且具有广谱持久的特性。植物的先天免疫系统包括两种反应模式,一个是被模式识别受体(pattern recognition receptors,PRRs)识别的病原物表面分子(pathogen-associated molecular patterns,PAMPs)所触发的免疫反应(PAMP-triggered immunity,PTI)[7];另一个是由NB-LRR蛋白识别效应因子所启动的免疫反应(Effector-triggered immunity,ETI)[8]。无论是PTI还是ETI在植物抗病方面所起到的作用都需要复杂的信号网络,涉及到各种植物激素的调节。其中,水杨酸(saliculic acid,SA)调节的信号通路在多个非寄主抗性反应中扮演着重要的角色,如拟南芥防御柑橘溃疡病菌[9]、水稻(转玉米非寄主抗性基因Rxo1)抵抗细菌性条斑病反应[10]等。值得注意的是,类似于抗病基因PR1和PAD4[11],寄主响应细菌和真菌病原体等非寄生菌胁迫过程中,NHO1基因亦是植物非寄主抗性病程中必需和共有的[12]。如在拟南芥(Arabidopsisthaliana)中,NHO1基因有助于抵抗真菌灰葡萄胞菌(Botrytiscinere)和细菌丁香假单胞菌(PseudomonassyringaetabaciP.s.tabaci)的侵染[13-14]。与此同时,NHO1基因也参与部分抗性基因所介导的寄主抗性,如RPM1、RPS2等[12,15]。除模式植物外,水稻(Oryzasativa)OsNHO1基因[16]和苋色蔾(Chenopodiumamaranticolor)CaNHO1基因[15]同样也被证实在相应的非寄主和寄主抗性中发挥着重要作用。正是由此,Peart等[17]认为非寄主抗性与寄主抗性机制之间存在一定的相关性。由此可见,NHO1基因在广谱抗性方面具有广泛的功能和广阔的利用前景。然而,目前对植物非寄主抗性分子机制的研究依然十分有限。
拟南芥NHO1基因编码的甘油激酶(glycerol kinase,GK),是甘油代谢的限速酶[18];同时也是能量代谢的关键酶,对脂肪的储存和碳水化合物的代谢起着至关重要的作用[19]。甘油激酶催化甘油产生的3-磷酸甘油(glycerol-3-phosphate, G3P),是拟南芥基础抗性和系统获得性抗性(systemic acquired resistance, SAR)中植物防御信号的一种新型调控因子[14,20]。Yang等[21]报道小麦中NHO1基因通过参与调控G3P的合成来影响对小麦条锈菌(PucciniastriiformisWestend f. sp.triticiErikss,Pst)的抗性,同时证实该基因参与了SA通路对无毒Pst小种CYR23的应答,但对于响应小麦白粉菌侵染过程中该基因的表达差异,以及对该基因的启动子研究以及亚细胞定位等未见报导。因此在小麦转录组数据基础上[22],本研究克隆了小麦中位于A、B、D三个基因组中的NHO1基因的部分同源序列,通过对其在小麦白粉菌胁迫下,三个部分同源染色体基因各自时空表达模式、启动子区域序列上调控元件及亚细胞定位进行初步分析,以期对该基因在小麦抗白粉病过程中的功能进行进一步解析。
1 材料与方法
1.1 材料与菌株
小麦条锈病和白粉病兼抗种质N9134是以染色体工具材料“阿勃5B非整倍体”为母本,与野生二粒小麦(Triticumdicoccoides)As846杂交后代经抗性定向选择而来的农艺性状良好且抗白粉病的小麦新种质。陕优225为本实验小麦白粉菌繁殖寄主和接种感病对照。以N9134为供体,陕优225 为轮回亲本,经7轮回交培育的携带PmAs846抗/感病近等基因系N9134R和N9134S由西北农林科技大学农学院培育并保存。中国春(China spring,CS)及中国春缺体-四体N2BT2A、N2DT2B、双端体DT2AS、陕优225和本氏烟草(Nicotianabenthamiana)的种子均由西北农林科技大学农学院提供。
小麦白粉菌(Blumeriagraminisf. sp.triticiBgt)E09菌株由中国农业科学院植物保护研究所麦类病害创新课题组惠赠。
1.2 材料的处理
将N9134及其抗病近等基因系N9134R、感病近等基因系N9134S种于盆钵中,置于25 ℃人工培养箱中培养。待幼苗长到两叶一心时,通过抖接法接种E09菌株。分别于接种前0 h,接种后12、24、36、48、72 h取叶样,置于-80 ℃保存备用。
1.3 基因组DNA、总RNA的提取及cDNA第一链的合成
采用CTAB法[23]提取小麦叶片基因组DNA。采用Trizol试剂法[24]对不同时间点叶片样品进行总RNA的提取。再根据PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit(TaKaRa,大连)试剂盒程序进行cDNA第一链的合成。
1.4 目的基因CDS区序列克隆及定位
利用Zhang 等[22]N9134 转录组数据基础结合基因组测序结果,依据获得序列中最大开放阅读框设计引物(表1)。以引物TaNHO1-F/R 、TaNHO1-2BF/R、 TaNHO1-2DF/R在cDNA中进行PCR扩增并采用缺体-四体定位,以特异性引物在DNA中扩增,来明确该基因所在染色体位置。PCR反应体系及程序参照吴迪等[25]方法。
1.5 生物信息学分析
通过NCBI(https://www.ncbi.nlm.nih.gov)和URGI(https://wheat-urgi.versailles.inra.fr/Tools)中BLAST程序对TaNHO1基因进行核酸序列及其氨基酸序列进行比对;用ExPASy(https://www.expasy.org/resources)中的在线网站资源进行生物信息学分析,如InterProScan(http://www.ebi.ac.uk/interpro/search/sequence-search)软件进行保守结构域预测;用Target P1.1 Server(http://www.cbs.dtu.dk/services/TargetP) 、Signal P3.0 Server(http://www.cbs.dtu.dk/services/SignalP-3.0)以及 TMHMMServer v2.0(http://www.cbs.dtu.dk/services/TMHMM/)软件对蛋白的信号肽、跨膜螺旋进行预测; 用ProtScale(https://web.expasy.org/protscale)对蛋白的亲疏水性进行预测;用NetPhos 2.0(http://www.cbs.dtu.dk/services/NetPhos-2.0)进行磷酸化位点预测;用Cell-PLoc2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2)进行该蛋白亚细胞定位预测。用 DNAMAN 8软件进行多重序列比对,用MEGA 7.0软件,采取 Neighbor-Joining法构建系统进化树;用MEME Suite 5.0(http://meme-suite.org)和GSDS 2.0(http://gsds.cbi.pku.edu.cn)在线分析软件对序列motif和基因结构进行分析。
1.6 基因启动子区域克隆及分析
依据Ensembl Plants(http://plants.ensembl.org/index.html)上公布的序列,选取ATG上游2 000 bp启动子区域,设计专一引物2A、2B、2D-promter F/R(表1)在基因组DNA中进行PCR扩增,采用方法同本文1.4内容。利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)在线对其进行分析。
1.7 E09侵染下 TaNHO1基因的表达分析
基于克隆得到的TaNHO1同源基因序列,在其差异区域分别设计专一性引物(表1),以TaActin为内参基因(表1)。利用TaKaRa公司(大连)的RR037A试剂盒要求采用两步法,对实验材料所取6个时间点叶片的总RNA进行反转录合成cDNA。通过ABI 7300型荧光定量PCR仪,采用TaKaRa公司(大连) RR820A试剂盒进行实时荧光定量PCR反应,利用2-△△Ct法进行目标基因接种白粉菌后的表达分析。
1.8 亚细胞定位
以杨凌奥科鼎盛生物科技公司测序的含有TaNHO1-2B基因的质粒为模板,设计同源重组引物GFP-F和 GFP-R(表1)扩增TaNHO1基因的CDS序列(已除终止子TAG),方法同1.4。将扩增得到的序列与SpeⅠ酶切的PYJ::GFP载体同源重组构建成PYJ-TaNHO1-2B-GFP载体,经大肠杆菌转化、菌落PCR检测后提取质粒,转化农杆菌EHA105, 以PYJ::GFP载体的空白载体为对照。参照丁作美[26]等的方法进行农杆菌侵染及观察。
2 结果与分析
2.1 小麦 TaNHO1基因的同源克隆结果
以接种E09的N9134叶片cDNA为模板,以TaNHO1-F/R(表1)为引物,对TaNHO1-2A基因扩增得到长度1 800 bp左右的目标条带 (图1),对该条带进行胶回收、连接、转化、挑菌、测序后,利用NCBI进行核酸序列比对,结果表明,与小麦编码甘油激酶基因相似度高达96%。利用特异性引物(表1)扩增得到的3个同源基因(图1)分别位于第2同源群A、B、D染色体上,故命名为TaNHO1-2A(Genbank登陆号MN082576)、TaNHO1-2B(Genbank登陆号MN082577)和TaNHO1-2D(Genbank登陆号MN082578)。CDS序列全长分别为1 605、1 599和1 605 bp。经序列比较,3个基因中存在91个SNP差异。与基因组DNA比对后发现,基因均含有3个内含子和4个外显子(图3-B)。TaNHO1-2B在第一外显子中比TaNHO1-2A/2D少6 bp,3条来自不同基因组序列的差异主要存在于内含子上。

M:DNA分子量标准 DL2000;1~3分别代表TaNHO1-2A、TaNHO1-2B和TaNHO1-2D的PCR产物。
M:DNA Marker DL2000; 1,2 and 3 represent the PCR products ofTaNHO1-2A,TaNHO1-2BandTaNHO1-2D, respectively.
图1TaNHO1基因的PCR扩增
Fig.1 PCR amplification ofTaNHO1gene
2.2 染色体定位结果
电泳结果(图2)分析表明:引物TaNHO1-F/R在DT2AS双端体中未扩增出目标条带,而在N2BT2A 、N2DT2B缺体-四体以及CS中扩增得到3 941 bp来源于A染色体组的条带;引物TaNHO1-2B F/R在N2BT2A缺体-四体中未扩增出目标条带,而在DT2AS双端体、N2DT2B缺体-四体以及CS中扩增得到3 930 bp来源于B染色体组的条带;引物TaNHO1-2D F/R在N2DT2B缺体-四体中未扩增出目标条带,而在DT2AS双端体、N2BT2A缺体-四体以及CS中扩增得到 3 762 bp来源于D染色体组的条带。因此,进一步明确3个同源基因转录自小麦第二同源群3条部分同源染色体。
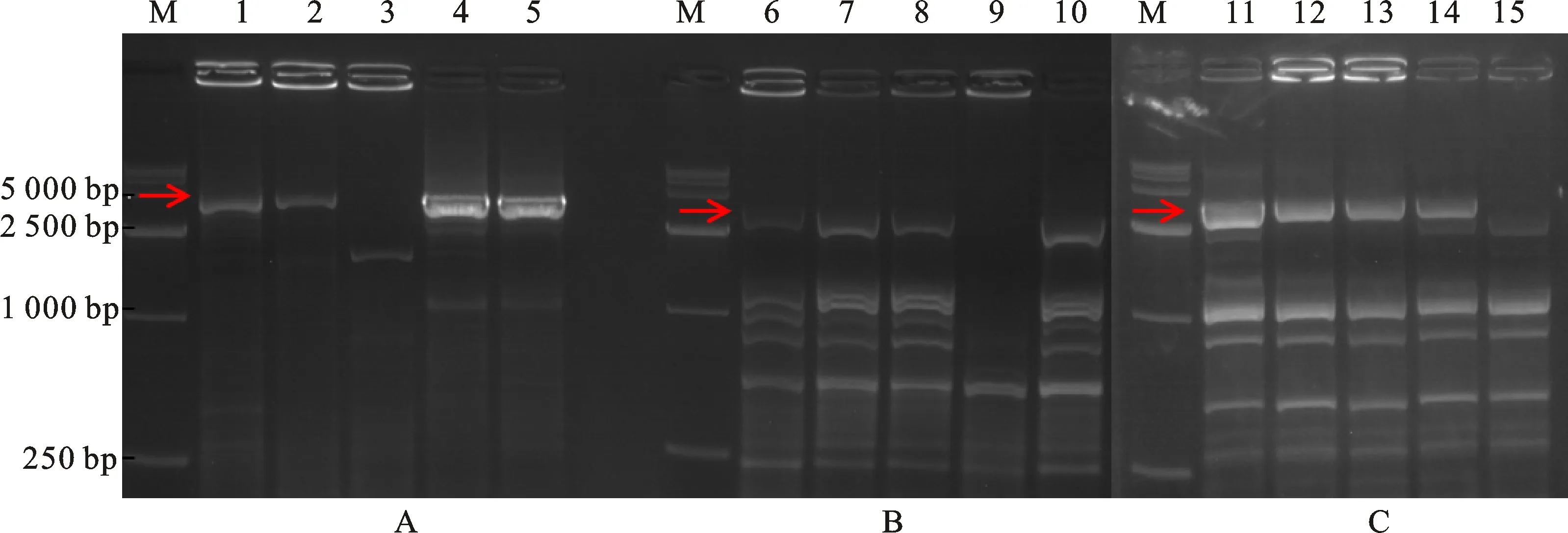
M: DL5000;A、B、C为TaNHO1-2A、TaNHO1-2B和TaNHO1-2D的缺体-四体定位;1、6、11模板为N9134; 2、7、12模板为CS;3、8、13模板为DT2AS;4、9、14模板为N2BT2A;5、10、15模板为N2DT2B。
M:DL5000; A,B and C are the localization ofTaNHO1-2A,TaNHO1-2BandTaNHO1-2D,respectively.Lanes 1, 6 and 11:Amplicons from N9134; Lanes 2, 7 and 12:Amplicons from CS; lanes 3, 8 and 13:Amplicons from DT2AS;Lanes 4, 9 and 14:Amplicons from N2BT2A; lanes 5, 10 and 15:Amplicons from N2DT2B.
图2TaNHO1同源基因的缺体-四体定位扩增电泳
Fig.2 Localization ofTaNHO1homologous genes with nulli-tetrasomic lines
2.3 生物信息学分析
2.3.1 蛋白的理化性质
利用Target P1.1、Signal P3.0和TMHMM 软件进行的分析表明,TaNHO1基因在小麦中的三个同源基因均编码一种非分泌蛋白,无法进行蛋白转运,为非跨膜蛋白。ProtScale在线进行分析推测出TaNHO1基因编码的蛋白为亲水蛋白。一般来说,可能发生磷酸化的位点存在于多肽链中越多,其所能发挥的功能就可能更多[27]。通过 NetPhos 2.0在线软件对该蛋白进行磷酸化位点预测,结果表明其含有大量的蛋白磷酸化位点(表2),由此推测出其编码的蛋白质活性可能与其磷酸化调控有关。用InterProScan对蛋白结构域分析发现,3个同源基因均含有FGGY家族成员的特征结构域,包括参与底物结合的FGGY_N端结构域和负责ATP结合的FGGY_C端结构域。与拟南芥、水稻中编码NHO1基因的蛋白序列进行比对,结果表明其包含FGGY家族中2个保守位点和ATP结合位点(图3A),推测TaNHO1编码小麦甘油激酶。

A:NHO1基因的氨基酸序列比对,横线部分为ATP结合位点,线框部分为2个FGGY家族保守位点;B:小麦和其他植物编码甘油激酶蛋白之间的系统进化树;用MEME4.0程序中描述的方法进行motif分析,盒子的不同颜色代表蛋白对应位置的10个motif;基因结构分析,横线为内含子,盒子为对应的外显子和上下游非编码区。
A:Amino acid sequence alignment deduced fromNHO1genes;the underlined sequence is the ATP binding site, and the boxed parts are the two conserved sites of the FGGY family; B:Consensus neighbor-joining tree based on the sequences of glycerol kinase from wheat and other plant;Motif analysis was determined by using MEME 4.0 program as described in methods. Different colors of the boxes represent 10 motifs in the corresponding position of each proteins.For gene structure analysis, the horizontal lines represent introns, the boxes correspond to exons and 5’UTR and 3’UTR.
图3 NHO1蛋白同源性分析
Fig.3 Homology analysis of NHO1 proteins

表2 同源基因中磷酸化位点个数Table 2 Number of phosphorylation sites in the three alleles
2.3.2 蛋白同源性
利用NCBI中同源序列比对获取拟南芥、水稻、野生二粒小麦、粗山羊草(Aegilopstauschii)、乌拉尔图小麦 (Triticumurartu)、二穗短柄草(Brachypodiumdistachyon)、谷子(Setariaitalica)、玉米(Zeamays)、大麦(Hordeumvulgare)以及高粱(Sorghumvulgare)等物种中与之同源性较高的基因序列。选取AtNHO1与OsNHO1基因同小麦NHO1基因进行多序列的比对(图3A)。发现TaNHO1-2A/2B/2D与AtNHO1和OsNHO1之间高度保守。为进一步研究TaNHO1基因的进化关系,将其与其他物种的氨基酸序列通过MEGA7.0软件构建进化树(图3B),发现TaNHO1-2A与野生二粒小麦A染色体组(TRIDC2AG072400)亲缘关系最近;TaNHO1-2B与野生二粒小麦B染色体组(TRIDC2BG078470)亲缘关系最近;TaNHO1-2D与粗山羊草(EMT01355)亲缘关系最近。进化分析表明,普通小麦和野生二粒小麦、乌拉尔图小麦、大麦(HORVU2Hr1G114260)、粗山羊草(EMT01355)等C3的单子叶作物属于同分支;与高粱(EES12965)、谷子(KQK99202)、玉米(Zm00001d002085_T001)等C4的单子叶作物属于遗传较远的另一分支;与拟南芥AtNHO1等双子叶植物遗传距离最远。通过MEME 5.0对其蛋白序列进行保守motif预测,共发现10个保守motif,其中有9个motif在所有蛋白质中存在,其排列顺序也相同。通过对基因结构的分析表明,小麦TaNHO1在基因结构上与其他作物之间具有较大的相似性。综合以上结果表明TaNHO1-2A、2B和2D与AtNHO1和OsNHO1以及其他作物编码甘油激酶的基因序列之间高度保守。
2.4 启动子区域分析
启动子分析结果表明:序列中除TATA-box和CAAT-box以外还含有大量响应植物激素以及干旱等胁迫的顺式作用元件,且在同源基因间存在差异。从响应植物激素元件来看,TaNHO1基因启动子受到多种植物激素调控,参与防卫、胁迫等植物应激反应,推测该基因可能受多种激素信号调节并参与小麦抗病抗逆反应,是一个与抗逆境相关的基因。从三个同源基因的启动子的差异上看,其均能受到SA、茉莉酸(jasmonic acid, JA)等植物激素诱导影响,但相同元件的数量不同(表3)且所处的位置不同(图4)。TaNHO1-2B基因启动子分析结果在接受植物激素诱导的顺式作用元件的数量上明显多于TaNHO1-2A/2D。
2.5 侵染后的表达差异分析
该基因的3个部分同源染色体同源基因在不同时间点的表达分析(图5)结果表明,对N9134的抗病近等基因系(N9134R)接种E09后,TaNHO1-2A、2B基因在接种早期均迅速呈现出上调表达,在接种12 h到24 h之内分别达到2.8和2.3倍上调表达;TaNHO1-2A基因在24 h后趋于正常水平,但TaNHO1-2B基因在72 h的表达量再次上调;而TaNHO1-2D在36 h后先表现下调,但在72 h表现出高于对照3.5倍的上调表达。对N9131的感病近等基因系(N9134S)接种E09后,该基因在3个部分同源染色体的同源基因均在接种48 h表现出下调表达。虽然同源基因TaNHO1在表达模式和表达量上存在差异,但均在小麦响应白粉菌侵染时参与了防御反应,且在其在抗、感病近等基因系之间的表达量上存在明显差异。
2.6 蛋白亚细胞定位
利用Cell-PLoc2.0的亚细胞定位预测结果显示,该蛋白作用于细胞质上的可能性最大,其次是细胞膜、细胞核上。为了更加准确的定位该蛋白的作用位置,进行了亚细胞定位实验。结果显示,PYJ::GFP空白载体分布在烟草表皮细胞的细胞核、细胞膜和细胞质等部位(图6A),而PYJ-TaNHO1-2B-GFP融合蛋白在细胞质、细胞膜以及核膜中表达(图6B),这说明该基因定位结果与预测结果一致。

表3 TaNHO1-2A、2B、2D启动子区域主要顺式作用元件Table 3 Main cis-acting elements of TaNHO1-2A, 2Band 2Dpromoter regions
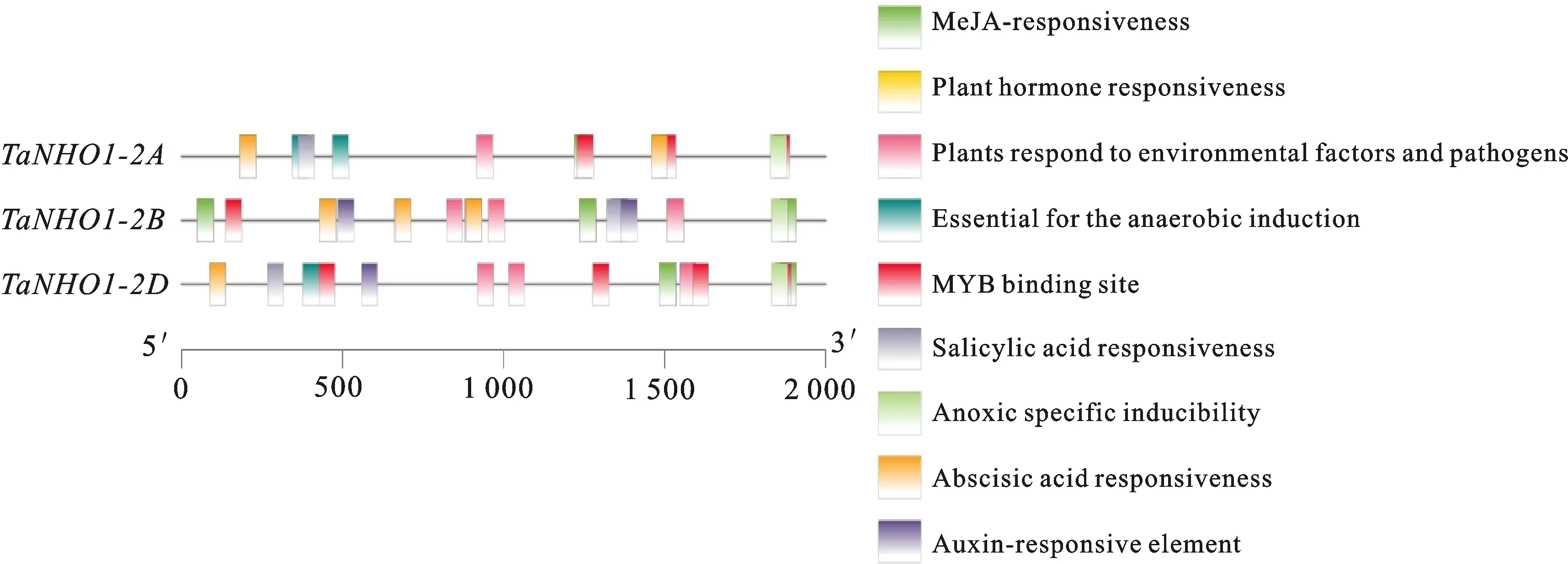
图4 TaNHO1启动子区部分顺势作用元件的相对位置

A:对N9134R接种E09后TaNHO1-2A/2B/2D基因的相对表达量; B:对N9134S接种E09后TaNHO1-2A/2B/2D基因的相对表达量。
A:Relative transcriptional changes ofTaNHO1-2A/2B/2Dinduced byBgtinfection in N9134R after inoculation with E09; B:Relative transcriptional changes ofTaNHO1-2A/2B/2Dinduced byBgtinfection in N9134S after inoculation with E09.
图5TaNHO1基因在E09侵染后不同时间点的相对表达量
Fig.5 Relative expression levels ofTaNHO1gene at different time points after infection

A:对照PYJ::GFP空白载体定位;B:PYJ-TaNHO1-2B-GFP融合蛋白定位。
A:The localization of control PYJ::GFP empty vector; B:The localization of PYJ-TaNHO1-2B-GFP fusion protein.
图6 小麦TaNHO1-2B基因的亚细胞定位分析
Fig.6 Subcellular localization of wheatTaNHO1-2Bgene
3 讨 论
前人研究表明,NHO1基因编码的甘油激酶参与甘油代谢合成G3P,而在拟南芥中G3P是其基础抗性和系统获得性抗性(systemic acquired resistance,SAR)防御系统中的一种新型调控因子[13,20]。水稻OsNHO1通过上游SA信号通路介导对其本身寄主病原物PXO99的抗性[16]。此外,将水稻OsNHO1互补到拟南芥nho1突变体上,证明其可以恢复对非寄主病原物的抗性。我们对TaNHO1-2A、2B和2D基因的启动子区域分析发现,其启动子区均含有大量TCA-element、as-I等元件,意味着SA可能调控TaNHO1-2A、2B和2D基因的表达。这一结果进一步为SA信号通路和NHO1基因均响应小麦抗条锈病[21]的过程提供了理论解释。
本研究利用转录组分析结果,PCR扩增得到的小麦TaNHO1基因的三个同源基因,其编码蛋白均属于FGGY家族,含有FGGY_C端结构域和FGGY_N端结构域,这与拟南芥、水稻、红藻(Pyropiahaitanensis)、苋色蔾(Chenopodiumamaranticdor)乃至大肠杆菌(Escherichiacoli)编码甘油激酶的基因具有相同的保守结构域;利用NJ法构建的系统进化树、以及通过分析保守motif和比较不同作物间同源基因的基因结构得到的结果表明该基因在进化过程中高度保守。在转录水平,Pseudonmonassyringaepv. Phaseolicola侵染拟南芥时,AtNHO1基因在12 h到24 h之间转录水平迅速上调来响应非寄主病原菌的侵染[28];在水稻被白叶枯病原菌PXO99侵染时,OsNHO1基因在9 h到24 h之间表现出强烈的上调表达来抵抗寄主病原菌侵染[16]。与此同时,在小麦抵抗Pst无毒性小种CYR23侵染中,TaGLI/NHO1基因同样的在12 h到24 h上调表达后趋于正常值[21],这与本实验得到的TaNHO1-2A基因在响应Bgt无毒小种侵染时的表达模式相同,且基因启动子区域与OsNHO1基因启动子较为相似,均含有大量的植物激素响应元件,如MeJA顺式作用元件、TGA-element、ABRE、MBS等。综合以上结果,TaNHO1基因在结构上与响应病原菌侵染过程中同AtNHO1和OsNHO1拥有高度的相似性。序列相似意味着功能相近,因此推测其在小麦非寄主抗性方面可能发挥着类似的作用。
据报道,甘油激酶在细胞质内催化ATP中的磷酸基团转移到甘油中,从而产生G3P;而在微生物中甘油激酶可以与结合在细胞膜上的甘油促进子相互作用并可以促进甘油激酶的功能[29-30]。本研究结果进一步证实了NHO激酶的多重功能。亚细胞定位结果表明,在小麦中甘油激酶主要作用在细胞质内催化甘油向G3P转化,改变植物甘油的含量,从而直接或者间接影响病原菌在植物中获取的营养成分,进而实现非寄主抗性[31]。此外,细胞膜和核膜定位信号结果表明,甘油激酶在植物中亦可能通过与作用于细胞膜上类似甘油促进子的基因发生相互作用,从而促进胞内甘油转化成G3P,然而其互作蛋白需要进一步研究。
多倍体化和基因冗余给小麦基因功能研究带来了巨大阻力。本研究克隆的NHO1基因,虽然来自于3条部分同源染色体,但同源基因间对生物胁迫的反应却不相同,表明其都参与到响应白粉菌侵染的过程中。在启动子研究报道中,启动子同样存在累积效应,同时,元件数量与转录距离的差异均会对启动子响应的强度和诱导产生的结果表现出不同的影响[32-33]。本实验对TaNHO1基因启动子的分析表明,虽然启动子的组成元件种类一致,但其在数量以及与转录起始位点的距离不同,可能导致了小麦TaNHO1基因在不同染色体上的表达差异。本研究所得到的结果为进一步解析非寄主抗性基因NHO1在小麦抗白粉病过程中的作用提供数据支撑,以及应对小麦多倍体化,同源基因的不同表达模式分析提供了参考,同时也为小麦抗病育种提供了基因资源,此后可进一步将TaNHO1基因转入拟南芥nho1突变体中进行其功能验证。
