2"-O-没食子酰基金丝桃苷的抗炎和神经保护活性研究
2019-12-24夏良萍孙惠芳郭兰芳
夏良萍,孙惠芳,王 丹,郭兰芳*,汤 建
(1.江苏大学附属四院,江苏 镇江 212001;2.江苏大学 药学院,江苏 镇江 212013)
金丝桃苷具有抗炎镇痛、神经保护、抗抑郁、抗氧化、保肝、抗癌、降血糖以及保护心脑缺血损伤等药理活性[1,2],广泛存在于蔷薇科(如北山楂)、藤黄科(如贯叶连翘)等植物中[3]。本课题组在前期研究中发现野生植物泽漆中富含金丝桃苷及其衍生物2″-O-没食子酰基金丝桃苷(2″-O-galloyl hyperoside,HyG)[4]。一些含有没食子酰基片段的天然化合物(如:茶多酚)往往具有良好的抗氧化、神经保护活性[5]。因此本课题组推断,2"-O-没食子酰基金丝桃苷可能具有良好的抗炎、抗氧化和神经保护等方面的药理活性。在本研究中,本课题组利用细胞模型初步评价了此化合物的抗炎和神经保护作用。
1 材料与方法
1.1 细胞与试剂
小鼠单核巨噬细胞白血病细胞RAW264.7,购自中国科学院上海细胞库;PC12低分化细胞株,由江苏大学药学院药理实验室提供;HEK 293T细胞,购自美国ATCC;1640培养基和新生牛血清(NBCS),购自维森特生物技术(南京)有限公司;DMEM培养基,购自Sigma公司;胎牛血清(FBS),购自Gibco公司;四甲基偶氮唑蓝(MTT)及二甲基亚砜(DMSO),购自生工生物工程(上海)股份有限公司;TRAPEZE端粒酶试剂盒,购自美国EMD millipore。2"-O-没食子酰基金丝桃苷和对照药物金丝桃苷为本实验室自制,纯度>95%。
1.2 主要仪器
Sartorius电子天平;台式高速冷冻离心机(Thermo Scientific);酶标仪(Spectra Max190,Molecular Device);二氧化碳培养箱(Thermo Scientific)。
1.3 化合物对NO释放的影响
参照文献将HyG用DMSO配置成 100 mM的储备液[6],使用时用含10% NBCS的1640培养基稀释至所需浓度。指数生长期的RAW 264.7细胞接种于96孔板中,5×104个/孔。待细胞状态稳定贴壁后分别加入终浓度为0.3、3、30 μM的待测样品,孵育24 h弃上清后每孔加入20 μL MTT工作液(5 mg/mL),37 ℃孵育3 h。除去上清,每孔加入DMSO (100 μL)轻摇振荡使得实验孔底部紫色结晶溶解并均匀分布,酶标仪570 nm测得吸光度(OD值),计算细胞存活率。
RAW 264.7细胞接种于24孔板中,4×105个/孔。待细胞状态稳定贴壁后分别加入终浓度为0.3、3、30 μM的待测样品,孵育12 h。弃去上清后加入150 μL的含LPS(终浓度1 μg/mL)的培养基,孵育12 h。取上清,离心,备用。
将NaNO2标品用细胞培养液梯度稀释至0、1、2、5、10、20、40、60、100 μM,加至96孔板中,50 μL/孔。再依次加入Griess Reagent Ⅰ和Ⅱ,反应20 min后于酶标仪540 nm检测吸光度(OD值)。以NaNO2浓度梯度为X轴,OD值为Y轴,得回归方程为Y= 0.004X-0.016,r=0.997,在1~100 μM范围内有良好的线性关系。据标准曲线计算NO浓度。
1.4 HyG对鱼藤酮致PC12损伤的保护作用
参照文献将PC12细胞接种于96孔板中[2],细胞密度1×104个/孔;37 ℃,5% CO2细胞培养箱中培养24 h。弃去上清,加入终浓度为0.1、1、10、100 μM浓度的HyG孵育5 h。加入终浓度5 μM的鱼藤酮共育24 h。弃去上清,加20 μL的MTT于37 ℃孵育3 h。弃去上清,每孔加入DMSO (100 μL)轻摇振荡使得实验孔底部紫色结晶溶解并均匀分布,酶标仪570 nm测得吸光度,计算细胞存活率。
生长期细胞占细胞培养瓶的80%时,按照细胞密度6×103个/孔接种于96孔板中,培养基在37 ℃,5% CO2细胞培养箱条件下培养24 h。弃去上清,加入终浓度为0.3、1、3、10、30 (μg/mL)的浓度梯度的PSC孵育5 h。加入终浓度50 μM共育24 h。弃去上清,加20 μL的MTT于37℃孵育3 h。弃去上清,每孔加入DMSO (100 μL)轻摇振荡使得实验孔底部紫色结晶溶解并均匀分布,酶标仪570 nm测得吸光度,计算细胞存活率。
1.5 化合物对叠氮钠致PC12损伤的保护作用
在此实验中采用25 mM叠氮钠(NaN3)损伤PC12细胞,其他操作同“1.4”项。
1.6 化合物对端粒酶的作用
参照文献将HEK 293T细胞接种于12孔板中[7],置于37 ℃,5% CO2孵箱培养48 h,吸去培养液后D-PBS洗涤,再加入胰蛋白酶消化5 min。加入DMEM培养基混匀、转移至离心管中。400 g离心5 min,吸去上清,D-PBS洗涤。细胞中加入含有蛋白酶的裂解液,混匀后置于冰上裂解30 min,于4 ℃,12 000 g下离心20 min。上清层转移至小离心管(10 μL/管)中,干冰/乙醇冷冻后置于-80℃冰箱内保存。TRAP实验参照TRAPEZE®端粒酶试剂盒操作说明进行,测定HyG对端粒酶的调节活性(图3A-D)。每个微型离心管中含有上述制备的裂解产物2 μL,药物的终浓度分别为0.1、1、10 μM,阳性对照组为1 μL的TSR8,空白组为0.1% DMSO。
1.7 数据分析处理
本次实验采用GraphPad Prism 7统计学软件进行单因素和多因素变异比较分析(ANOVA),各组数据采用平均数±标准差(mean±SD)表示。P<0.05表示差异具有统计学意义,P<0.01表示差异具有极显著统计学意义。
2 结果
2.1 HyG对RAW264.7细胞炎症的抑制作用
在细胞存活率实验室中,HyG对RAW264.7细胞无明显细胞毒活性,说明细胞培养液中NO浓度降低是基于药物对细胞中NO释放的抑制。本实验中发现HyG对RAW264.7细胞中NO释放具有一定的抑制作用,但作用强度均低于相同浓度的金丝桃苷(HyP)。

注:LPS:1 μg/mL;IND(阳性对照药吲哚美辛):50 μM;##P<0.01,**P<0.01。
图1 HyP和HyG对RAW264.7细胞中NO释放的抑制作用
2.2 HyG对PC12细胞增殖的影响
在细胞存活率实验室中,HyG对PC12细胞的自然增殖没有明显的抑制作用,说明化合物HyG对PC12细胞无明显细胞毒活性。
2.3 HyG对鱼藤酮和叠氮钠致PC12损伤的保护作用
HyG(0.3-30 μM)对叠氮钠所致的PC12细胞损伤具有显著的保护作用(P<0.01),其中30 μM浓度下损伤后的PC12细胞存活率较空白对照组高10.3%,3 μM浓度下HyG的保护作用略低于金丝桃苷(HyP)。在鱼藤酮致PC12细胞损伤模型中,HyG也表现出浓度依赖性的保护作用,但和模型组(Rot组)相比并未表现出显著差异。
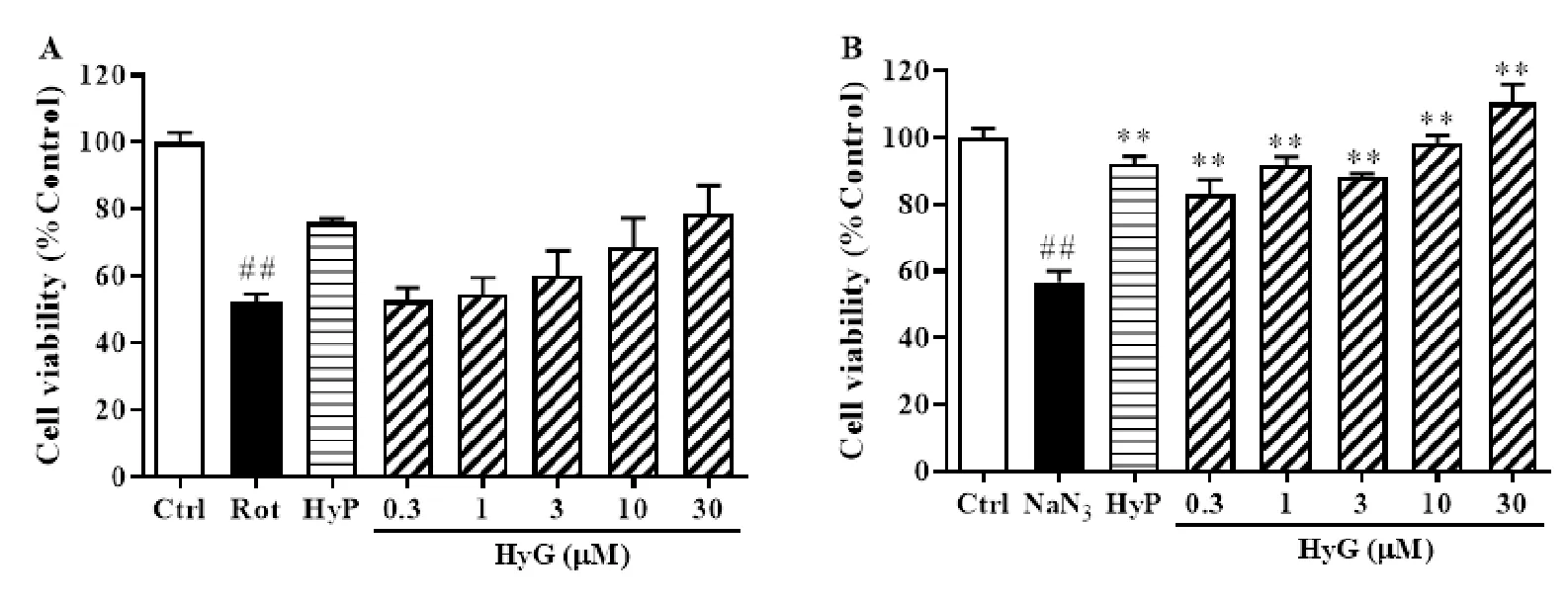
注:Ctrl:空白对照组;Rot:(鱼藤酮)5 μM;NaN3(叠氮钠):10 mM;HyP(金丝桃苷): 3 μM;##P<0.01,**P<0.01。
2.4 端粒酶活性
金丝桃苷(HyP)和HyG在0.1、1.0、10 μM浓度下,对HEK293T细胞中的端粒酶具有一定程度的抑制作用,相对端粒酶活性分别降低12.0%、12.9%、22.6%(图3C)和-1.7%、27.6%、49.4%(图3D)。

注:DMSO:0.1%DMSO;△H:95 ℃加热20 min。
3 讨论
HyG具有一定程度的抗炎活性,但和金丝桃苷相比并未表现出优势。HyG对叠氮钠损伤的PC12细胞具有显著保护作用,但在3 μM浓度下HyG作用强度略低于金丝桃苷,对鱼藤酮损伤的PC12细胞损伤不敏感。端粒酶激活是细胞寿命延长和保护的重要机制之一,但与预期的结果相反,HyG和对照药金丝桃苷对HEK293T细胞中的端粒酶具有一定程度的抑制作用。可见,HyG的神经保护活性不是基于对端粒酶的激活作用,可能与其他方面的机制,如抗氧化应激等有关。在后续的工作中还需要进一步的研究来阐明HyG的神经保护作用机制。
