基于转录调控元件设计的高级生物化学实验教学
2019-12-20郭志强周耐明
史 影,郭志强,曹 铮,周耐明
(浙江大学 生命科学学院,杭州 310058)
0 引 言
高级生物化学实验是我校生命科学学院面向本学院高年级本科生开设的高级生物化学课程中的实验部分。区别于基础生物化学实验常用的对生物大分子静态、孤立的分析方法,本实验力求呈献给学生一个完整、动态的生物化学系列过程,引导学生掌握新型生化方法和实验思路,增强学生综合性实验能力。本文从科研实践中提炼实践高级生物化学实验——利用转录调控元件CRE及报告基因荧光素酶检测GPCR受体功能,用于多年教学实践,大大激发了学生的学习兴趣,很好地提高了学生综合实验能力,该模型还可以适用于产学研多个领域。
1 实验原理
报告基因的编码序列常和其他基因相融合形成嵌合基因,当在调控元件控制下进行表达时,报告基因的表达产物可以来标定目的基因的表达调控。在真核基因表达调控研究中,常用的报告基因有氯霉素乙酰转移酶基因(cat)、β-半乳糖苷酶基因、荧光蛋白、荧光素酶基因等[1-3]。本实验采用萤火虫荧光素酶(firefly luciferase)作为报告基因,荧光素酶在生物体内能催化荧光素或脂肪醛氧化发光。与传统报告基因相比,荧光素酶具有检测速度快、灵敏度高、费用低、不需使用放射性同位素等优点,目前常用于信号通路检测、miRNA靶点验证,启动子效率验证,以及发光免疫分析及环境监测等方面[4-6]。
基因转录调控元件对基因表达的调控是细胞内正在发生的重要分子事件,同样它也成为研究基因表达的重要手段[7]。调控元件的选择与特定的细胞、特定的信号转导途径、特定的转录因子等有关。多种自然和合成的调控元件被广泛用于报告基因系统。如自然启动子,c-fos启动子,血清应答元件SRE(Serum response element),热休克应答元件HSE(Heat shock response element),cAMP应答元件CRE (cAMP response element)等,这些调控元件使得所在启动子受上游转录因子的调控。人工合成的启动子中还可加入多个单一调控元件来增强转录效果,如几个CRE串联的cAMP反应元件[8-10]。
细胞膜上G蛋白偶联受体(G protein-coupled receptors,GPCRs)可通过与异源三聚体G蛋白的相互作用调控胞内第二信使cAMP、Ca2+等浓度,引导下游信号传导,从而实现信息从细胞外到细胞内乃至细胞核的信息传递,进而影响正常或病理生理过程[11-12]。Gαs偶联的GPCRs,激动剂作用后,可激活细胞内腺苷酸环化酶(AC),引起胞内cAMP水平升高,进而激活PKA(cAMP-dependent protein kinase A)。活化后的PKA可通过磷酸化CREB(CRE binding protein),促使CREB入核并与特定的CRE启动子序列结合,促进下游基因转录。Gαi偶联的GPCRs活化后抑制腺苷酸环化酶活性,促使胞内cAMP水平降低,通过抑制PKA活性,最终抑制CRE下游基因的转录[13-15]。
本实验所用报告基因质粒将3个串联的转录调控元件CRE和一个CRE-VIP(vasointestinal peptide promoter)启动子序列,克隆在firefly luciferase的上游,并连接在原核表达载体pBluescript上,构成报告基因质粒。报告基因质粒和GPCR受体质粒共转染细胞,适当刺激或处理后裂解细胞,测定荧光素酶活性。通过荧光素酶活性的高低判断胞外激动剂和拮抗剂作用于细胞膜上受体的效率及对下游信号通路的影响(见图1)。

图1 CRE-luc系统工作示意图
2 实验过程
2.1 质粒提取及检测
本实验所用质粒为PCMV-hCB1、PCMV-hCB2和报告基因质粒pBluescript /3CRE/pCRE-VIP-fLuc。将所用质粒转化至大肠杆菌中,摇菌扩大培养。用去除内毒素的质粒提取试剂盒提取相关质粒,紫外分光光度法对所提质粒进行定性分析、定量测定。
2.2 细胞培养
本实验所用细胞株为人胚胎肾细胞HEK293,用含10%FBS的DMEM/Low Glucose培养基,在37 ℃,5%CO2培养箱中培养。待细胞汇合度达到80%~90%时,以1∶3~1∶5的稀释度传代。
2.3 转染
将处于良好生长状态的HEK293细胞,以(3~5)×105的密度接种于6孔培养板中。在37 ℃,5%CO2培养箱中继续培养18~24 h,用于质粒转染。选用Lipofectamine 2000和磷酸钙两种转染方法。80%~90%细胞汇合度适用于Lipofectamine 2000转染,50%~60%细胞汇合度适用于磷酸钙转染试剂转染。转染按说明书操作。
教师建议方案:每组用Lipofectamine 2000转染4孔,质粒比例分别是PCMV-CB1: pBluescript /3CRE/pCRE-VIP-fLuc 3∶1, PCMV-CB1: pBluescript /3CRE/pCRE-VIP-fLuc 1∶1, PCMV-CB1: pBluescript /3CRE/pCRE-VIP-fLuc 1∶3, PCMV-CB2: pBluescript /3CRE/pCRE-VIP-fLuc 3∶1.每组用磷酸钙转染2孔,质粒比例分别是PCMV-CB1: pBluescript /3CRE/pCRE-VIP-fLuc 3∶1和PCMV-CB2: pBluescript /3CRE/pCRE-VIP-fLuc 3∶1。每组学生可按需调整方案。转染后继续培养4~6 h,换新鲜培养基继续培养8~12 h。
2.4 细胞模型的功能检测
2.4.1 细胞准备
将6孔板中转染后的HEK293细胞以合适密度接种于96孔培养板中,按细胞密度调节种孔数量。37 ℃,5%CO2培养箱中继续培养18~24 h,使在进行实验时细胞达到70%~80%的汇合度。
2.4.2 药物刺激
提供CB1、CB2的激动剂WIN-55212-2,拮抗剂SR141716。在96孔板培养细胞中加含不同浓度梯度激动剂的培养基,做激动剂刺激实验。设空白对照,以胞内腺苷酸环化酶激动剂Forskolin做正对照。设置3组平行实验。
加同一浓度激动剂WIN-55212-2及不同浓度梯度拮抗剂SR141716,做拮抗剂功能实验。设空白对照、用只含WIN-55212-2的作为阴性对照。设置3组平行实验。
细胞于37 ℃,5%CO2培养箱培养中继续孵育4~6 h。
2.4.3 荧光素酶报告基因检测
将细胞培养基从待检细胞中吸出。向细胞培养孔中加入适当的1X细胞裂解非变性缓冲液,冰浴裂解10 min。取25 μL萤光素酶检测试剂加入事先收集的25 μL细胞裂解上清液中,马上放入荧光光度计或Topcount化学发光仪中读数,记录结果。
2.5 作图分析讨论
用PRISM软件对数据进行作图分析和讨论,获得激动剂及拮抗剂作用曲线,及激动剂的EC50、拮抗剂的IC50值,比较不同转染试剂、不同质粒配比及不同受体之间的作用曲线。
3 实验结果讨论
3.1 激动剂对调控元件的影响
设计一系列激动剂浓度梯度,分别刺激CB1和CB2转染的细胞,4~6 h后测定荧光素酶活性,用PRISM软件作图分析。图2显示激动剂WIN-55212-2对CB1和CB2均可激活,它们的EC50值分别为58.1 nmol/L和4.95 nmol/L,其中CB1显示Gs特征,CB2显示Gi特征,与之前实验研究相符,CB1的反应窗口比CB2大。实验过程与实验数据相结合,反映了膜外信号向膜内,直至报告基因表达的传递,也体现了不同受体活化对应的不同信号通路变化。


图2 激动剂对调控元件的影响
3.2 拮抗剂对调控元件的影响及受体作用专一性研究
设计一系列拮抗剂浓度梯度,研究拮抗剂SR141716拮抗激动剂WIN-55212-2的效果,结果见图3,SR141716能有效拮抗WIN-55212-2对CB1的激动作用,IC50为103 pmol/L,但它不能明显拮抗WIN-55212-2对CB2的激动作用。从中可以看出,SR141716是CB1的强拮抗剂,同时也是CB1的特异性拮抗剂,对CB2没有显著影响。


图3 拮抗剂对调控元件的影响
3.3 不同转染方法的比较
不同孔细胞选择不同的转染方法,比较不同转染方法的原理、效率、操作要点及适用范围。从图4所示中可以看出,不论是激动剂实验还是拮抗剂实验,lipofectamine 2000和磷酸钙转染都能获得类似的反应曲线,但lipofectamine 2000转染的最终荧光读数和窗口都比磷酸钙转染大很多,说明lipofectamine 2000的转染效率比磷酸钙转染高很多,更适合于需要高转染效率和大反应窗口的实验;而磷酸钙转染则可适用于如挑选稳定转染单克隆细胞株等低转染效率以及大规模、低成本的细胞转染实验。该结果也显示了转染效率的高低不影响膜外配体与膜受体的作用能力。

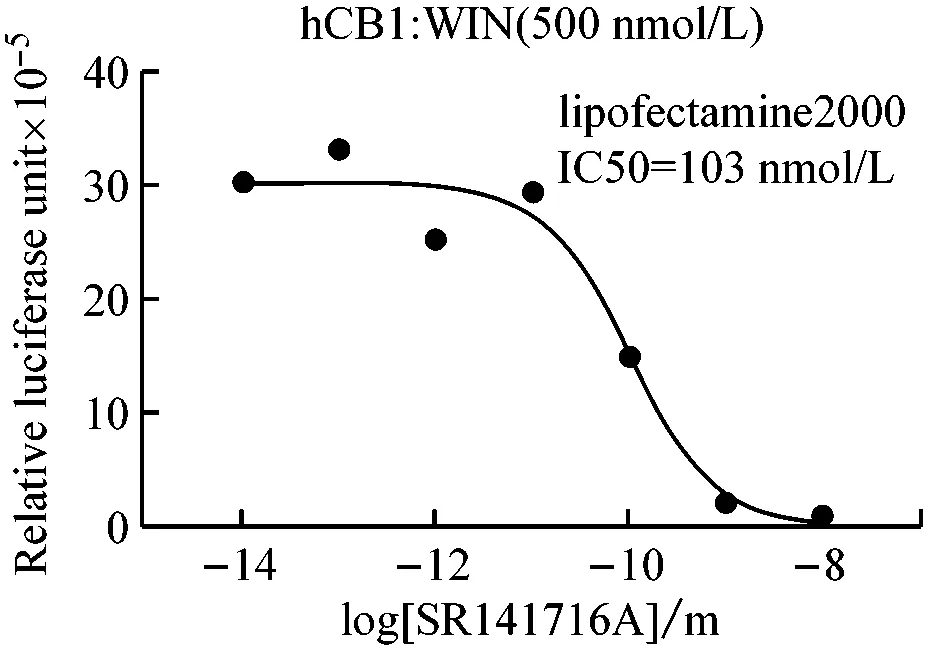


图4 不同转染方法比较
3.4 信号放大功效比较
不同孔细胞设置不同的共转染质粒比例,转染质粒总量保持相等,用以比较质粒比例与信号放大效率的关系。如图5所示,膜外信号作用曲线形状及EC50值与膜上受体及细胞内CRE质粒的拷贝数无关;但胞内CRE质粒比例越高,反应窗口越大,即信号放大倍数越大。发现和掌握这个规律,可以帮助了解细胞内信号传导的饱和状况,在进行激动剂、拮抗剂筛选或研究信号传导时,可根据需要灵活调整质粒的比例。
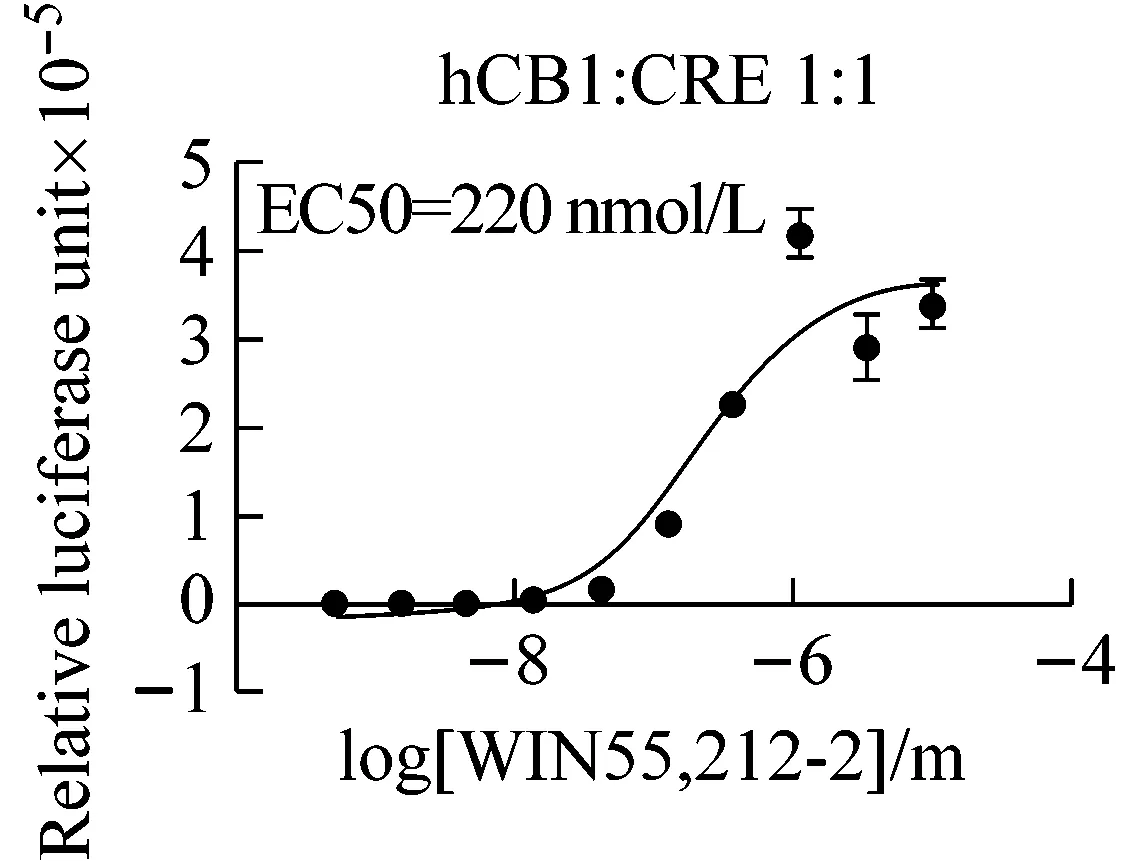


图5 不同质粒配比信号放大功效比较
4 实验安排与效果
本实验是一个涉及分子生物学、细胞生物学和生物化学的综合性实验,根据需要可安排连续4~5 d,共12~18学时完成。实验过程中设置开放性设计环节:如转染方法,质粒浓度配比,激动剂及拮抗剂的浓度梯度设置及其他学生感兴趣的环节。实验教学中特别强调对照的设置及结果的数据分析。实验从学生自己养细胞开始,一步步实践,了解细胞里面正在发生的生化事件,是个动态且完整的过程。学生普遍反映本实验趣味性高并整体收获丰富。
5 结 语
本实验将转录增强因子CRE及报告基因荧光素酶建立的GPCR功能检测应用到高级生物化学实验教学中。通过本实验,一方面学生能切身感受到膜外信号是如何通过膜受体,步步传递,直至转录增强因子及DNA转录翻译的整个过程,大大激发了学生学习实践的兴趣;另一方面,学生学习了如何利用报告基因和转录调控元件的生化原理来设计实验,开拓了学生实验设计及应用的思路。实践证明,整个实验能极大地提高学生整体综合性实验的能力,包括实验设计、数据处理、开放性探索及多种实验手段的融合,为高年级本科生进一步的科研实践奠定了很好的基础。
