一种快速检测乳与乳制品中单核细胞增生李斯特氏菌的方法
2019-12-09朱海华谭静平洋周莉胡桂芳王法云王慧王永
朱海华,谭静,平洋,周莉,胡桂芳,王法云,王慧,王永
(河南省商业科学研究所有限责任公司,郑州450002)
0 引 言
单核细胞增生李斯特菌(Listeria monocytogenes,LM)简称单增李斯特菌,肠杆菌科李斯特菌菌属,是目前已知唯一引起人类疾病的李斯特菌属致病菌[1-2]。单增李斯特菌致病性强,可导致新生儿脑膜炎、败血症、孕妇流产和死胎,病死率可达到30%以上[3-6],被世界卫生组织列为四大食源性致病菌之一[7]。目前,食品中单增李斯特菌的传统检验方法耗时长、步骤繁琐,易出现假阴性结果,危害广大消费者安全。本文选择被公认为自然界营养最为均衡的全价食品[8-9]乳与乳制品为研究对象,对样品中的单增李斯特菌进行富集分离研究,用于单增李斯特菌的快速检测。该方法操作简便、耗时短、耗费试剂和培养基少、检测灵敏度高,大大提高了乳品中单核细胞增生李斯特氏菌的检出限。
1 实验
1.1 材料
菌株:单增李斯特菌(ATCC 19115),沙门氏菌(CMCC 50115),金黄色葡萄球菌(ATCC 6548),乙型溶血性链球菌(CMCC(B)32210),福氏志贺氏菌(CMCC(B)51572),大肠埃希氏菌(8099),阪崎肠杆菌(ATCC 29544),产气肠杆菌(ATCC 13048),铜绿假单胞菌(CMCC 10104),小肠结肠炎耶尔森氏菌(ATCC 23715),由本实验室传代保存。
免疫磁珠:单增李斯特菌免疫磁珠,由本实验室自制。
培养基和试剂:磷酸盐缓冲液(PBS),缓冲蛋白胨水,LB肉汤,萘啶酮酸,吖啶黄素,李斯特氏菌显色培养基,PALCAM培养基,生化鉴定试剂盒等,dd H2O,碳酸盐缓冲液,Hanks平衡盐溶液,混合纤维素(CN-CA)滤膜,聚酰胺类滤膜尼龙(PA-66),聚醚砜(PES)滤膜,聚丙烯(PP)纤维滤膜,具塞平底玻璃杯。
1.2 仪器与设备
电热恒温培养箱DPX-9162B-2,立式压力蒸汽灭菌锅YXQ-LS-50,电子分析天平PL202-L,高速离心机UNIVERSAL 320R,旋涡振荡器,生物安全柜BSC-1500IIB2-X,磁力架,恒温水浴锅HH-S,-80℃冰箱700Series,拍击式均质器asyMix,红外接种环灭菌器 WM 350,酶标分析仪 NM-9602,真空泵P-010,抽滤装置 1 000 mL,微孔滤膜,移液器(5 000,1 000,200μL)。
2 方 法
2.1 缓冲液的选择
取10 mL乳与乳制品单增李斯特菌阳性样品,分别加入装有90 mL缓冲液的均质袋中,均质袋中缓冲液分别为:dd H2O,PBS缓冲液(浓度0.02 mol/L,p H值为7.4),碳酸盐缓冲液,李氏增菌肉汤基础LB,LB1,LB2,李氏增菌肉汤LB3+0.02 mol/L PBS(体积比1:1)。按照GB 4789.30-2016《食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验》第一法[10],对上述菌悬液进行增菌、平板分离、生化鉴定等操作,得出单增李斯特菌阳性菌数。
2.2 微孔滤膜材质和孔径的选择
分别选取混合纤维素(CN-CA)滤膜、聚酰胺类滤膜尼龙(PA-66)、聚醚砜(PES)滤膜、聚丙烯(PP)纤维滤膜,经过滤器负压抽滤对比,选择韧性较好,破损率最低的微孔滤膜用于样品中目标菌的富集。
实验中分别选取孔径为0.1,0.22,0.45,0.8,1.2μm的微孔滤膜进行富集效果验证。无菌条件下取10 mL含单增李斯特菌的乳品阳性样品,加入装有90 mL缓冲液的均质袋中,经离心去除大分子物质后,将上清液真空抽滤通过不同孔径的微孔滤膜,富集目标菌于微孔滤膜上,将抽滤后的微孔滤膜取下,洗涤,洗涤后的溶液取1 mL于李斯特氏菌显色平板,36℃分离培养48 h,计数李斯特氏菌阳性菌落数。
2.3 “低温离心+微孔抽滤”富集法的富集效果验证
无菌取乳品阳性样品10 mL,加入盛有90 mL 1∶1的李氏增菌肉汤LB3+0.02 mol/L PBS无菌均质袋中,用均质器均质1 min。均质液于2℃转速为10 000 r/min低温离心5 min,采用富集浓缩装置,0.45μm微孔滤膜抽滤样液,将微生物富集于微孔滤膜上。将微孔滤膜置于直径Φ55mm 50 mL具塞平底玻璃杯中,用5 mL洗脱液(含7 mL浓度为0.02 mol/L PBS+3 mL李氏增菌肉汤LB3冲洗浸泡,于微型振荡器震荡1 min,制备成目标菌样品浓缩液。分别取1 mL上述样品浓缩液于李斯特氏菌显色平板和PALCAM平板,36℃培养48 h,计数单增李斯特菌阳性菌落数。
2.4 洗脱液的选择
分别选择不同种类的洗脱液:10 mL PBS,10 mL LB,7 mL PBS+3 mL LB3冲洗浸泡富集有单增李斯特菌阳性菌的微孔滤膜,得到样品菌悬液。分别取1 mL上述样品菌悬液于李斯特氏菌显色平板和PALCAM平板,36℃培养48 h,做单增李斯特菌阳性菌计数,对比不同洗脱液的洗脱效果。
考虑到添加了萘啶酮酸和吖啶黄素后的李氏增菌肉汤有利于单增李斯特菌的分离和保护,因此自制了李氏增菌肉汤LB3并对其洗脱效果进行了研究。
2.5 单增李斯特菌免疫磁珠分离单增李斯特菌敏感性试验
将单增李斯特菌菌液,按一定梯度进行10倍的倍比稀释,分别取1 mL对每一浓度梯度进行平板计数。另取单增李斯特菌免疫磁珠(质量浓度5 g/L)50μL,分别加入到0.5 mL的单增李斯特菌稀释液中,充分混匀后20℃50 r/min振荡吸附10 min,静置磁力架上5 min,待磁珠充分被磁力聚集,弃上清,加入1 mL PBS+LB3(7:3)洗涤液,充分混匀,静置磁力架上8 min,待磁珠充分被吸附,弃上清,重复洗涤3次,加入1 mL PBS+LB3(7:3)洗涤液震荡后制备为样品菌悬液,吸取1 mL菌悬液涂于李斯特氏菌显色平板,36℃培养48 h,观察菌落并计数单增李斯特菌阳性菌落数。
2.6 单增李斯特菌免疫磁珠分离单增李斯特菌的特异性试验
将50μL免疫磁珠,分别加入到0.5 mL单增李斯特菌、金黄色葡萄球菌、阪崎肠杆菌、副溶血性弧菌、乙型溶血性链球菌、福氏志贺氏菌、大肠埃希氏菌、产气肠杆菌、铜绿假单胞菌、小肠结肠炎耶尔森氏菌中。充分混匀后20℃、50 rpm振荡吸附10 min,静置磁力架上5 min,待磁珠充分被磁力聚集,弃上清,加入1 mL PBS+LB3(7:3)溶液,充分混匀,静置磁力架上8 min,待磁珠充分被吸附,弃上清,重复洗涤3次,加入1mL PBS+LB3(7:3)溶液震荡后制备为样品菌悬液,吸取1 mL涂于营养琼脂平板,同时直接吸取各菌培养液1 mL涂于营养琼脂平板,36℃培养48 h,观察菌落并计数单增李斯特菌阳性菌落数。
2.7 方法验证试验
将浓度为1×109mL-1的单增李斯特菌菌液进行10倍梯度稀释,分别取1 mL稀释液加入到9 mL的乳与乳制品样品中,制备成乳与乳制品单增李斯特菌污染阳性样品。按照本文研究的方法检测,同时采用《GB 4789.30-2016》第二法[12]
进行检测对比,检测乳与乳制品阳性样品和乳与市售乳制品样品,对比检测结果。
3 结果与分析
3.1 缓冲液的选择
不同种类缓冲液对样品中单增李斯特菌的分离保护效果影响不同,实验数据如图1所示。
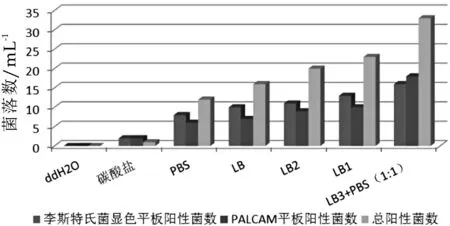
图1 不同缓冲液对单增李斯特菌分离保护效果的影响
由图1可以看出,虽然李氏增菌肉汤基础LB,LB1,LB2和浓度0.02 mol/L的PBS溶液均能有效的保护样品中的单增李斯特菌,其中LB3和浓度0.02 mol/L的PBS的混合液效果最好,分离得到的单增李斯特菌数最多。因此,选择体积比1:1的李氏增菌肉汤LB3+0.02 mol/L PBS作为前处理缓冲液最有利于单增李斯特菌的保护。
3.2 微孔滤膜材质和孔径的选择
经过滤器负压抽滤对比,聚醚砜(PES)滤膜破损率最低。不同孔径的微孔滤膜对目标菌的拦截效果也不同,结果如表1所示。

表1 微孔滤膜孔径的选择
实验发现,直径0.1μm的微孔滤膜过滤时因孔径太小,过滤速度特别缓慢,10 s后已经无法继续过滤。直径0.22μm的微孔滤膜可以过滤大部分的样品处理液,但是30 s后过滤速度下降,5 min后仍不能过滤完所有样品溶液。0.45μm、0.8μm、1.2μm的微孔滤膜均可满足过滤速度要求。但是因为0.8μm和1.2μm的微孔滤膜目标菌的富集率偏低,原因可能是单增李斯特菌的大小为0.5μm~2.0μm,孔径大的微孔滤膜目标菌通过滤膜微孔过滤至抽滤瓶中,无法富集所有的目标菌。因此,综合考虑过滤速度、富集效率等因素,采用直径0.45μm的微孔滤膜富集单增李斯特菌最佳。
3.3 “低温离心+微孔抽滤”富集法的富集效果验证
“低温离心+微孔抽滤”富集法处理样品后,单增李斯特菌培养计数结果与国家标准方法得到的技术结果对比数据如图2所示。
由图2可以看出,低温离心与微孔滤膜抽滤相结合富集样品中的目标菌单增李斯特菌较国家标准方法阳性菌的检出值高,说明该方法富集目标菌的效果较好。
3.4 洗脱液的选择
不同洗脱液的洗脱目标菌,并有效保护目标菌的效果如表2所示。

图2 富集效果验证实验

表2 不同洗脱液的洗脱效果 mL-1
由表2可看出,仅使用自制李氏增菌肉汤LB3效果并不理想,原因可能是自制李氏增菌肉汤LB3虽然有利于单增李斯特菌的保护和培养,但对于滤膜中的单增李斯特菌洗脱效果并不佳。而选用7 mL浓度0.02 mol/L的PBS溶液和3 mL的LB3的混合溶液,即可以达到洗脱的目的又可以达到保护单增李斯特菌的目的。
3.5 单增李斯特菌免疫磁珠分离单增李斯特菌敏感性实验
单增李斯特菌免疫磁珠对乳与乳制品中单增李斯特菌的富集分离敏感性实验结果如表3所示。

表3 敏感性实验 mL-1
由表3可见,利用单增李斯特菌免疫磁珠富集分离敏感性可达到10 CFU/mL,直接平板计数高出2个数量级,大大提高了单增李斯特菌的检测灵敏度和检出限。
3.6 单增李斯特菌免疫磁珠分离单增李斯特菌的特异性试验
单增李斯特菌免疫磁珠对乳与乳制品中单增李斯特菌的富集分离特异性实验结果见表4。
单增李斯特菌(ATCC 19115),沙门氏菌(CMCC 50115),金黄色葡萄球菌(ATCC 6548),乙型溶血性链球菌(CMCC(B)32210),福氏志贺氏菌(CMCC(B)51572),大肠埃希氏菌(8099),阪崎肠杆菌(ATCC 29544),产气肠杆菌(ATCC 13048),铜绿假单胞菌(CMCC 10104),小肠结肠炎耶尔森氏菌(ATCC 23715)。

表4 单增李斯特菌免疫磁珠分离单增李斯特菌特异性实验结果
经单增李斯特菌免疫磁珠富集分离乳与乳制品中的目标菌,将富集分离后的样品待测液进行直接涂布李斯特菌平板,培养后计数各类阳性菌数,发现平板上的单增李斯特菌菌落较多,其它菌经磁珠富集分离后未生长,说明单增李斯特菌免疫磁珠的吸附富集单增李斯特菌特异性良好。
3.7 方法验证实验
本文研究的乳与乳制品中单增李斯特菌检验方法与国家标准检验方法的阳性样品及市售样品检验结果对比如表5所示。

表5 与标准检验方法的对比检验结果 mL-1
由表5对比检验数据可见:(1)本文研究的快速检验方法与国标方法相比提高了检测的灵敏度,提高了乳与乳制品中单增李斯特菌的检出率和检出限,大大降低了乳与乳制品的食品安全风险。(2)该方法缩短了检测时间,国标方法每检测一个样品总耗时4~6 d,本发明的方法每检测一个样品总耗时60 min,提高了工作效率。(3)该方法操作简单,省略了恒温培养时间和生化鉴定等繁琐的操作步骤,大大节省了人力和物力。
4 结 论
单增李斯特菌作为一种常见的食源性致病菌,在冷藏温度下仍可生长繁殖,较其他致病菌污染范围更广,有“冰箱菌”之称,由其引起的散发和暴发病例主要与即食食品有关。乳与乳制品作为我国消费较多的即食食品,其安全性不容忽视。因此,提高乳与乳制品中单增李斯特菌的检测灵敏度和检出限,可以有效减少市售产品的单增李斯特菌污染率,降低乳与乳制品消费的安全风险,保护消费者食用安全。
本文通过对乳与乳制品检验时样品缓冲液的选择、目标菌富集方法的研究、富集后滤膜洗脱液的研究,以及免疫磁珠富集分离单增李斯特菌的敏感性和特异性试验,建立了一种可以有效提高乳与乳制品中单增李斯特菌检出限的快速检测方法。即缩短了检验时间和周期,又提高了检验的敏感性和灵敏度,可用于乳与乳制品生产企业对生产环节样品进行单增李斯特菌的实时监测,也可用于流通销售环节乳与乳制品的安全性抽查监督。
