新型高效纳米磁珠试剂盒在DNA检测中的应用
2022-12-30李鹏飞牛青山梁克伟王志锋
吴 婷 李鹏飞 牛青山 梁克伟 王志锋 冯 锐
(1 湖南警察学院刑事科学技术系 湖南 长沙 410138;2 苏州市公安局园区分局 江苏 苏州 215000;3 中国刑事警察学院科研处 辽宁 沈阳 110035;4 中国刑事警察学院刑事科学技术学院 辽宁 沈阳 110035;5 新海生物公司检验科 江苏 苏州 215000;6 湖南省公安厅刑事科学技术研究所 湖南 长沙 410000)
1 引言
法医DNA检验技术已成为现代科技在法医学鉴定领域的主流技术,DNA-STR分型是国内外个体识别及亲子鉴定的主要技术手段,一般包括样本DNA提取,PCR扩增和电泳分型[1]。其中,样本DNA高质量的提取是该技术的关键,特别是犯罪现场遗留样本微量时,DNA提取回收效率更是至关重要。传统的DNA提取方法大多数操作繁琐,残留的DNA提取试剂会抑制PCR扩增,并且回收效率有限,对于微量生物检材的DNA提取成功率较低。在提取纯化的过程中,若不能有效去除样品中所含有的血红素和腐植酸等PCR抑制剂,最终会抑制PCR反应的进行,直接影响效果。国内外已有许多方法应用于微量DNA的提取及纯化,其中,国内实验室目前常用的有Chelex法[2]、硅珠法[3-5]、磁珠法[6-7]、直接扩增法[8]、Microcon 100(Millipore)超滤浓缩法[9]等,其中磁珠法还有半定量作用。
Chelex法提取是最简便的方法,实验成本低,因而被普遍使用,但其容易受生物检材的影响,特别是遇到微量的、含杂质多的接触性检材,检测成功率不高。硅珠法提取原理是依托硅珠的吸附作用,对于微量的、含杂质的检材效果较好。在实验中,虽然得到的DNA比较纯,但是需要反复洗脱,易造成DNA损耗,如果检材DNA含量极少,最终会得出不能成功检测分型的实验结果。相比于前两种方法,污染严重、含抑制剂的微量检材采用磁珠法DNA提取量最高[10]。磁珠法提取DNA已经形成了成熟的自动化工作站,提取效率比较高,对于一般的检材均有效,其原理是DNA在溶液中可逆性地结合在磁珠上,所以此方法关键在于让DNA牢固吸附在磁珠上,如果吸附不全,DNA在洗涤过程中就会发生丢失,而样本中可能含有某些化学试剂会影响DNA与磁珠的结合。因此,对于原始条件脆弱且量微的接触类检材来说,实验结果更容易受到影响。直接扩增检验法虽然具有快速、简便的特点,但仍具有一定的应用局限性。该方法适用于现场检材量大的DNA快速分析,一般相对洁净的唾液斑的“直扩”样本成功率较高;而对于微量接触性检材,建议不采用直接扩增方法进行检验。Microcon 100过柱法不仅成本高于磁珠法,而且样本中一些大分子杂质如纤维、染料、灰尘等,因不能滤过而被浓缩导致抑制扩增。因此,Microcon 100超滤法对接触性DNA的提取纯化应用有限,适用于污染较轻的接触性DNA的纯化浓缩[11-12]。
基于综述,为满足目前公安实际案件检验需要,急需建立一种操作步骤简化,可有效去除PCR抑制剂,不仅适用于微量生物物证的DNA检验,而且适用于大批量样本自动化操作的DNA检测方法。本研究将从对纳米磁珠严格筛查和提取试剂的优化、操作步骤的简化、DNA模板提取方法的优化、减少抑制剂对PCR的抑制等方面,探索新型高效纳米磁珠试剂盒[13]在公安实际案件DNA检测中的应用。
2 新型高效纳米磁珠试剂盒设计方案
2.1 磁珠法提取DNA基础流程的构建
综合考虑国产磁珠的粒径、均一度、磁珠表面修饰基团、性价比等因素,并做出相关的测评和筛选,选择合适的纳米级磁珠。建立案件生物检材模型体系,准备采用人EDTA抗凝血细胞体系。加入高效裂解液迅速裂解血细胞释放核酸,而后加入与DNA高效结合的超顺磁珠及DNA吸附剂吸附核酸,置于磁分离器上,使溶液与磁珠分离,吸弃上清,再加入洗涤液震荡混匀,洗去残留的蛋白、脂质及裂解液(强PCR抑制剂),再次置于磁分离器上使溶液与磁珠分离,然后吸弃上清。重复洗涤一次后,吸弃上清65℃烘干管中残留液体,得到纯磁珠核酸复合物,加入超纯水震荡并65℃孵育15min,待磁珠上的DNA全部洗脱下来后,置于磁分离器上,分离吸取富集纯化好的核酸溶液备用,也可以不经洗脱直接将磁珠核酸复合物转移至PCR管用于扩增。
2.2 实验方案
2.2.1 优化样品回收率
建立一种样品提取回收率测试的模型。取得定量浓度的细胞液,分别加不同体积的细胞液于干净的玻片上,用棉签擦拭置于1.5mL EP管中,加入裂解液后经磁珠富集纯化,直接转移磁珠核酸复合物至PCR反应管,根据每组细胞数量算出理论上该有多少DNA拷贝,然后直接在PCR体系中加入与实验组相当的DNA拷贝数作为对照组,做荧光定量检测分析。通过优化裂解液中的相关组分的浓度和配比,如优化离液盐的种类和浓度、相关表面活性剂的种类和浓度、裂解时间、洗涤液和洗脱液的组分,得到高样品回收率。
2.2.2 优化样品灵敏度
建立样品灵敏度检测的系统模型。分别稀释各不同浓度梯度的人DNA置于棉签上放入1.5mL EP管中,再经磁珠富集纯化一整套流程得到富集纯化好的磁珠核酸复合物,将磁珠核酸复合物一起转入PCR管做荧光定量PCR的模板,使用荧光定量PCR检测分析[14]。通过优化裂解液中的相关组分的浓度和配比、洗涤液和洗脱液的组分筛选和优化,提高样品提取灵敏度。
2.2.3 优化提取时间和反应稳定性
通过优化提取各个步骤的时间,在不降低相关提取参数的情况下,缩短提取的时间;通过设计实验,将提取好的DNA放置一定时间后再进行STR检测。通过统计学分析,探索新型高效纳米试剂盒针对DNA 保存的稳定性。
2.2.4 样品适用性的检测
挑选日常案件检测中典型的检材,每种取一定量进行检测。得出每种检材的检出率,并与其他提取方法做比较。通过案件检测中大量实际的样品,对具体问题予以具体分析解决。
2.3 试剂盒操作方法及注意事项
新型纳米磁珠试剂盒采用具有独特分离作用的超顺磁珠和各具特色的缓冲液系统,试剂盒具体组成如表1所示。磁珠之所以能达到快速分离纯化核酸的目的,是因为在一定条件下,特殊包被的磁珠对目的核酸具有很强的亲和力,能从样品中分离高质量高纯度核酸;而当条件改变时,磁珠又能释放吸附的核酸。整个富集纯化过程不涉及有毒试剂,安全、便捷,提取的核酸可以应用到各类下游分子生物学实验中。本试剂盒可用于提取各种人体组织细胞、动物细胞及悬液、法医检材,也适用于核酸自动化提取平台。

表1 新型纳米磁珠试剂盒组成
2.3.1 裂解
剪取适量擦拭过犯罪现场生物检材的棉签拭子放入1.5mL EP套管中,加入100μL Lysis buffer(裂解液)及5μL protease K(蛋白酶K)混合均匀,在恒温金属浴中56℃温浴20min以上,98℃温浴5min,然后12000rpm离心5min,将上部载体套管去除,留下底部的裂解成分,进行下一步操作。
2.3.2 结合
加入震荡混匀的磁珠20μL混匀,加入200μL Binding buffer (结合液)在震荡器上混匀,静置15min待其充分结合,期间震荡2次,确保磁珠始终处于悬浮状态。将EP管置于磁力架上,连同磁力架一起颠倒3~4次,吸弃废液。
2.3.3 洗涤
加入800μL wash buffer (漂洗液),振荡均匀,然后磁分离,吸净管盖及管底的残液,重复一次;吸净管盖及管底的残液,65℃开盖干燥2min。
2.3.4 洗脱
加入30μL Elution buffer(洗脱液),震荡均匀,65℃温浴10min。然后磁分离,小心吸取上清液作为模板,进行下游实验。
2.3.5 注意事项
磁珠用前一定要充分混匀;每次加洗涤液后放在漩涡震荡器上充分震荡混匀,确保磁珠呈完全分散悬浮状态。
3 新型高效纳米磁珠试剂盒检测效果评估实验
3.1 实验材料
3.1.1 主要仪器
离心机(Eppendorf,德国)、漩涡振荡器(Eppendorf,德国)、1.5mL恒温金属浴(Eppendorf,德国)、 LC480荧光定量PCR仪(Roche,瑞士)、1.0mm打孔器(Whatman,英国)。
3.1.2 主要试剂和耗材
1.5mL EP套管(Thermo Fisher Scientific,美国)、新型高效纳米磁珠试剂盒、96孔板(BioPlastics,荷兰)、引物(上海捷瑞公司)、扩增液Mix(苏州新海生物科技有限公司)、血卡(Whatman,英国)。
3.2 方法及结果
3.2.1 磁珠的筛选实验
实验分为11组,每组重复3管,每组对应所用磁珠如下:
第1组:DynalMyOne硅烷基磁珠,Dynal Biotech ASA(挪威),产品编号和粒径 DynalMyOne(1μm);
第2组:安科羟基磁珠,温州安科纳米科技有限公司,产品编号和粒径:AK1-W200(200nm);
第3组:OMEGA,OMEGA Biotek(美国),产品编号和粒径:M6213-00(200nm);
第4组:百运羟基磁珠,上海百运纳米科技有限公司,产品编号和粒径:BCS(-OH)(200nm);
第5组:百运羧基磁珠,上海百运纳米科技有限公司,产品编号和粒径:BCS(-COOH)(200nm);
第6组:海狸羧基磁珠,苏州海狸生物医学工程有限公司,产品编号和粒径:Mag COOH(200nm~1μm);
第7组:海狸羟基磁珠,苏州海狸生物医学工程有限公司,产品编号和粒径:Mag OH(200nm~1μm);
第8组:MagnaMedics硅基磁珠 ,MagnaMedics(美国),产品编号和粒径:200nm;
第9组:MagnaMedics羧基磁珠,MagnaMedics(美国),产品编号和粒径:200nm;
第10组:奥润微磁珠,上海奥润微纳新材料科技有限公司,产品编号和粒径:SM1-015(200nm);
第11组:Corning磁珠,Corning(美国),产品编号和粒径:Axygen AxyMag(200nm);
样品均为同一张大血卡使用1.0mm打卡器打下来的1.0mm血卡,采用新型纳米磁珠试剂盒提取,各组按不同厂家磁珠加入等质量磁珠,使用新型纳米磁珠试剂盒提取纯化后,均用30μL洗脱液洗脱,取2μL洗脱液作为模板,按下列程序在LightCycle 480上扩增:95℃,10min;(95℃,15s;60℃,40s)×50循环。各实验组荧光定量Ct值及磁珠在操作中的状态如表2所示。磁珠聚沉与贴壁对比如图1所示。

图1 磁珠聚沉与贴壁对比图

表2 荧光定量Ct值及磁珠在操作中的状态显示
实验结果表明,DynalMyOne磁珠能满足实验要求,提取DNA效率高,且磁珠不易聚沉。Corning磁珠效果同样较好,但是货源供应不稳定。因此,新型纳米磁珠试剂盒的磁珠选用DynalMyOne磁珠。
3.2.2 标准品回收率测试
实验分为4组定量标准DNA样品,分别为50μL 0.5ng/μL G1471标准DNA溶液;50μL 1ng/μL G1471标准DNA溶液;50μL 2.5ng/μL G1471标准DNA溶液;50μL 5ng/μL G1471标准DNA溶液,每组重复3管,使用新型纳米磁珠试剂盒提取纯化后,用50μL洗脱液洗脱,取2μL洗脱液作为模板加入23μL荧光定量扩增液。用相同的实验设计方法改用Qiagen M48型磁珠提取试剂盒纯化,最后也用50μL洗脱液洗脱,取2μL洗脱液加入23μL荧光定量扩增液。
扩增程序:95℃,10min;(95℃,15s;60℃,40s)×50循环。
标准品:1ng/μL G1471人基因组标准DNA,2ng/μL G1471人基因组标准DNA,5ng/μL G1471,10ng/μL 人基因组标准DNA,各1μL分别加入PCR反应管并各补1μL 水。实验结果如表3所示。新型纳米磁珠与M-48型磁珠对标准品回定量折线如图2所示。

表3 针对不同浓度标准品回收率测试结果

图2 新型纳米磁珠与M-48型磁珠对标准品回定量折线图
实验结果表明,新型纳米磁珠试剂盒具有较高的回收效率,尤其是在低拷贝模板情况下,较M-48型磁珠试剂盒回收效率更高。
3.2.3 新型纳米磁珠试剂盒样本裂解环境测试
该部分实验主要针对不同裂解液与不同裂解温度对新型纳米磁珠试剂盒进行比较。用1.0mm的打卡器打相同血卡12个孔,打下来的12个1.0mm血卡作为测试样品。实验分为4组,每组3个重复。4个实验组分别为:第1组:使用低盐裂解液95℃,15min进行裂解;第2组:使用低盐裂解液56℃,20min,然后98℃,5min进行裂解;第3组:使用高盐裂解液56℃,30min,然后98℃,5min进行裂解;第4组:使用高盐裂解液95℃,15min进行裂解。使用新型纳米磁珠试剂盒进行提取纯化,最后30μL洗脱,取4μL作为模板,进行PCR,PCR循环反应条件: 95℃,11min(94℃,20s;59℃,180s)×28循环60℃,10min。毛细管凝胶电泳:甲酰胺15μL + PCR扩增样品1.5μL,实验结果如表4所示。不同裂解环境下新型纳米磁珠试剂盒STR检测图谱如图3所示。

表4 不同裂解环境对新型纳米磁珠试剂盒的影响

图3 不同裂解环境下新型纳米磁珠试剂盒STR检测图谱
实验结果表明,新型高效纳米磁珠试剂盒使用低盐先56℃处理,再98℃处理效果提取扩增更好。
3.2.4 灵敏度测试
实验分为两组,编号分别为第1组和第2组,每组取10支1.5mL EP管,各装入50μL纯水。第1组EP管里加入1μL 0.5ng/μL 9948人基因组标准DNA,第2组EP管加入1μL 0.125ng/μL 9948人基因组标准DNA,预先震荡混匀,用新型纳米磁珠试剂盒提取纯化后,不用洗脱液洗脱,直接65℃烘干后,使用25μL ID-Plus扩增液将磁珠全部转移至PCR反应管进行 PCR扩增及STR分析,实验结果如表5所示。新型纳米磁珠试剂盒纯化不同浓度DNA样本后STR检测图谱如图4所示。

图4 新型纳米磁珠试剂盒纯化不同浓度DNA样本后STR检测图谱

表5 针对不同浓度DNA新型纳米磁珠试剂盒纯化后RFU值
实验结果表明,新型纳米磁珠试剂盒提取DNA样品回收灵敏度达到125pg人类基因组。
3.2.5 血红素去除测试
实验分为4组,编号分别为第1组、第2组、第3组、第4组,每组重复3管。第1组EP管里加入30μL 纯水,第2组加入30μL 250uM血红素,第3组加入30μL 500uM 血红素,第4组加入30μL 1000uM血红素。在这4组EP管中均加入1μL 10ng/μL 9947人基因组标准DNA预先震荡混匀,用新型纳米磁珠试剂盒提取纯化后加入30μL 洗脱液洗脱。用相同的实验设计方法改用M-48型磁珠试剂盒提纯,洗脱液体积与上述一致。
取2μL洗脱液作为模板加入到23μL荧光定量PCR扩增液中进行荧光定量PCR。荧光定量PCR循环反应条件:95℃,10min;(95℃,15s;60℃,40s)×50循环。使用仪器:Roche LC480 荧光定量PCR仪。
取4μL洗脱液作为模板加入到6μL ID-plus扩增液中进行PCR。PCR循环反应条件: 95℃,11min(94℃,20s;59℃,180s)×28循环60℃,10min。毛细管凝胶电泳:甲酰胺15μL + PCR扩增样品1.5μL。实验结果如表6~7所示。新型纳米磁珠试剂盒纯化不同浓度血红素后STR检测图谱如图5所示,M-48磁珠试剂盒纯化不同浓度血红素后STR检测图谱如图6所示。

图5 新型纳米磁珠试剂盒纯化不同浓度血红素后STR检测图谱

图6 M-48磁珠试剂盒纯化不同浓度血红素后STR检测图谱
实验结果表明,新型纳米磁珠试剂盒对血红素的去除能力等于或优于M-48型磁珠试剂盒。
3.2.6 腐殖酸去除测试
实验分为4组,编号分别为第1组、第2组、第3组、第4组,每组重复3管。第1组EP管里加入30μL纯水,第2组加入30μL 25ng/μL腐殖酸,第3组加入30μL 50ng/μL腐殖酸,第4组加入30μL 100ng/μL腐殖酸。在这4组EP管中均加入1μL 10ng/μL 9947人基因组标准DNA预先震荡混匀,用新型纳米磁珠试剂盒提取纯化后加入30μL 洗脱液洗脱,取2μL洗脱液作PCR荧光定量扩增。用相同的实验设计方法改用M-48型磁珠试剂盒提纯,洗脱液体积与上述一致。

表7 新型纳米磁珠与M-48型磁珠去除血红素后RFU值
取2μL洗脱液作为模板加入到23μL荧光定量PCR扩增液中进行荧光定量PCR。荧光定量PCR循环反应条件:95℃,10min;(95℃,15s;60℃,40s)×50循环。使用仪器:Roche LC480 荧光定量PCR仪。
取4μL洗脱液作为模板加入到6μL ID-plus扩增液中进行PCR。PCR循环反应条件:95℃,11min(94℃,20s;59℃,180s)×28循环60℃,10min。毛细管凝胶电泳:甲酰胺15μL + PCR扩增样品1.5μL。实验结果如表8~9所示。新型纳米磁珠试剂盒纯化不同浓度腐殖酸后STR检测图谱如图7所示,M-48型磁珠试剂盒纯化不同浓度腐殖酸后STR检测图谱如图8所示。

表8 新型纳米磁珠与M-48型磁珠法去除腐殖酸荧光定量Ct值

表9 新型纳米磁珠与M-48型磁珠法去除腐殖酸后RFU值

图7 新型纳米磁珠试剂盒纯化不同浓度腐殖酸后STR检测图谱

图8 M-48型磁珠试剂盒纯化不同浓度腐殖酸后STR检测图谱
实验结果表明,新型纳米磁珠试剂盒对腐植酸的去除能力与M-48型磁珠试剂盒相当。
3.2.7 稳定性测试
将人类基因组模板9948 1ng/μL 分别使用新型纳米磁珠试剂盒洗脱液,M-48型磁珠试剂盒洗脱液,硅珠[3]60-61洗脱液来稀释,稀释至样品浓度为0.2ng/μL , 0.1ng/μL, 0.05ng/μL。样品均存放在4摄氏℃冰箱中,分别隔0天,1天,2天,5天,10天,20天各取1μL作为模板,加入到ID plus 体系中进行扩增,每组做四个平行对照。扩增产物进行毛细管电泳。比较三者的扩增情况,实验结果如表10~12所示。针对标准品采用三种磁珠纯化方法洗脱体系的STR检测对照图,如图9~14所示。

表10 0.2ng标准品三种磁珠纯化方法洗脱体系的稳定性测试结果

表11 0.1ng标准品三种磁珠纯化方法洗脱体系的稳定性测试结果

表12 0.05ng标准品三种磁珠纯化方法洗脱体系的稳定性测试结果

图9 0.2ng 4℃保存20天

图10 0.1ng 4℃保存20天

图11 0.05ng 4℃保存20天

图12 0.05ng 4℃保存20天新型纳米磁珠

图13 0.05ng 4℃保存20天M48磁珠

图14 0.05ng 4℃保存20天硅珠法
实验结果表明,新型纳米磁珠试剂盒洗脱液保存的模板可以在4℃条件下保存20天而仍能有效分型。新型纳米磁珠洗脱液稀释的样品在存放20天后,扩增效果优于其他实验组。
3.3 新型纳米磁珠试剂盒与其他磁珠类试剂盒比较
3.3.1 与M-48型磁珠试剂盒比较
取10张陈血卡,同一张血卡打6个0.8mm孔。分别标记为A1至A10,B1至B10, C1至C10, D1至D10,E1至E10,F1至F10;A,B,C系列30个样品用新型纳米磁珠试剂盒纯化,D,E,F系列30个样品用M-48型磁珠试剂盒纯化。其中,A系列与D系列均用100μL 洗脱液洗脱,取4μL上清作为模板;B系列与E系列均用100μL 洗脱液洗脱,将洗脱液与磁珠混匀后取4μL作模板;C系列与F系列最后烘干后不加洗脱液,使用25μL的ID-plus扩增液转移全部磁珠作为模板。实验结果如表13所示。新型纳米磁珠法STR检测图谱如图15所示,M48型磁珠法STR检测图谱如图16所示。
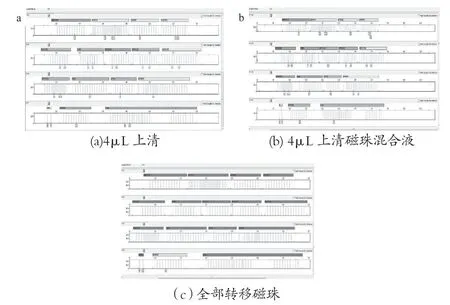
图16 M48型磁珠法STR检测图谱

表13 新型纳米磁珠与M-48型磁珠处理后RFU值

图15 新型纳米磁珠法STR检测图谱
实验结果表明,新型纳米磁珠试剂盒可以使用洗脱液洗脱进行扩增,也可以不洗脱将烘干后的全部磁珠转移至PCR扩增液中进行PCR,起到富集样本的作用。而M-48型磁珠磁珠试剂盒转移磁珠会抑制PCR反应导致扩增失败。
3.3.2 与国产东胜磁珠试剂盒比较
取10张陈血卡,同一张血卡打4个0.8mm孔。分别标记为A1-A10,B1-B10,C1-C10,D1-D10;A,B系列20个样品为新型纳米磁珠试剂盒纯化;C,D系列20个样品用东胜磁珠试剂盒按照其说明书步骤纯化。其中A系列与C系列均用100μL洗脱液洗脱,取4μL上清作为模板;B系列与D系列均用100μL 洗脱液洗脱,将洗脱液与磁珠混匀后取4μL磁珠洗脱液混合液作模板。实验结果如表14所示,新型纳米磁珠与国产东胜磁珠试剂盒STR检测图谱如图17所示。
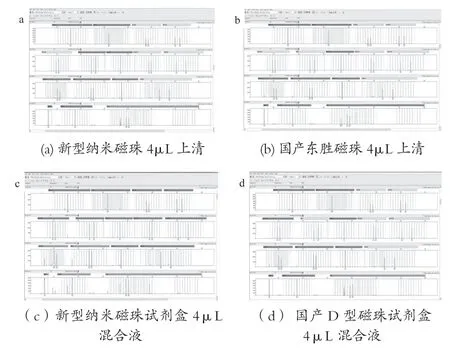
图17 新型纳米磁珠与国产东胜磁珠试剂盒STR检测图谱

表14 新型纳米磁珠与国产东胜磁珠纯化后RFU值
实验结果表明,新型纳米磁珠试剂盒提取效果优于国产东胜磁珠试剂盒。
4 新型高效纳米磁珠试剂盒应用测试
4.1 不同常规检材测试实验
实验分为4组,第1组样品1.0mm血卡,第2组1.0mm唾液卡,第3组1mm 精斑,第4组1.0mm烟头,每种样品重复10个,使用TECAN自动化工作站,参照新型纳米磁珠试剂盒操作说明书提取纯化后,50μL 洗脱液洗脱。以相同的样品量与洗脱体积,分别用M-48型磁珠提取试剂盒及东胜磁珠提取试剂盒提取上述样品,按各自说明书操作,使用TECAN自动化工作站,使用同样的洗脱液体积。
取4μL作为模板,进行PCR,PCR循环反应条件:95℃,11min(94℃,20s;59℃,180s)×28循环60℃,10min。毛细管凝胶电泳:甲酰胺15μL+ PCR扩增样品1.5μL。实验结果如表15所示,3种磁珠试剂盒纯化后STR检测图谱如图18~20所示。
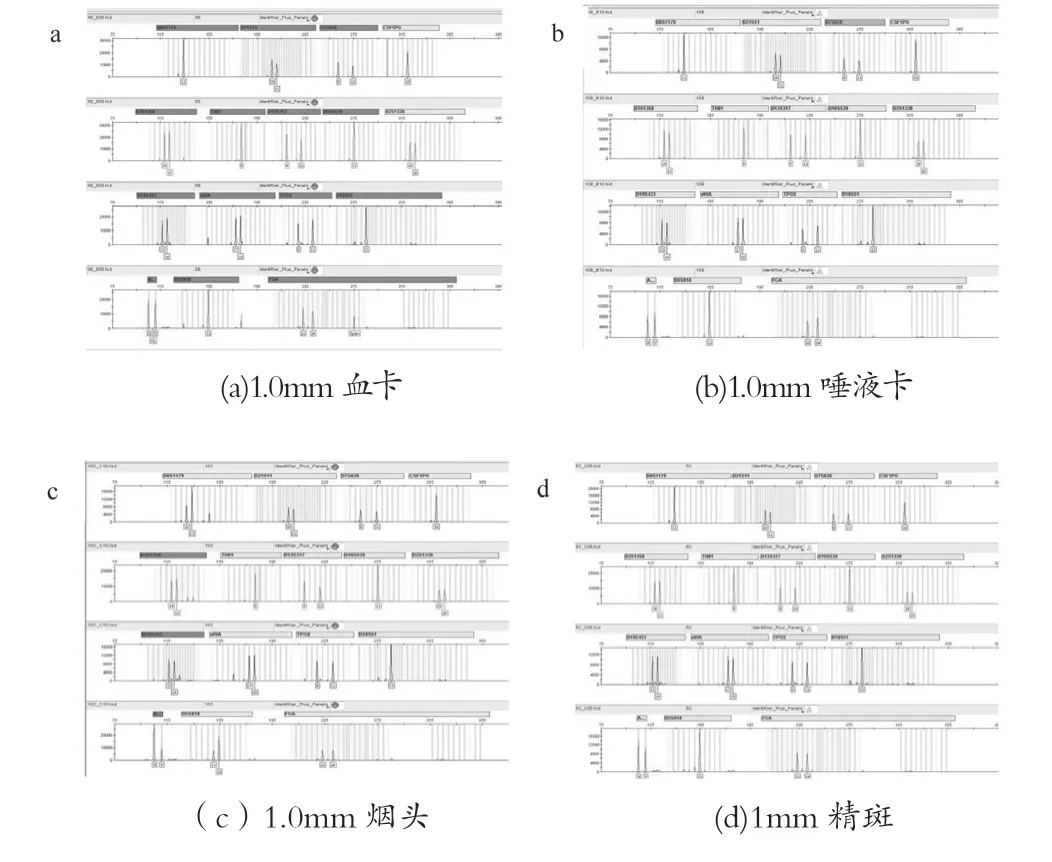
图18 常规检材新型纳米磁珠试剂盒纯化后STR检测图谱

表15 3种磁珠试剂盒纯化后检测RFU值
实验结果表明,新型纳米磁珠试剂盒在上述4种检材中使用自动化工作站提取效果优于其他两种试剂盒。
4.2 实际案件不同擦拭检材测试实验
实际案件擦拭物作为样品,使用TECAN自动化工作站,参照新型纳米磁珠试剂盒操作说明书提取纯化后,30μL洗脱液洗脱。取4μL作为模板,进行PCR,PCR循环反应条件:95℃,11min(94℃,20s;59℃,180s)×28循环60℃,10min。毛细管凝胶电泳:甲酰胺15μL + PCR扩增样品1.5μL,实验结果如表16所示。实验结果表明,实际案件微量生物检材检出效果良好。
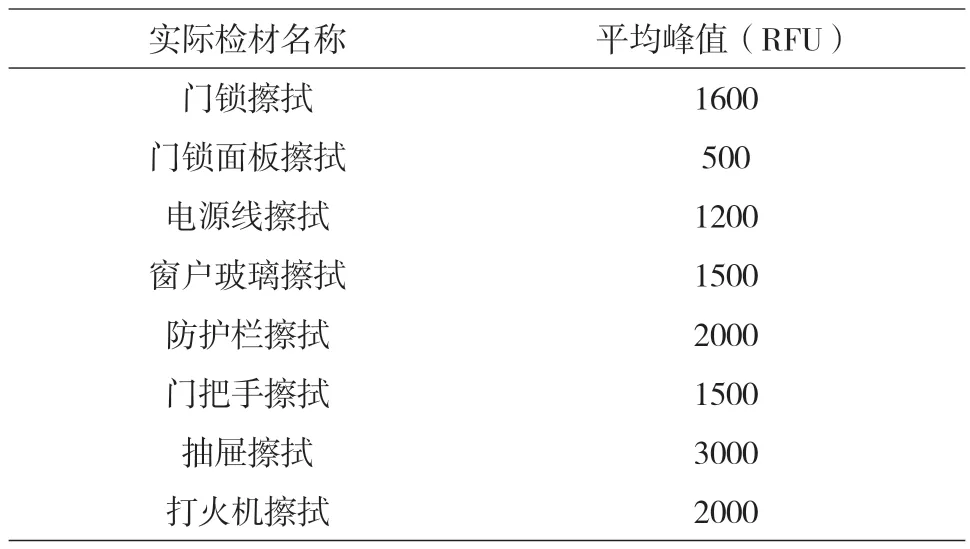
表16 新型纳米磁珠试剂盒对实际案件擦拭物的检验效果

图19 常规检材M-48磁珠试剂盒纯化后STR检测图谱
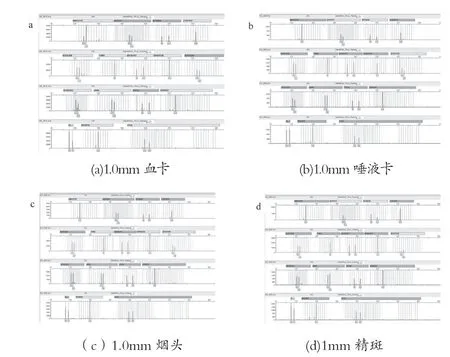
图20 常规检材国产东胜磁珠试剂盒纯化后STR检测图谱
5 结论
(1)通过对不同DNA提取试剂盒进行了灵敏度、样品回收率、抗腐植酸、血红素等PCR抑制剂的能力、样品回收后的稳定性、带磁珠扩增对微量DNA的检测比较,结果表明:①新型高效纳米磁珠试剂盒具有较高的回收效率,尤其是在低拷贝模板情况下,较M-48型磁珠回收效率更高;②新型高效纳米磁珠试剂盒可以对至少125pg的人基因组DNA进行提取纯化并进行扩增分型;③新型高效纳米磁珠试剂盒对血红素、腐殖酸等抑制剂的去除能力与M-48型磁珠试剂盒相当,都能去除大量的PCR抑制剂;④新型高效纳米磁珠试剂盒对烟蒂、血斑、精斑等常规检材40份的检出率达到100%;⑤新型高效纳米磁珠试剂盒对样品回收后DNA保存稳定性高,4℃下存放1个月能够有效检出;⑥新型高效纳米磁珠试剂盒能够适用于自动化工作站大批量、快速操作;⑦新型高效纳米磁珠试剂盒通过25μL带磁珠扩增体系实现对微量DNA的高检出率,能将所有提取到的DNA完全进行PCR扩增,极大地提高了检出率。
(2)具备自主知识产权,成本可控,可进一步推广至全国范围内法医检测市场,以及生物、医疗研发机构,具有良好的社会效益和广阔的市场前景。目前,公安系统提取生物物证DNA广泛采用磁珠法,一方面,主要采用进口试剂,如Qiagen公司生产的M-48磁珠提取试剂盒及Qiacube硅膜提取试剂,均为公安实战中使用较为广泛的纯化试剂盒。但在实际应用中,进口试剂盒操作步骤繁琐、耗时较长,相关的设备和耗材均为进口配套产品,高昂的检测成本也限制了其在经济欠发达地区日常案件中的应用。另一方面,主要是国产的磁珠DNA提取试剂盒,如东胜磁珠试剂盒、博坤磁珠试剂盒。在实际应用中,国产试剂又存在DNA提取回收率低,磁珠上DNA不容易完全释放、质量不稳定等问题。通过对市面上11种知名厂家的优质基础纳米磁珠进行筛选,优化试剂,成功研制出了具有高回收效率的新型纳米磁珠试剂盒,并且该试剂盒可以通过转移全部磁珠的方法进行扩增,极大地提高了对微量案件检材的检出率。新型高效纳米磁珠试剂盒已在一些公安机关实验室日常的案件检验中使用,并取得了良好的检验效果。
(3)带磁珠扩增体系实现对微量DNA的高检出率,同时可用于处理大批量样本,满足自动化操作的需要。传统的DNA提取方法常涉及去垢剂裂解、蛋白酶处理、有机溶剂提取及乙醇沉淀等步骤,不但操作繁琐,而且DNA提取中所用的去垢剂裂解、蛋白酶、有机溶剂等残留试剂抑制PCR扩增,降低DNA检出率;大批量样本检测过程中,繁杂的操作步骤也会增加样本间交叉污染的风险。通过研究新型纳米磁珠对样本DNA进行富集,采用25μL带磁珠扩增体系,不仅能有效地扩增微量检材DNA,同时通过优化磁珠法提取DNA操作步骤,简便易行且适合机器语言,可满足自动化操作的需要,可以同时处理大批量样本,工作效率大大提升。
综上所述,新型高效纳米磁珠试剂盒出色的样品回收率、PCR抑制剂去除能力、样品回收后DNA保存的稳定性,已经超越DNA实验室传统常规的磁珠纯化试剂盒。新型高效纳米磁珠试剂盒成本可控,检测效率高且稳定,可以极大地提高疑难检材的检出率,尤其是针对微量生物物证检材具有很好的检测效果,可为侦查办案提供有力的证据。
6 不足与展望
(1)对于目前市面上常用的磁珠类型,本研究仅从市面上常用的11种磁珠筛选出满足试剂盒要求的磁珠类型——DynalMyOne,该磁珠不易聚沉且提取DNA效率高。未来可进一步探究每种磁珠大小和结构组成,得出磁珠大小与结构对DNA提取检测效率影响的原因,进而深入探索适用于公安实践中不同检材DNA纯化的磁珠种类,将试剂盒做全做细做精,做到“关键核心技术牢牢掌握在自己手中”,加快公安科技创新,全面实现试剂盒国产自主化。
(2)本研究没有进行检材预处理方式对试剂盒纯化效果影响的探讨。未来可以考虑针对检材材质进行分类,如光滑客体、粗糙客体、渗透性客体、非渗透性客体等,并设置几种合理的预处理方式,如剪取法、擦拭法、粘取法、吸附法[15]等,再利用新型高效纳米磁珠试剂盒进行纯化比较STR检测效果,得出针对某类检材使用新型高效纳米磁珠试剂盒进行纯化之前最合适的预处理方式,全面提高微量生物物证DNA检测率和成功率。
(3)新型高效纳米磁珠试剂盒用于检测陈旧性微量生物物证的实际案例较少。本研究中涉及实际案例生物物证检材种类相对简单、常规,未来可进一步开展相关模拟实验,尤其是对于陈旧性的微量生物物证展开技术攻坚,针对不同种类的检材模拟陈旧性检材保存时长和环境进行实验,探索适用于不同陈旧性生物检材种类、保存时长及保存环境的纯化试剂盒,针对陈旧性生物检材提前优选预处理方式和DNA提取纯化方法,做到DNA精准纯化,提高陈旧性疑难生物物证DNA检测成功率。
(4)针对PCR 抑制剂的去除实验,本研究主要探讨了血红素及腐殖酸两大主要抑制剂的去除效果,实际案件中的抑制剂种类繁杂多样,未来可进一步模拟实际案件中常见的PCR抑制剂环境,探讨新型纳米磁珠试剂盒针对如铁锈、油污、染料、果酸等抑制剂的去除效果。
(5)针对磁珠核酸提取的实验步骤,可以深入优化现有的自动化实验平台。微流控芯片由于其集成化和低消耗的特点,在PCR核酸提取实验中得以广泛运用,在磁珠法核酸提取微流控系统上使用超声振动微混合器对磁珠生物混合液进行混合,利用超声振动的能量集中、频率高的优点,提高磁珠的混合效率,缩减混合时间,从而加快核酸提取效率。搭建基于运用超声振动微混合器的磁珠法核酸提取微流控系统的自动化实验平台无疑是一个优化方向[16]。
(6)本研究中多个实验均涉及DNA标准品的使用,分别为标准品回收率测试使用0.5ng/μL G1471标准DNA溶液;灵敏度和稳定性测试使用0.5ng/μL 9948人基因组标准DNA;血红素和腐殖酸去除实验使用10ng/μL9947标准DNA溶液。尽管使用了3种不同厂家标准品,但对于同一类型的实验采用的是同一种标准品,对于最终实验结果的影响相对较小。但今后的实验中应尽量避免类似情况,控制单一变量,将影响因素控制到最小。
