冷冻消融术治疗Lewis肺癌小鼠移植瘤侵袭转移的实验研究
2019-12-06孙满强胡凯文何乐毅凡庞皓玥李龙宇
孙满强,胡凯文,陈 琪,何乐毅凡,庞皓玥,李龙宇,周 天
冷冻消融术作为一种新兴的微创治疗技术具有低损伤、可重复的优点,目前冷冻消融术复温常采用两种复温范围,分别是20 ℃~40 ℃和0 ℃~15 ℃,术者在复温选择时常常依据经验和习惯。当前关于冷冻消融机制的研究多体现在免疫方面,冷冻消融术不具有扩大型手术的特性,关于术后不同复温温度对残存瘤的侵袭性和转移性影响的实验研究较少。碱性-环-螺旋蛋白(Twist)是编码位于常染色体的碱性-环-螺旋DNA结合转录因子,在正常胚胎发育中调控细胞运动及组织重组,因其被发现在肿瘤转移过程中起关键调控作用而备受关注,可调控上皮—间充质细胞转化(epithelial mesenchymal transition,EMT)和血管新生[1]。该实验采用免疫组化法检测Twist、钙黏附蛋白E(E-Cadherin)、血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白的表达,探究冷冻消融术后冰球复温温度与残存瘤侵袭转移能力的关系。
1 材料与方法
1.1 动物和瘤株45只SPF级C57BL/6小鼠,4~5周龄,购自北京华阜康生物科技有限公司,动物许可证号:SCXK(京)2014-0004。Lewis肺癌小鼠细胞(lewis lung cancer,LLC)购自美国CA公司。LLC细胞用含10%FBS(英国Biochrom公司)的RPMI1640培养基(美国Corning公司)进行培养,放置于37 ℃、5%CO2培养箱中。待细胞生长状态最佳时进行收集,用完全培养基将细胞浓度调整为1×107/ml,对小鼠进行皮下注射造模。
1.2 主要仪器和试剂冷冻消融术采用海杰亚CHS 800001手术系统,购自北京海杰亚医疗器械有限公司;Leica2135石蜡病理切片机、Leica病理组织包埋机购自德国Leica公司;显微镜购自日本Olympus公司;Anti-Twist单克隆抗体购自美国Abcam公司;Anti-E-Cadherin单克隆抗体、Anti-VEGF-A单克隆抗体、Anti-VEGF-C单克隆抗体、羊抗兔/鼠IgG H+L抗体(二抗)购自美国Proteintech公司。
1.3 造模取100 μl细胞悬液(106个细胞)皮下注射于45只小鼠右侧背部。密切观察小鼠生长状况。
1.4 超低温冷冻消融术造模24 d后,将45只荷瘤小鼠随机分为3组,分别为对照组、复温至0 ℃组(T0组)、复温至40 ℃组(T40组),每组15只。对照组未予任何干预,T0组予100 mg/kg戊巴比妥钠腹腔注射麻醉小鼠,固定后,备皮,消毒,采用海杰亚冷冻消融设备实行冷冻手术。将1.66 mm冷冻刀头插入肿瘤中央,采用单循环冷冻方法,当冷冻范围到达癌旁组织时开始升温,直到肿瘤中心温度到达0 ℃,停止复温,拔出探针。T40组操作如上,当肿瘤中心温度达到40 ℃时,拔出探针。冷冻消融术第1天记为第0天(Day0,D0)。
1.5 取材小鼠的体质量每隔1 d记录1次,在术后第14天(D14)进行脱颈处死,剥离肿瘤并进行称重,计算肿瘤抑制率=([对照组平均肿瘤重量]-[实验组平均肿瘤重量])/[对照组平均肿瘤重量]×100%。肿瘤称重后放入4%多聚甲醛固定,石蜡包埋,用于免疫组化检测。
1.6 免疫组化染色法检测取包埋后的组织修剪边缘后装入切片机作4 μm切片,烘箱过夜进行脱蜡,脱蜡后将标本进行阻断内源性过氧化物酶,PBS冲洗后将标本架置于pH 9.0 抗原修复液中进行修复(置于微波炉中高火7 min,中低火15 min),用自来水复温后取适量Anti-Twist抗体用一抗稀释液稀释至合适浓度(稀释浓度1 ∶100)孵育标本30 min,冲洗后滴加二抗孵育20 min,最后进行DAB显色,封片后用显微镜观察Twist蛋白表达及分布(按照抗体说明书及文献,Twist阳性表现为胞核出现黄色或棕色的颗粒状物质沉积)。Twist蛋白表达水平以平均光密度值(Image Pro Plus 6.0软件分析图像所得)表示。同理,按照上述实验方法进行E-Cadherin、VEGF-A、VEGF-C蛋白检测。

2 结果
2.1 小鼠冷冻消融术后体质量比较对小鼠术后各时间段体质量进行统计分析,见表1。对照组小鼠体质量大于T0组和T40组(P<0.05),T0组与T40组之间比较,差异无统计学意义。
2.2 各组小鼠肿瘤质量及抑瘤率计算对照组肿瘤质量大于T0组和T40组(P<0.05),T0组平均肿瘤抑制率为25.14%,T40组平均肿瘤抑制率为15.85%,T0组与T40组之间比较,差异无统计学意义,见表1。
2.3 各组肿瘤组织中Twist、E-cadherin、VEGF-A、VEGF-C蛋白的表达免疫组化染色结果显示,高倍镜下观察,用细胞内棕黄色强弱来判断肿瘤细胞内蛋白表达的高低,结果以平均光度值来表示。T0组Twist表达低于对照组(P<0.05),T40组Twist表达低于对照组(P<0.05),T0组与T40组之间比较,差异无统计学意义。T0组E-Cadherin表达高于对照组(P<0.05),T40组E-Cadherin表达高于对照组(P<0.05),T0组与T40组之间比较,差异无统计学意义。T0组VEGF-A表达低于对照组(P<0.05),T40组VEGF-A表达低于对照组(P<0.05),T0组与T40组之间比较,差异无统计学意义。T0组VEGF-C表达低于对照组(P<0.01),T40组VEGF-C表达低于对照组(P<0.05),T0组与T40组之间比较,差异无统计学意义。见图1、2。
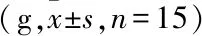
表1 各组小鼠体质量和肿瘤质量变化
与对照组比较:*P<0.05
3 讨论
冷冻消融手术具有安全、有效、微创、副作用小等优点,目前已广泛应用于中晚期肺癌、肝癌、肾癌、前列腺癌等恶性肿瘤的治疗[2-3]。当前国内外关于氩氦刀抗肿瘤效应的机制研究主要体现在溶解效应、凋亡效应、微血栓形成和免疫效应4个方面[4-8]。0 ℃以上的复温温度均可使冰球融化,但是不同复温温度是否会对残存瘤侵袭转移产生影响的相关研究较少。
当前研究[9-10]表明,EMT和血管新生是肿瘤侵袭转移的重要环节。EMT过程可使具有极性特点的上皮细胞转化为可移动的间质细胞,利于肿瘤的侵袭和转移[9]。E-Cadherin减少是EMT过程中的重要表现[11-12]。肿瘤组织血流供应增强是肿瘤恶性程度的重要标志,VEGF具有促内皮细胞生长、增加血管通透性,以及协助肿瘤细胞进入脉管系统等作用[13]。VEGF-A主要促进血管内皮新生,VEGF-C主要促进淋巴管内皮新生。而Twist蛋白对于E-Cadherin 和VEGF均有调控作用,Twist在多种人类肿瘤中表达上调,并直接导致E-cadherin表达下调,致使上皮细胞间黏附力降低,细胞失去上皮特征、从原位脱落、运动能力加强,并在侵袭带形成伪足、组装张力丝并召集细胞基质降解酶,为侵袭转移提供了必要前提[10]。转染Twist的肿瘤细胞可增加VEGF的表达,促进肿瘤微血管、微淋巴管生成,而通过小干扰RNA(small interfering RNA,siRNA)下调Twist则可见VEGF表达量下降,通过RT-PCR检测得其mRNA呈同样变化趋势[14]。由此得知Twist、E-Cadherin、VEGF是肿瘤侵袭转移过程的重要蛋白,而E-Cadherin和VEGF的表达受Twist调控。

图1 各组肿瘤组织免疫组化结果 ×400
图2 各组肿瘤组织中Twist平均光密度值 与对照组比较:*P<0.05
本实验结果显示,实验组小鼠在手术之后体质量减少,这与剪开皮毛,暴露肿瘤的手术损伤有关。对照组肿瘤质量大于T0组和T40组(P<0.05),表明冷冻消融术对肿瘤起到抑制作用。进一步行免疫组化发现,相比对照组,T0组和T40组的Twist、VEGF-A、VEGF-C蛋白表达降低,E-Cadherin蛋白表达增高(P<0.05)。T0组和T40组在肿瘤抑制率和相关蛋白表达方面差异虽无统计学意义,但T0组在各项数据统计方面均优于T40组。由此得出:冷冻消融术后0 ℃复温相较于40 ℃复温对于肿瘤的侵袭性和转移性具有更好的抑制作用,其机制与抑制上皮间质转化和肿瘤血管新生两个过程有关。氩气和氦气是稀有气体,具有很高的价值性和战略性,0 ℃复温符合环保节能的原则,此实验结果对于氩氦刀术后复温温度选择具有一定指导意义。本研究只从组织层面对实验目的进行验证,缺少基因转录层面的验证,并且肿瘤的表观层面缺乏更强的说服性,以上是本实验的不足和待改进之处。除此之外,冷冻消融对肿瘤微环境的影响是多方面的,以上只是从转移角度进行探索,在炎症、免疫方面的探索将是后续的研究方向。
