电压门控钾离子通道3.4亚基调控口腔鳞状细胞癌的侵袭和增殖
2019-12-06钱成炜戴永铮
钱成炜,戴永铮,蒋 勇
Kv3.4是位于细胞膜上的电压门控钾通道,属于Shaker型钾通道蛋白。以前的研究[1-2]表明,Kv3.4在头颈部鳞状细胞癌中高表达。基质金属蛋白酶(matrix metalloproteins,MMPs)的主要功能是降解细胞外基质,维持细胞外基质的动态平衡。基质金属蛋白酶9(matrix metalloprotein 9,MMP-9)可以水解肿瘤细胞外基质并调节细胞黏附,这与肿瘤侵袭密切相关[3]。Caspase-3是Caspase家族中最重要的蛋白之一,是凋亡的主要执行者。它的激活表明细胞凋亡已进入不可逆转的阶段[4]。尽管研究[5]表明Kv3.4在口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)中高表达,但其与OSCC发展和特定分子机制的关联仍有待进一步研究。基于此,本研究假设Kv3.4与肿瘤的侵袭、增殖和凋亡密切相关,并推测Kv3.4通过调节细胞周期,干扰MMP-9表达和激活Caspase-3来实现上述功能。
1 材料与方法
1.1 主要实验试剂血清购自以色列Biological Industries公司;青霉素-抗生素、RIPA裂解液、蛋白酶抑制剂、磷酸酶抑制剂、BCA试剂盒、cyclin D1一抗、cyclin E1一抗、caspase-3一抗、细胞周期试剂盒购自江苏碧云天生物技术有限公司;DMEM购自美国Hyclone公司;共聚焦培养皿、Transwell小室购自美国Corning公司;siRNA-KCNC4、siRNA-NC购自上海吉玛公司;lipofectamine 2000购自美国Thermo Fisher Scientific公司;PVDF膜、超敏显影液购自德国Millipore公司;Kv3.4一抗购自英国Abcam公司;MMP-9一抗购自武汉赛维尔生物科技有限公司;β-actin一抗、二抗购自北京中杉金桥生物技术有限公司;RNA试剂盒购自日本Takara公司;PCR引物购自上海生物工程股份有限公司;CCK-8试剂购自日本同仁公司;细胞凋亡试剂盒购自上海贝博公司。
1.2 方法
1.2.1细胞培养 OSCC细胞株SCC3来自安徽省口腔重点实验室。取对数生长期的细胞置于含有10%胎牛血清和1%青霉素-链霉素溶液的DMEM中,在37 ℃、5% CO2培养箱中培养,每2~3 d换液,待细胞达到80%汇合度时传代培养。
1.2.2SCC3细胞的免疫细胞化学和荧光成像 在共聚焦培养皿中接种2×105个细胞,培养24 h,使用PBS洗涤3次后,使用4%冷多聚甲醛固定30 min,加入1 ml 0.5% TritonX-100,置于摇床上轻摇10 min,用1% BSA封闭30 min。一抗孵育过夜,二抗避光孵育2 h,加入4′,6-二脒基-2-苯基吲哚荧光染料(DAPI),5 min后使用激光共聚焦显微镜观察。
1.2.3si-RNA转染 NCBI上查找KCNC4序列,设计合成3条具有KCNC4的干扰RNA(small interfering RNA,siRNA),阴性对照siRNA(siRNA-NC)(引物序列见表1),转染前18 h,将2×105个细胞接种在不含抗生素培养液的6孔板中,在转染时,将培养基替换为无血清培养基。取5 μl/孔siRNA,使用245 μl的DMEM稀释,室温静置5 min,取10 μl的lipofectamine 2000,使用240 μl的DMEM稀释,室温静置5 min,将两者混匀,静置20 min,然后加入细胞培养皿中。6 h后,将培养基更换为含10%血清的DMEM,细胞在37 ℃、5% CO2培养箱中继续培养。将正常培养的SCC3细胞命名为control组,将添加等量的lipofectamine 2000,消除转染试剂的干扰的SCC3细胞命名为mock组,将转染阴性对照试剂的SCC3细胞命名为Si-NC组,将转染3组siRNA-KCNC4分别命名为s1、s2、s3组。
1.2.4逆转录定量实时PCR 转染后48 h,使用TRIzol试剂从SCC3细胞中分离总RNA。根据制造商指南,使用RNA试剂盒合成cDNA。正向引物序列:5′-AGTTCCTGCTGCTTATCATCTTCC-3′,反向引物序列:5′-TCTTGAAGTCGGTGTGGTCATTAC-3′。将2 μl cDNA、10 μl SYBR和1.6 μl特异性引物混合以构建RT-qPCR反应系统,并添加ROX以校正孔间误差。反应条件为:95 ℃、2 min,95 ℃、5 min,95 ℃、30 s,75 ℃、30 s,重复35个循环。采用2-ΔΔCT法比较分析基因表达。
1.2.5蛋白质印迹 转染后72 h,使用含有PMSF、磷酸酶抑制剂和蛋白酶抑制剂的RIPA裂解物裂解细胞,4 ℃、12 000 r/min离心后提取蛋白质,使用BCA试剂盒测量蛋白质浓度,通过8% SDS-PAGE(MMP-9,Kv3.4)、10% SDS-PAGE(capase-3,cyclin D1,cyclin E1)分离已定量的蛋白质,并转移至PVDF膜上。使用含有5% BSA的TBS-Tween 20封闭2 h,一抗孵育过夜,将经过一抗孵育的PVDF膜与二抗孵育1 h,随后使用ECL超敏发光试剂盒检测蛋白。
1.2.6CCK-8增殖实验 转染24 h后,用胰蛋白酶消化细胞,将1×104个细胞接种到96孔板中,待细胞贴壁后,分别培养12、24、48、72 h,每孔加入10 μl CCK-8并孵育1 h,酶标仪测量450 nm波长下的OD值,每个样本做5个复孔实验,根据OD值绘制0、24、48、72 h增殖曲线。
1.2.7细胞凋亡实验 转染48 h后,使用胰蛋白酶消化,收集5×106个细胞,并用PBS洗涤3次。细胞使用Annexin V-FITC染色20 min后,再使用PI染色5 min,使用流式细胞仪进行检测和分析。Annexin V-FITC染色的细胞为早期凋亡细胞,PI染色的细胞为晚期凋亡细胞。
1.2.8基质胶侵袭测定 转染24 h后,用胰酶消化细胞,收集计数后用无血清培养基重悬,密度为4×104,接种于transwell上室,上室内预先铺设50 μl、1.25 mg/ml基质胶。用含有10% FBS的DMEM 600 μl填充transwell下室。将24孔板在37 ℃、5%CO2培养箱中孵育24 h。擦拭未侵入的细胞,将小室置于多聚甲醛中固定20 min。使用双蒸水洗涤后,细胞用1%结晶紫染色15 min。放大200倍拍摄照片,使用Image J软件计数细胞。
1.2.9细胞周期实验 转染48 h后,将细胞用胰蛋白酶消化并用PBS均匀吹散,加入1 ml预冷的70%乙醇放入细胞中,4 ℃静置24 h,1 500 r/min离心5 min后收集细胞,细胞用PI在37 ℃下染色30 min,通过流式细胞术检测细胞周期,使用CytExpert软件进行最终结果分析。


表1 引物列表
2 结果
2.1 免疫细胞化学激光共聚焦镜下可见,SCC3细胞核为蓝色,Kv3.4被荧光标记为红色,可见Kv3.4广泛存在于细胞质和细胞膜上,见图1。
2.2 siRNA转染效果评估qRT-PCR和Western blot实验证实siRNA降低了Kv3.4的表达水平。qRT-PCR结果表明,转染3条siRNA后,与control组相比,s1、s2、s3组KCNC4 mRNA表达水平降低,差异有统计学意义(F=39.1,P<0.001)。而mock组、si-NC组与control组相比,差异无统计学意义。其中,s3具有最高的沉默效率,见图2。随后的实验选用该siRNA进行。

图1 Kv3.4在SCC3细胞中的定位 ×200 A:DAPI将细胞核染为蓝色;B:Kv3.4蛋白染为红色;C:二者合成图像

图2 siRNA降低SCC3细胞中KCNC4组 的mRNA和蛋白质表达水平
A:qRT-PCR检测KCNC4 mRNA表达水平;与control组比较:***P<0.001;B:Western blot检测证明Kv3.4表达水平
2.3 KCNC4沉默对SCC3细胞增殖的影响CCK-8检测结果显示,随时间变化,各组吸光度存在差异。在48 h,与control组(1.05±0.07)和mock组(0.96±0.1)相比,si-KCNC4组(0.67±0.06)吸光度下降,差异有统计学意义(F=32.27,P<0.001)。在72 h,与control组(1.49±0.1)和mock组(1.34±0.1)相比,si-KCNC4组(0.81±0.09)吸光度下降,差异有统计学意义(F=59.46,P<0.001),见图3。
2.4 KCNC4沉默对SCC3细胞凋亡的影响流式细胞仪检测结果显示,与control组和mock组相比,si-KCNC4组凋亡细胞百分比增加,差异有统计学意义(F=467.4,P<0.001),见图4。
2.5 KCNC4沉默对SCC3细胞侵袭的影响使用Matrigel基质胶侵袭测定来确定细胞的侵袭能力。与control组相比,si-KCNC4组侵袭细胞数明显减少,差异有统计学意义(F=33,P<0.001)。且si-KCNC4组与mock组相比,侵袭细胞数也下降,差异具有统计学意义(P<0.01)。control组与mock组之间差异无统计学意义,见图5。

图3 沉默KCNC4基因后SCC3细胞的增殖能力下降情况
与control组比较:***P<0.001;与mock组比较:###P<0.001
2.6 KCNC4沉默对SCC3细胞周期的影响G0/G1期:与control组和mock组相比,si-KCNC4组的细胞比例增加,差异有统计学意义(F=58.36,P<0.001)。S期:与control组和mock组相比,si-KCNC4组细胞比例减少,差异有统计学意义(F=41.09,P<0.001)。G2/M期:与control组和mock组相比,si-KCNC4组细胞比例减少,差异有统计学意义(F=26.91,P<0.001)。由各细胞百分比变化可知,si-KCNC4组细胞周期在G0/G1期增高,在S期和G2/M期降低,见图6。
2.7 KCNC4沉默对侵袭和凋亡相关蛋白的影响与control组和mock组相比,si-KCNC4组中Caspase-3的表达水平增加。这从分子层面证明了细胞凋亡的发生。同时,实验结果表明cyclin D1、cyclin E1和MMP-9的表达水平降低,见图7,这可能揭示Kv3.4调节OSCC增殖和侵袭的机制。

图4 沉默KCNC4基因后SCC3细胞的凋亡能力增加
A:control组;B:mock组;C: si-KCNC4组;D:各组细胞凋亡率比较;与control组比较:***P<0.001;与mock组比较:###P<0.001

图5 沉默KCNC4基因后SCC3细胞侵袭性比较×200
A:control组;B:mock组;C:si-KCNC4组;与control比较:***P<0.001;与mock组比较:##P<0.01
3 讨论
电压门控钾通道是跨膜蛋白,是细胞膜中最丰富和分布最广的蛋白质。学者们认为钾通道与肿瘤的发生发展密切相关[6]。目前,推测电压门控钾通道可能通过调节细胞周期、调节基质金属酶和改变细胞体积[7]来影响肿瘤的发生和发展。有研究[8]表明,钾离子通道对细胞膜的活性在细胞有丝分裂周期的G1期起着关键作用。有学者发现在少突神经胶质瘤细胞中,钾通道的开放导致延迟外向钾电流过度表达,并参与细胞增殖的调节,影响细胞周期中的G1/S期转变[8]。体内和体外研究[1-2]发现,靶向钾通道的药物可以减弱某些肿瘤的生长,促进肿瘤细胞的凋亡,为癌症药物研究开辟了一条新途径。
Kv3.4属于Kv1-9亚家族,由KCNC4基因编码。OSCC中Kv3.4 mRNA表达增加[5],Kv3.4特异性抑制剂BDS特异性阻断Kv3.4通道可抑制OSCC的增殖。这些研究表明,Kv3.4与OSCC密切相关。

图6 沉默KCNC4基因后SCC3细胞周期被阻滞在G1期
A:control组;B:mock组;C:si-KCNC4组;与control比较:***P<0.001;与mock组比较:###P<0.001
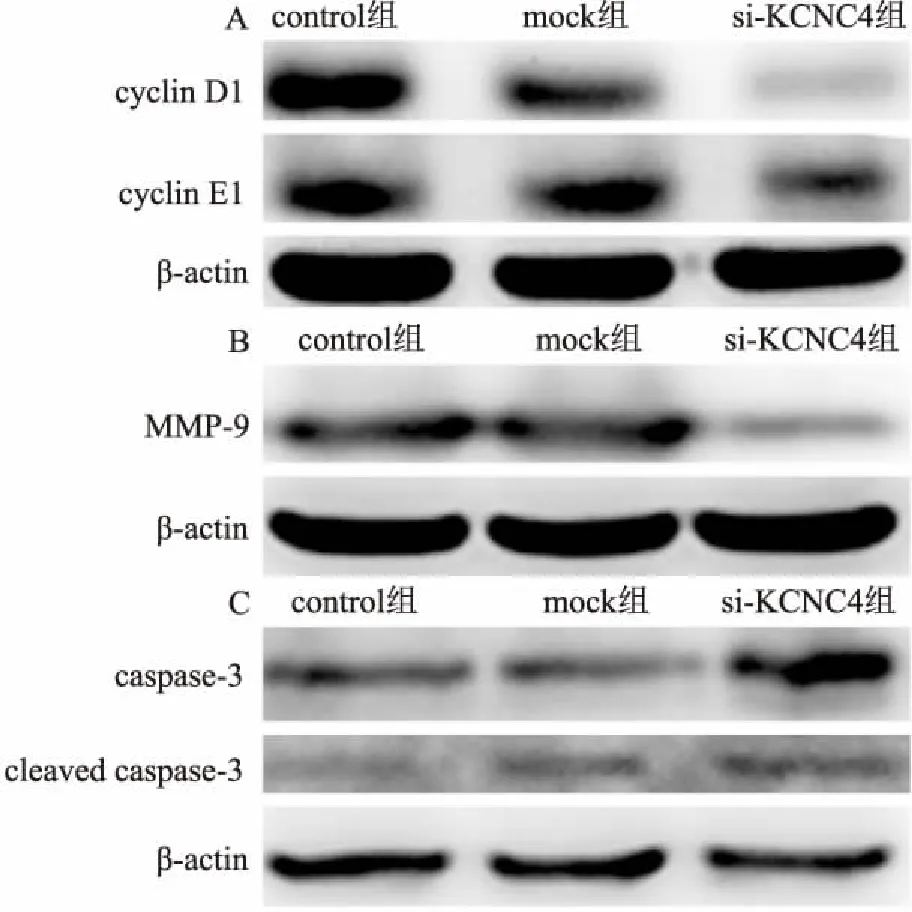
图7 沉默KCNC4后侵袭和凋亡相关蛋白表达水平的变化
A:cyclin D1和cyclin E1蛋白表达水平下降;B:MMP-9蛋白表达水平降低;C:caspase-3和cleaved caspase-3蛋白表达水平增加
转移是癌症患者死亡的原因之一,细胞侵袭能力是癌症转移的关键。MMPs诱导细胞外基质降解,促进新生血管形成是细胞侵袭的重要过程。其中,MMP-9与肿瘤晚期侵袭和转移增加密切相关。本研究表明,沉默KCNC4可降低SCC3细胞系的侵袭能力。同时,Western blot结果显示沉默KCNC4和MMP-9表达降低。基于此,推测Kv3.4可能通过MMP-9调节SCC3细胞系的侵袭能力。值得注意的是,MMP-9与缺氧的关联已得到证实[9]。而Kv3.4是一种氧敏感通道亚基,这可能揭示Kv3.4调节MMP-9的具体机制。
细胞增殖调控机制失控是肿瘤发展的重要原因[10]。细胞周期紊乱导致细胞增殖异常。大量研究[11]表明,胞膜上钾离子通道的活性在细胞周期的G1期起着关键作用。本研究显示,敲低KCNC4可以降低cyclin D1和cyclin E1表达,阻断G1期。Cyclin D1和cyclin E1表达的峰值出现在G1的中后期,驱使细胞从G1期进入S期。细胞内和细胞外信号整合在G1-S期,此期决定了细胞增殖、分化、死亡或退出细胞周期进入G0期。一些学者认为cyclin D1和cyclin E1的过度表达将缩短细胞G1期,加快细胞分裂速度,最终导致DNA复制异常,促进细胞恶性转化[12-13]。cyclin D1和cyclin E1的表达将导致视网膜母细胞瘤蛋白磷酸化,从而导致细胞不受控制的增殖[14]。结合以往的研究和本研究实验结果,推测沉默KCNC4可导致cyclin D1、cyclin E1的降解,细胞周期G0/G1被阻滞,从而抑制肿瘤细胞系增殖。近年来,已有研究[7]显示,钾离子通道的异常表达,导致细胞周期蛋白表达水平改变,引起细胞周期异常。钾通道阻滞剂可以抑制CyclinE/cdk2的活性,外向钾电流维持cdk2的活性,并调节G1/S期的转变[15]。研究[8]表明,钾通道阻滞剂仅阻断G1/S期转变,而G0期钾通道蛋白合成不依赖于RNA合成。
细胞凋亡是一个复杂的生理过程,其特征是细胞体积减小和细胞内钾离子浓度降低。Caspase-3是细胞凋亡的最关键蛋白之一,并且位于Caspase级联的最下游。随着Kv3.4表达水平的降低,Caspase-3和cleaved-Caspase-3表达增加,细胞凋亡增加。这进一步证实了敲低KCNC4对细胞凋亡的作用。
本研究首先确认了Kv3.4在OSCC细胞系SCC3中的位置,然后使用RNA干扰技术沉默SCC3中的KCNC4基因,干扰Kv3.4的表达,观察其对SCC3细胞增殖、凋亡、侵袭能力的影响并初步探讨了相关的分子机制。本研究验证了Kv3.4与OSCC的关联,并初步证明Kv3.4对OSCC的影响可能通过调控细胞周期,调控MMP-9和Caspase-3的表达水平来实现。这表明Kv3.4可能是OSCC的潜在靶点,为OSCC的治疗提供了新的策略。
