过表达SPINK5对宫颈癌细胞恶性生物学行为的影响
2019-11-26朱丽娜王勇朱月华
朱丽娜,王勇,朱月华
(中国人民解放军陆军第七十一集团军医院,江苏徐州221116)
据报道,2015年我国新发宫颈癌约9.89万例,死亡约3.05万例,已成为仅次于乳腺癌的女性第二高发恶性肿瘤,严重威胁女性身心健康和生活质量[1]。尽管目前已经明确HPV为宫颈癌的主要病因,但由于缺少有效的肿瘤早期诊断分子标志物,大多数患者确诊时已进入中晚期,治疗效果不佳。因此,寻找宫颈癌的早期诊断分子标志物和治疗靶点成为近年研究的热点[2~4]。丝氨酸蛋白酶抑制剂Kazal型5(SPINK5)定位于人染色体5q32,包含15个潜在的功能抑制区域,其编码蛋白在皮肤及毛发的形态发育和黏膜上皮的抗炎、抗微生物侵袭等过程中发挥重要作用[5,6]。近年越来越多研究发现,SPINK5与恶性肿瘤的发生、发展密切相关,其在食管癌[7]、喉咽鳞癌[8]、口腔鳞癌[9]、膀胱癌[10]、非小细胞癌[11]等组织中低表达,且与患者预后不良有关。提示SPINK5在恶性肿瘤的发生、发展过程中可能发挥抑癌基因作用。但目前鲜见SPINK5在宫颈癌中作用的报道。2016年6月~2018年6月,我们以GEO数据库为基础,挖掘出宫颈癌关键差异表达基因SPINK5,并探讨过表达SPINK5对宫颈癌细胞增殖、凋亡和侵袭的影响。现报告如下。
1 材料与方法
1.1 材料 人宫颈癌HeLa细胞、人胚肾上皮293T细胞(以下分别称HeLa细胞、293T细胞),购自中国科学院上海生命科学研究院细胞资源中心。SPINK5过表达质粒载体(PCDNA 3.1-SPINK5)及对照质粒载体(PCDNA 3.1-NC),上海吉凯基因医学科技有限公司。所有引物序列由深圳华大基因科技服务有限公司设计合成。TRIzol、逆转录试剂盒、荧光定量PCR试剂盒,美国Thermo Fisher Scientific公司。RIPA裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒,天根生化科技(北京)有限公司。GAPDH、SPINK5一抗和HRP标记的山羊抗兔IgG二抗,英国Abcam公司。Lipofectamine2000,美国Invitrogen公司。MTT细胞增殖及细胞毒性检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒,上海碧云天生物技术有限公司。
1.2 宫颈癌组织差异表达基因分析 通过GEO数据库获取GSE9750数据集数据。GSE9750数据集包含33例份宫颈癌组织、24例份正常宫颈组织的基因表达谱芯片数据,该芯片类型为Affymetrix Human Genome U133A Array。R语言程序归一化处理各样本基因表达值后,以差异倍数>2、P<0.05为标准,筛选差异表达基因。通过STRING version10.5分析差异表达基因的蛋白互作网络[12]。
1.3 稳定过表达SPINK5宫颈癌细胞构建
1.3.1 细胞培养 将冻存的HeLa细胞、293T细胞快速解冻并转移至15 mL无菌离心管中,1 000 r/min离心3 min,去除旧的培养基上清,用含10% FBS、100 U/mL青霉素和100 μg/mL链霉素的DMEM完全培养基重悬。然后将细胞悬液接种至新的细胞培养瓶中,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。待细胞融合85%左右时,按1∶3传代。
1.3.2 慢病毒包装 取传3代、对数生长期、生长状态良好的293T细胞,0.25%胰蛋白酶消化,按1×105个/孔接种于6孔板,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养,次日更换为不含双抗、含10% FBS的DMEM完全培养基,当细胞生长融合60%~70%即可用于转染。分别配制A液(PCDNA3.1-SPINK5或PCDNA3.1-NC质粒载体1.25 μg+psPAX2 0.75 μg+pMD2.G 0.5 μg+Opti-MEM培养基150 μL)和B液(Lipofectamine2000 15 μL+Opti-MEM培养基150 μL),A液与B液按1∶1混合,吹打混匀,室温孵育20 min,逐滴加入6孔板中,轻轻摇动混匀。37 ℃、5% CO2、饱和湿度的细胞培养箱中培养6 h,更换新鲜的DMEM培养基。继续培养16 h更换新鲜的DMEM培养基,再培养24 h收集上清液,1 000 r/min离心5 min,弃去细胞碎片后,用0.45 μm滤器将上清液过滤至离心管中。4 ℃下50 000 r/min离心2 h,获取浓缩的PCDNA3.1-SPINK5、PCDNA3.1-NC慢病毒沉淀。
1.3.3 细胞转染 取传3代、对数生长期、生长状态良好的HeLa细胞,按6×105个/孔接种于6孔板,分别记为观察组和对照组,然后置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。次日,更换为不含FBS的DMEM培养基,然后观察组加入PCDNA3.1-SPINK5慢病毒,对照组加入PCDNA3.1-NC慢病毒,于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养2 h,更换为含10%FBS的DMEM培养基继续培养。继续培养48 h,加入含400 μg/mL的G418完全培养基筛选,每2天更换一次新的筛选培养基,筛选培养2周,获得稳转细胞株。
1.3.4 转染效率鉴定 ①SPINK5 mRNA表达检测:采用实时荧光定量PCR法。收集两组稳转细胞,TRIzol法提取细胞总RNA,按逆转录试剂盒说明将总RNA逆转录为cDNA。以cDNA为模板,按荧光定量PCR试剂盒说明进行PCR扩增。引物序列:SPINK5上游引物5′-ATAGCCACAGTGTCAGTGCTT-3′,下游引物5′-TGCCTGAAATTCATGGCACAT-3′;GAPDH上游引物5′-TGAAGGTCGGAGTCAACGG-3′,下游引物5′-TCCTGGAAGATGGTGATGGG-3′。PCR反应体系共25 μL:SYBR Premix Ex Taq 12.5 μL,上下游引物各1 μL,cDNA模板2 μL,ddH2O 8.5 μL;反应条件:95℃ 30 s,95 ℃ 5 s、60 ℃ 20 s共40个循环。以GAPDH为内参,采用2-ΔΔCt法计算目的基因相对表达量。实验重复3次,取平均值。②SPINK5蛋白表达检测:采用Western blotting法。收集两组稳转细胞,RIPA裂解液提取细胞总蛋白,经BCA法蛋白定量合格。然后加入5×上样缓冲液,100 ℃水浴5 min,使蛋白充分变性。取变性蛋白30 μg,SDS-PAGE分离蛋白(5%浓缩胶、8%分离胶)。采用湿转法将蛋白电泳产物转印至PVDF膜,5%脱脂奶粉-TBST封闭液室温封闭1 h,分别加入SPINK5、GAPDH一抗(稀释比均为1∶2 000),4 ℃孵育过夜。次日,加入HRP标记的山羊抗兔IgG二抗(稀释比1∶1 000),37 ℃恒温摇床孵育1 h。然后加入ECL超敏发光液至完全覆盖PVDF膜,ChemiDoc MP多功能成像仪成像。采用Image J软件分析各蛋白电泳条带灰度值。以GAPDH为内参,以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比值作为目的蛋白相对表达量。实验重复3次,取平均值。
1.4 细胞增殖活性检测 采用MTT法。收集两组上述稳转细胞,接种于96孔板,每孔2×103个,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。培养0、24、48、72 h时,每孔加入MTT 10 μL,于细胞培养箱内孵育4 h,弃去上清液,加入Formazan溶解液100 μL,充分混匀,直至光学显微镜下观察Formazan全部溶解。酶标仪于570 nm波长处检测各孔的光密度(OD)值。以OD570值代表细胞增殖活性。
1.5 细胞凋亡检测 采用Annexin V-FITC/PI双染法。收集两组上述稳转细胞,置于6 cm细胞培养皿中培养48 h,胰蛋白酶消化,1 000 r/min离心5 min,PBS重悬并计数。取重悬细胞1×105个,1 000 r/min离心5 min,弃上清,加入Annexin V-FITC结合液195 μL重悬细胞,再加入Annexin V-FITC 5 μL和PI染色液10 μL,充分混匀。室温避光孵育20 min,上流式细胞仪检测。
1.6 细胞侵袭能力检测 采用Transwell侵袭实验。Matrigel胶4 ℃过夜融化,用含10% FBS的DMEM培养基按1∶5稀释后,包被Transwell小室上室的基底膜,然后将Transwell小室置于37 ℃、5% CO2、饱和湿度的细胞培养箱孵育4~5 h,直至Matrigel胶凝固。收集两组上述稳转细胞,用含10% FBS的DMEM培养基制成密度为1×106个/mL的细胞悬液。取细胞悬液150 μL加入Transwell小室上室,下室加入含10% FBS的DMEM培养基750 μL,然后将Transwell小室置于37 ℃、5% CO2、饱和湿度的细胞培养箱中孵育24 h。取出Transwell小室,PBS冲洗2次,用棉签轻轻拭去Transwell小室上室未穿膜细胞,4%多聚甲醛固定20 min,0.1%结晶紫染色10 min,倒置显微镜下观察。随机取6个100倍视野,计数穿膜细胞数。以穿膜细胞数代表细胞侵袭能力。实验重复3次,取平均值。
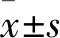
2 结果
2.1 宫颈癌组织差异表达基因筛选与蛋白互作网络分析 在GSE9750数据集中共筛选出665个差异表达基因。差异表达基因的蛋白互作网络分析发现,以SPINK5为中心,其连接KRT4、CRNN、KLK13等组成核心蛋白互作网络,故选择SPINK5进行后续功能研究。
2.2 两组SPINK5 mRNA和蛋白表达比较 转染48 h,观察组与对照组SPINK5 mRNA相对表达量分别为5.87±0.25、1.00±0.09,SPINK5蛋白相对表达量分别为4.37±0.55、1.00±0.13。观察组SPINK5 mRNA和蛋白相对表达量均明显高于对照组(t分别为18.02、5.97,P均<0.05)。
2.3 两组培养不同时间细胞增殖活性比较 见表1。

表1 两组培养不同时间细胞增殖活性比较
注:与对照组培养同时间比较,*P<0.05。
2.4 两组细胞凋亡率比较 观察组与对照组细胞凋亡率分别为(11.82±0.39)%、(4.15±0.22)%。观察组细胞凋亡率明显高于对照组(t=29.67,P<0.01)。
2.5 两组细胞侵袭能力比较 观察组与对照组穿膜细胞数分别为(54.67±3.48)、(120±6.35)个。观察组穿膜细胞数明显低于对照组(t=15.63,P<0.01)。
3 讨论
宫颈癌是全球女性常见的一种生殖系统恶性肿瘤。据统计,每年宫颈癌新发病例约50万例,其中绝大多数在发展中国家。目前,宫颈上皮内瘤变被认为是宫颈癌的癌前病变,从宫颈上皮内瘤变发展至宫颈癌一般要8~10年,这表明宫颈癌的发生、发展是一个复杂的过程[13]。宫颈癌发病的分子机制复杂,涉及致癌基因的激活和抑癌基因的抑制。随着对宫颈癌发病分子机制的持续研究,越来越多参与宫颈癌发生的基因或蛋白被发现,进而衍生出一些新的治疗方法,如靶向治疗。利用公共数据库表达谱数据与临床数据挖掘宫颈癌形成关键作用基因是寻找其致病基因、诊断或治疗分子标志物的有效手段[14,15]。鉴于此,本研究通过GEO数据库中宫颈癌组织及其癌旁组织的基因表达谱数据,获取差异表达基因,在蛋白互作网络分析的基础上,筛选出宫颈癌关键差异表达基因SPINK5,并推测SPINK5可能在宫颈癌的发生、发展过程中发挥重要作用。
SPINK5属于丝氨酸蛋白酶抑制剂超家族中的膀腺分泌类膀蛋白酶抑制剂家族。近年研究发现,SPINK家族与人类多种疾病特别是恶性肿瘤密切相关。Ida等[16]研究发现,SPINK1能诱导人结肠癌细胞增殖;在通过偶氮甲烷构建的结肠癌小鼠模型中发现,结肠癌组织SPINK3(SPINK1的小鼠同源物)过表达,并且SPINK3杂合子小鼠肿瘤多样性和肿瘤体积较野生型小鼠明显降低。这些结果提示,SPINK1/SPINK3能刺激结肠癌细胞增殖,并参与结肠癌的进展。目前,丝氨酸蛋白酶抑制剂Kazal型家族中的SPINK1、SPINK3等与肿瘤关系的研究较多,但SPINK5与恶性肿瘤关系的研究相对较少。Wang等[7]研究发现,在食管癌组织中SPINK5表达明显降低,且过表达SPINK5能够抑制食管癌细胞中Wnt/β-catenin信号通路。李崇鑫[11]研究发现,NSCLC组织SPINK5表达明显高于癌旁正常组织,且在有淋巴结转移的NSCLC组织中表达更高;进一步分层分析发现,SPINK5主要在有淋巴结转移的肺腺癌组织中高表达。结果表明SPINK5在NSCLC组织中高表达,且其高表达在淋巴结转移过程中发挥重要作用。Zhao等[9]研究发现,SPINK5表达与口腔鳞癌患者生存率明显相关,并认为SPINK5能够通过DNA甲基化引起的表观遗传改变参与口腔鳞癌的发生、发展。但目前鲜见SPINK5表达与宫颈癌关系的报道。
本研究通过慢病毒构建稳定过表达SPINK5的HeLa细胞,发现观察组SPINK5 mRNA和蛋白相对表达量均明显高于对照组,表明该技术能够稳定使HeLa细胞SPINK5过表达。进一步观察发现,观察组培养48、72 h细胞增殖活性明显低于对照组,细胞凋亡率明显高于对照组,细胞侵袭能力明显低于对照组,表明SPINK5可能通过促进细胞凋亡而抑制肿瘤生长,进而降低其侵袭能力,与Matsuura等[17]报道基本一致。
综上所述,SPINK5在宫颈癌组织中低表达;过表达SPINK5能够抑制宫颈癌细胞增殖和侵袭并促进其凋亡。这为未来宫颈癌靶向治疗提供了新的靶点。
