抑制miR-182表达对裸鼠乳腺癌皮下移植瘤生长和转移的影响及其机制
2019-11-26董超黄远丽徐正丰
董超,黄远丽,徐正丰
(华中科技大学同济医学院附属荆州医院,湖北荆州434020)
近年来,我国乳腺癌的发病率呈明显上升趋势,已位居女性恶性肿瘤发病率的首位[1]。虽然乳腺癌诊疗技术得到不断发展进步,但过去的5年乳腺癌总生存率并没有得到实质性提高[2]。目前,乳腺癌的病因及其发病机制尚不完全清楚。因此,探索与乳腺癌发生、发展有关的原癌基因或抑癌基因具有重要临床意义[3]。微小RNA(miRNA)是一类由18~25个核苷酸组成的非编码小分子RNA。近年研究发现,在恶性肿瘤组织中存在多种miRNA异常表达,在恶性肿瘤的发生、发展中发挥促癌或抑癌作用[4]。miR-182是近年发现的miRNA家族成员之一,定位于人染色体7q32.2。有研究表明,miR-182在多种恶性肿瘤组织中异常表达,并与肿瘤的发生、发展密切相关[5]。我们前期研究发现,抑制miR-182表达能够通过上调叉头框转录因子O亚族1(FOXO1)基因表达来抑制乳腺癌细胞的侵袭和迁移[6]。为了进一步观察在体内miR-182表达变化对乳腺癌细胞生长和迁移的影响,2018年10~12月,我们通过构建人乳腺癌裸鼠皮下移植瘤模型,观察抑制miR-182表达对裸鼠皮下移植瘤生长和转移的影响,并探讨其可能的作用机制。现报告如下。
1 材料与方法
1.1 材料 健康雌性BALB/c裸鼠20只,SPF级,鼠龄6~8周,体质量19~22 g,购自北京维通利华实验动物技术有限公司。所有裸鼠标准饮食、自由摄水,饲养环境温度22~24 ℃、湿度55%~60%、光照12 h明暗交替。人乳腺癌细胞系MDA-MB-231(以下称MDA-MB-231细胞),美国ATCC细胞库。miR-182和U6引物序列,由广州市锐博生物科技有限公司设计合成。miR-182抑制物(miR-182 inhibitor)及其阴性对照物(inhibitor NC),购自上海吉玛制药技术有限公司。CFX96 Touch实时荧光定量PCR仪,美国Bio-Rad公司。L-15培养基,美国HyClone公司;TRIzol,美国Invitrogen公司;iScript Advanced cDNA Synthesis Kit、iScript一步法RT-qPCR试剂盒(SYBR Green),美国Bio-Rad公司;LipofectamineTM2000,美国Invitrogen公司;兔抗鼠FOXO1、Bax、Bcl-2、GAPDH一抗和HRP标记的羊抗兔IgG二抗,美国Santa Cruz公司。
1.2 抑制miR-182表达的乳腺癌细胞构建 将MDA-MB-231细胞接种于含10% FBS的L-15培养基,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。待细胞贴壁生长后,用0.25%胰蛋白酶消化,按1∶3传代。取传5代、对数生长期、生长状态良好的MDA-MB-231细胞,接种于6孔板,随机分为miR-182 inhibitor组和inhibitor NC组,每组设3个复孔。然后将6孔板置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。待细胞融合70%~80%时,两组分别采用LipofectamineTM2000转染miR-182 inhibitor、inhibitor NC。转染24 h,收集细胞,采用TRIzol法提取细胞总RNA,经紫外分光光度计鉴定,OD260/OD280为1.8~2.0。按iScript Advanced cDNA Synthesis Kit说明将总RNA逆转录为cDNA。以cDNA为模板,按iScript一步法RT-qPCR试剂盒说明进行PCR扩增。引物序列:miR-182上游引物5′-TGCGGTTTGGCAATGGTAGAAC-3′、下游引物5′-CCAGTGCAGGGTCCGAGGT-3′,内参U6上游引物5′-CTCGCTTCGGCAGCACA-3′、下游引物5′-AACGCTTCACGAATTTGCGT-3′。PCR反应体系共50 μL:2×Quant One Step Probe RT-qPCR Master Mix 25 μL,HotMaster Tap Polymerase 2 μL,Qunat RTase(for one step) 0.7 μL,上下游引物各2 μL,RNase-Free ddH2O 18.3 μL;反应条件:94 ℃ 2 min,94 ℃ 20 s、60 ℃ 30 s共40个循环。以U6为内参,采用2-ΔΔCT法计算目的基因相对表达量。实验重复3次,取平均值。
1.3 裸鼠皮下移植瘤模型构建 将20只裸鼠随机分为观察组和对照组,每组10只。收集上述转染24 h的MDA-MB-231细胞,用移液枪轻轻吹打,制成密度为2×108个/mL的单细胞悬液。用灭菌注射器分别吸取单细胞悬液0.1 mL,转染miR-182 inhibitor的单细胞悬液接种于观察组右侧后腿皮下,转染inhibitor NC的单细胞悬液接种于对照组相同部位。接种后注意观察裸鼠一般情况,如饮食、精神状态、活动等。接种第10天,如发现裸鼠右侧后腿皮下出现肿瘤结节,说明裸鼠皮下移植瘤模型构建成功。
1.4 皮下移植瘤体积、瘤体质量和腹股沟淋巴结检测 从接种第10天开始定期观察裸鼠皮下移植瘤生长情况,每5天用专用卡尺测量肿瘤最长径(a)、最短径(b),计算皮下移植瘤体积(V)。V=1/2×a×b2。接种第30天,所有裸鼠断颈处死,分离皮下移植瘤和两侧腹股沟淋巴结组织。皮下移植瘤组织快速称质量后液氮中速冻,-80 ℃保存。腹股沟淋巴结组织用10%中性甲醛固定,石蜡包埋,5 μm厚连续切片。切片经二甲苯脱蜡、梯度乙醇脱水后,苏木素染色,伊红复染,显微镜下观察。如果切片中发现肿瘤细胞,则判定有淋巴结转移。计算淋巴结转移率和阳性率。淋巴结转移率(%)=淋巴结转移裸鼠只数/裸鼠总数×100%,淋巴结阳性率(%)=淋巴结阳性个数/淋巴结总数×100%。
1.5 皮下移植瘤组织miR-182表达检测 取冻存的皮下移植瘤组织,液氮环境下研磨成粉,采用TRIzol法提取组织总RNA,经紫外分光光度计鉴定,提取的总RNA纯度和浓度合格。取总RNA 100 ng,按1.2中的方法检测miR-182表达。实验重复3次,取平均值。
1.6 皮下移植瘤组织FOXO1、Bax、Bcl-2蛋白表达检测 取冻存的皮下移植瘤组织,RIPA冰上充分裂解,4 ℃下14 000 r/min离心10 min,提取组织总蛋白,经BCA法蛋白定量合格,-80 ℃保存。然后加入4×上样缓冲液,100 ℃水浴3~5 min使蛋白充分变性。取变性蛋白30 μg,SDS-PAGE分离蛋白(5%浓缩胶、10%分离胶),80 V恒压30 min,120 V恒压2 h。电泳结束,将蛋白电泳产物电转移至PVDF膜。5%脱脂奶粉室温封闭1 h,分别加入兔抗鼠FOXO1、Bax、Bcl-2、GAPDH一抗,4 ℃孵育过夜。次日TBST洗膜3次,加入HRP标记的羊抗兔IgG二抗,室温孵育1 h,ECL发光、显影,凝胶成像系统成像。采用Quality One软件分析各蛋白电泳条带灰度值。以GAPDH为内参,以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比例作为目的蛋白相对表达量。实验重复3次,取平均值。
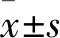
2 结果
2.1 miR-182 inhibitor组与inhibitor NC组miR-182表达比较 转染24 h,miR-182 inhibitor组和inhibitor NC组miR-182相对表达量分别为0.22±0.10、0.99±0.06,两组比较P<0.01。
2.2 观察组与对照组皮下移植瘤体积、瘤体质量及腹股沟淋巴结转移情况比较 两组皮下接种乳腺癌细胞后均逐渐出现饮食减少、精神状态和活动力下降等情况。接种第10天,两组均成功构建皮下移植瘤模型,无死亡。两组皮下移植瘤体积比较见表1。接种第30天,观察组与对照组瘤体质量分别为(0.51±0.16)、(1.16±0.13)g,两组比较P<0.01。观察组与对照组淋巴结转移率分别为30.0%(3/10)、90.0%(9/10),淋巴结阳性率分别为30.4%(7/23)、76.8%(43/56),两组比较P均<0.01。

表1 两组皮下移植瘤体积比较
注:与对照组比较,*P<0.01。
2.3 观察组与对照组皮下移植瘤组织miR-182表达比较 观察组与对照组皮下移植瘤组织miR-182相对表达量分别为0.59±0.10、1.03±0.04,两组比较P<0.01。
2.4 观察组与对照组皮下移植瘤组织FOXO1、Bax、Bcl-2蛋白表达比较 见表2。

表2 两组皮下移植瘤组织FOXO1、Bax、Bcl-2蛋白相对表达量比较
注:与对照组比较,*P<0.01。
3 讨论
乳腺癌是女性常见的恶性肿瘤之一,在世界范围内,其发病率和病死率均较高,严重威胁女性生命健康和生活质量。乳腺癌具有侵袭性,几乎能够扩散或转移至全身任何部位,而侵袭和转移是导致患者死亡的最主要原因。但目前对乳腺癌侵袭和转移的分子机制尚不清楚。因此,探索乳腺癌侵袭和转移的分子机制具有重要临床意义。
miRNA是近年发现的非编码小分子RNA,能够通过与靶基因的3′非翻译区互补结合,降解靶基因mRNA或抑制其翻译,从而调控靶基因表达。miRNA具有高度保守性和组织特异性,可参与细胞增殖、分化、凋亡及炎症反应等病理生理过程[7]。近年随着分子生物学技术快速发展,miRNA在恶性肿瘤发生、发展中的作用逐渐被重视,已成为肿瘤诊断的分子标志物和潜在的治疗靶标[8]。miR-182属于miR-183/miR-96/miR-182基因簇中的一员,于2003年在小鼠眼睛中首次被发现[9]。目前,miR-182与肿瘤发生、发展关系的报道较多。有研究报道,miR-182能够通过抑制FBXW7、FBXW11基因表达,抑制非小细胞肺癌细胞增殖[10]。Wang等[11]研究发现,miR-182能够通过激活Wnt/β-catenin信号通路,促进前列腺癌进展。miR-182在多数恶性肿瘤中具有原癌基因作用[5]。但也有研究报道,miR-182作为抑癌基因能够抑制骨肉瘤侵袭[12,13]。以上研究提示,miR-182在不同恶性肿瘤中的作用不同。
我们前期研究发现,miR-182在乳腺癌组织和细胞中均异常高表达,且其异常高表达与乳腺癌进展有关[6],提示miR-182在乳腺癌中可能具有原癌基因作用,与Chiang等[14]报道一致。前期研究还发现,抑制miR-182表达能够抑制乳腺癌细胞的侵袭和迁移能力[6]。本研究采用脂质体转染技术将miR-182 inhibitor、inhibitor NC转染至MDA-MB-231细胞,结果发现转染miR-182 inhibitor的MDA-MB-231细胞miR-182相对表达量明显低于转染inhibitor NC的MDA-MB-231细胞,表明该技术能抑制乳腺癌细胞miR-182表达。裸鼠皮下移植瘤模型是目前模拟体内环境下肿瘤生物学特征较好的动物模型。本研究将转染miR-182 inhibitor、inhibitor NC的MDA-MB-231细胞接种至裸鼠右侧后腿皮下,构建皮下移植瘤模型。接种第10天,两组均成功构建了皮下移植瘤模型,无死亡。本研究进一步观察了皮下移植瘤在裸鼠体内生长和转移情况,结果发现,观察组皮下移植瘤体积、瘤体质量均低于对照组,提示抑制miR-182表达对裸鼠体内乳腺癌生长具有抑制作用。Bax/Bcl-2信号通路是目前发现最经典的细胞凋亡信号通路。Bax、Bcl-2是Bcl-2家族的重要成员,分别属于促凋亡Bax亚家族和抗凋亡Bcl-2家族。Bcl-2能够与Bax竞争性结合形成稳定的异源二聚体,抑制Bax的促凋亡作用,还可抑制Fax介导的死亡受体凋亡通路。因此,Bax/Bcl-2是决定肿瘤细胞是否会发生凋亡的重要因素[15]。凋亡受阻是恶性肿瘤细胞的生物学特征之一。本研究结果发现,观察组皮下移植瘤组织Bax蛋白相对表达量明显高于对照组,而Bcl-2蛋白相对表达量明显低于对照组,说明抑制miR-182表达可通过促进乳腺癌细胞的凋亡起到抗肿瘤作用。淋巴结转移也是恶性肿瘤最基本的生物学特征。为了观察抑制miR-182表达对体内环境下乳腺癌转移的影响,本研究观察了两组腹股沟淋巴结转移情况,结果发现观察组淋巴结转移率和阳性率均低于对照组,说明抑制miR-182表达对体内环境下乳腺癌转移具有明显抑制作用。
miRNA的作用主要取决于其调控的下游靶基因的生物学功能,一个靶基因可受多个miRNA调控,同时一个miRNA也可调控多个靶基因,从而在机体中发挥不同的作用。FOXO1是FOX蛋白家族的重要成员之一。既往研究发现,抑制miR-182表达能够通过下调靶基因FOXO1表达促进宫颈癌和前列腺癌的发生、发展[16,17]。我们前期研究发现,抑制miR-182表达能够通过上调靶基因FOXO1表达抑制乳腺癌细胞的侵袭和迁移[6]。为了证实在乳腺癌中miR-182对靶基因FOXO1的调控作用,进一步研究发现,观察组皮下移植瘤组织miR-182相对表达量明显低于对照组;观察组皮下移植瘤组织FOXO1蛋白相对表达量明显低于对照组,提示抑制miR-182表达对乳腺癌转移的抑制作用可能是通过调控靶基因FOXO1表达实现的,与陈宝英等[18,19]报道一致。
综上所述,抑制miR-182表达可能通过下调靶基因FOXO1表达来抑制裸鼠乳腺癌皮下移植瘤的生长和转移。miR-182有可能成为乳腺癌靶向治疗的一个潜在靶点。
