SLE全血样本线粒体功能相关基因的差异表达分析
2019-11-26巴燕娜袁晴苏丽萍袁志栋吴振彪
巴燕娜,袁晴,苏丽萍,袁志栋,吴振彪
(1 第四军医大学西京医院,西安710032;2 第四军医大学)
系统性红斑狼疮(SLE)是一种累及多系统、多器官并有多种自身抗体出现的自身免疫性疾病[1]。SLE多发于青年女性,以20~40岁多见,无论是从疾病本身还是由于长期激素治疗带来的不良反应均严重影响患者的身心健康,降低其生活质量[2,3]。目前认为,SLE的病因与遗传因素、环境因素和免疫反应异常等有关,但其发病的确切分子机制尚不完全清楚。线粒体是一种普遍存在于真核细胞中的细胞器,主要功能是通过氧化磷酸化和脂质过氧化反应产生能量。人类的线粒体基因组长度为16 569 bp[4],能够编码2种rRNA、22种tRNA和4种不同呼吸酶复合物(Ⅰ、Ⅲ、Ⅳ、Ⅴ)的13种高度疏水多肽亚单位。近年研究发现,线粒体损伤能够促进固有免疫系统的异常激活,导致炎症性疾病和自身免疫性疾病[5]。但目前鲜见线粒体功能相关基因异常表达与SLE关系的报道。2019年4~7月,本研究通过分析SLE全血样本转录组数据,探索了差异表达的线粒体功能相关基因及其涉及的生物学通路,为进一步探索SLE的发病机制提供新思路。
1 材料与方法
1.1 材料 通过NCBI的GEO数据库(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi)下载人类SLE的RNA-seq转录组公共数据,ID:GSE72509,测序平台:Illumina HiSeq 2500。该公共数据集中共有全血样本117例份,其中SLE样本99例份、健康对照样本18例份。线粒体相关基因信息来源于MitoMiner数据库(MitoMiner4.0v2018JUN)[6]。该数据库的参考数据集IMPI共收录了1 626个人线粒体功能相关基因,其中13个为线粒体基因组编码的基因。本研究称非线粒体编码的1 613个线粒体功能相关基因为线粒体相关基因,而NCBI提供的线粒体参考基因组中的37个线粒体相关基因为线粒体基因。线粒体相关基因和线粒体基因统称为线粒体功能相关基因。
1.2 RNA-seq转录组数据处理 RNA-seq原始数据处理:①质量控制:去除每一段测序读段的接头序列并过滤rRNA污染和低质量序列;②序列比对:使用GSNAP软件将序列和参考基因组hg19进行比对;③计算基因表达值RPKM:根据Chepelev等[7]报道的方法计算基因表达的RPKM值。
1.3 RNA-seq转录组数据分析 采用t检验和差异倍数(FC)法识别线粒体功能相关的差异表达基因谱,差异表达基因的筛选阈值为P<0.05且FC≥1.5。通过R软件clusterProfiler、topGO、Rgraphviz、pathview和org.Hs.eg.db等程序包对差异表达基因进行GO功能注释和KEGG功能富集分析。采用Benjamini-Hochberg法对P进行多重检验校正并控制错误发现率(P.adjust),满足P.adjust<0.05的GO术语和KEGG通路具有显著性。
1.4 蛋白质互作网络分析 利用在线的基因注释与分析资源Metascape(http://metascape.org/gp/index.html#/main/step1)对差异表达的线粒体功能相关基因进行蛋白质互作网络分析。如果网络包含3~500个蛋白质,则应用分子复合物检测算法来识别密集连接的网络组件[8]。
2 结果
2.1 SLE全血样本差异表达基因筛选 对SLE、健康对照全血样本的转录组数据进行t检验和FC分析,从23 284个基因中筛选出1 478个显著差异表达的基因,其中表达上调的基因有1 105个、表达下调的基因有373个。差异表达最大的5个上调基因和5个下调基因见表1。这10个差异表达基因可能与SLE的发生、发展有关。

表1 SLE全血样本差异表达最大的5个上调基因和5个下调基因
2.2 SLE全血样本差异表达线粒体相关基因分析
2.2.1 SLE差异表达的线粒体相关基因筛选 在1 478个显著差异表达的基因中,SLE差异表达的线粒体相关基因共40个,其中表达上调的基因26个、表达下调的基因14个。差异表达最大的5个上调基因和5个下调基因见表2。这10个线粒体相关基因的异常表达在SLE发生、发展过程中具有一定作用。
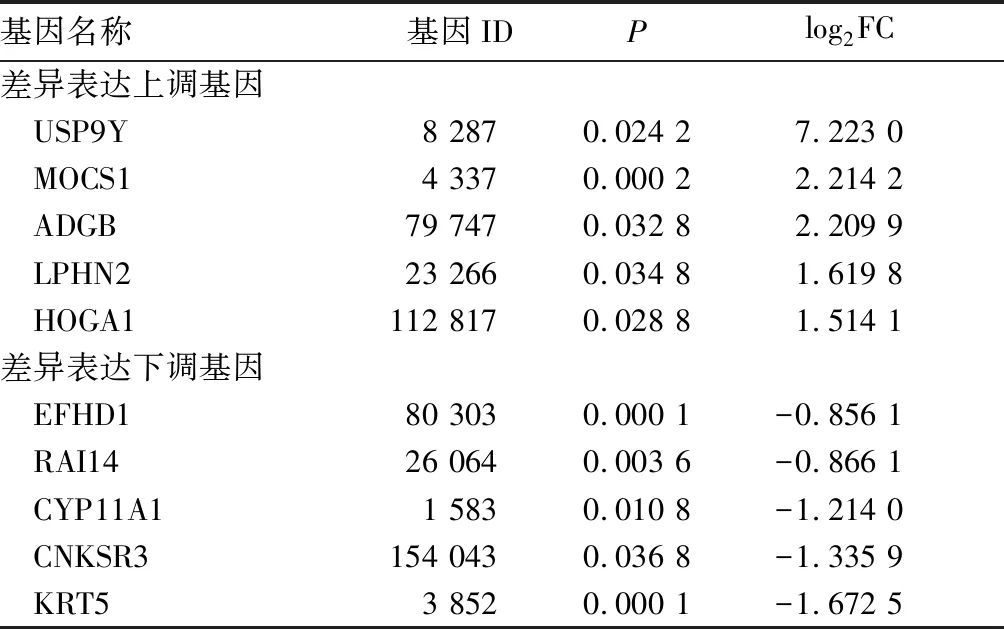
表2 SLE全血样本线粒体相关基因差异表达最大的5个上调基因和5个下调基因
2.2.2 SLE差异表达线粒体相关基因的注释与功能富集分析 GO功能注释分析显示,这40个SLE差异表达的线粒体相关基因与氨基酸及其衍生物的代谢过程、蛋白质寻靶、信号识别颗粒依赖的靶向膜共翻译蛋白、靶向膜共翻译蛋白、蛋白质靶向内质网、细胞内氨基酸催化过程、核转录mRNA分解代谢及无义突变介导的降解和蛋白定位至内质网的建立有关。KEGG功能富集分析发现,这40个SLE差异表达的线粒体相关基因与核糖体、氧化磷酸化及甘氨酸、丝氨酸、苏氨酸、精氨酸、脯氨酸代谢有关。
2.2.3 SLE差异表达线粒体相关基因的蛋白质互作网络 将这40个SLE差异表达的线粒体相关基因提交至已经整合BioGrid[9]、InWeb_IM[10]和OmniPath三个数据库信息的Metascape中,分析蛋白质互作网络,得到的网络包含一些蛋白质子集,这些蛋白质子集成员至少包含一个与其他成员形成物理相互作用的SLE差异表达线粒体功能相关基因。这些SLE差异表达线粒体功能相关基因的蛋白质互作网络包括如下通路:hsa04260为与心肌收缩有关的KEGG通路,CORUM:306为核糖体和胞质相关的通路,R-HAS-192823为与病毒mRNA翻译相关的通路。蛋白质相互作用网络密集连接区中的4个基因(R、RPL34、RPL31和RPS15A)包含的通路:CORUM:306、R-HSA-192823、R-HSA-156902(肽链延伸相关的通路);另外4个基因(COX6C、COX7A1、COX7B和COX7C)涉及的通路:hsa04260通路、hsa00190通路(与氧化磷酸化相关的KEGG通路)和hsa05012通路(与帕金森病相关的KEGG通路)。结果表明,SLE差异表达线粒体相关基因的蛋白相互作用网络可影响心肌收缩、氧化磷酸化等细胞功能通路。
2.3 SLE全血样本差异表达的线粒体基因分析
2.3.1 SLE差异表达线粒体基因的鉴定 在1 478个显著差异表达的基因中,线粒体基因共8个,均为表达下调的基因,其中有6个基因(MT-ND6、MT-CO1、MT-ND1、MT-ATP6、MT-CO3和MT-ATP8)是编码蛋白质的基因、2个基因(MT-TR、MT-TE)是编码线粒体tRNA的基因。见表3。

表3 SLE差异表达线粒体基因的相关信息
注:MT-ND6、MT-ND1编码蛋白NADH还原酶,MT-CO1、MT-CO3编码蛋白细胞色素C,MT-ATP6、MT-ATP8编码蛋白ATP酶,MT-TR编码tRNA中的精氨酸,MT-TE编码tRNA中的谷氨酸;链的类型中,“+”表示该基因所在位置为与mRNA序列(除T代替U)相同的DNA链上,“-”表示该基因在合成RNA模板的DNA链上。
2.3.2 SLE差异表达线粒体基因的功能分析 GO功能注释分析显示,这8个差异表达的线粒体基因与线粒体能量供应、ATP代谢和核苷酸代谢有关。KEGG功能富集分析显示,这8个线粒体基因与氧化磷酸化、帕金森病等生物学通路有关。GO功能注释分析和KEGG功能富集分析获得富集的结果分别有74、9条,其中最显著的5条GO术语和5条KEGG通路(P.adjust<0.05)见表4。
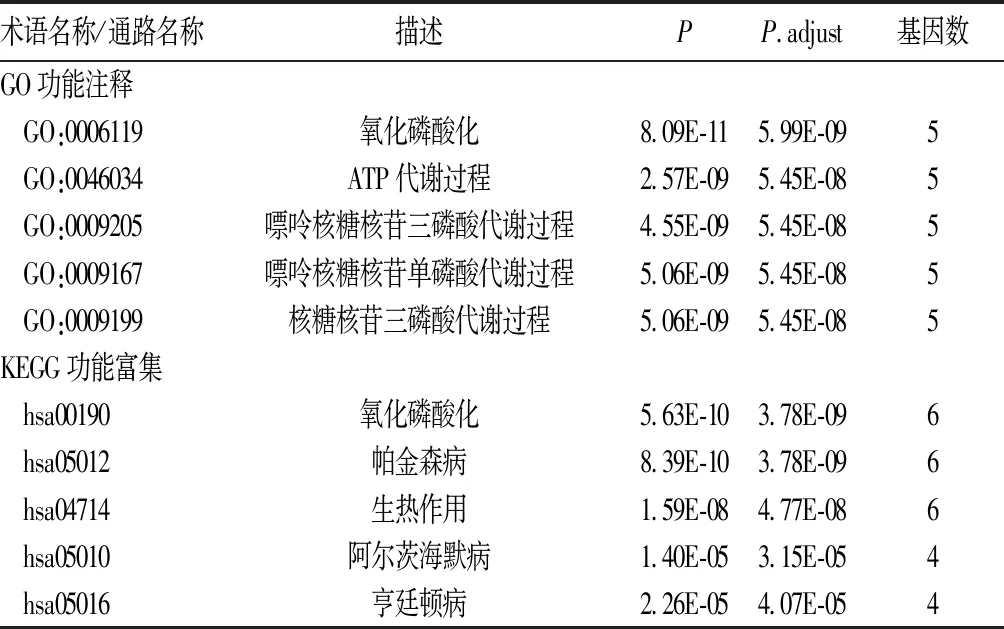
表4 8个线粒体基因功能注释和功能富集的结果
3 讨论
SLE是一种典型的系统性自身免疫性疾病,其特征是针对核抗原的自身抗体产生和导致慢性全身性炎症的Ⅲ型超敏反应。SLE的发病机制复杂,是多种基因和环境因素相互作用的结果,从而导致自身抗原暴露、自身抗体产生、慢性炎症和组织损伤的恶性循环[11]。含有自身抗原的免疫复合物过载和IFN-α有增无减是SLE形成的标志。在细胞死亡过程中,细胞凋亡和中性粒细胞特异性死亡会改变自身抗原。因此,清除各种死亡细胞的能力不足有可能是导致自身抗原暴露于免疫系统的一个重要因素,最终导致自身免疫性疾病。
线粒体是一种普遍存在于真核细胞中的细胞器,主要功能是通过氧化磷酸化和脂质过氧化反应产生能量。研究证实,线粒体损伤与炎症性疾病和自身免疫性疾病的发生有关。近年越来越多研究表明,线粒体功能障碍在SLE的发病中具有重要作用[12]。因此,进一步研究线粒体的病理生理学机制对阐明SLE发病的分子机制具有重要意义。但目前基于线粒体功能相关基因与SLE关系的报道较少,线粒体功能在SLE发病机制中的作用也一直未受到重视。
本文基于SLE患者和健康对照者全血样本的转录组数据,分析线粒体功能相关基因在SLE中的表达情况,从23 284个基因中筛选出1 478个差异表达显著的基因,表达上调的基因有1 105个、表达下调的基因有373个。其中,差异表达最大的5个上调基因分别为TXLNG2P、KDM5D、EIF1AY、DDX3Y和RPS4Y1,差异表达最大的5个下调基因分别为LRRC26、PLD5、PRSS35、LINC00226和LOC100132472。这些差异表达的基因可能在SLE的发生、发展过程中具有重要作用。在1 478个差异表达显著的基因中,筛选出SLE差异表达的线粒体相关基因共40个,表达上调的基因26个、表达下调的基因14个。其中,差异表达最大的5个上调基因分别为USP9Y、MOCS1、ADGB、LPHN2和HOGA1,差异表达最大的5个下调基因分别为EFHD1、RAI14、CYP11A1、CNKSR3和KRT5。在1 478个差异表达显著的基因中,筛选出线粒体基因8个,均为表达下调的基因,其中6个基因(MT-ND6、MT-CO1、MT-ND1、MT-ATP6、MT-CO3和MT-ATP8)是编码蛋白质的基因、2个基因(MT-TR、MT-TE)是编码线粒体tRNA的基因。本研究分别对这些基因进行GO功能注释分析和KEGG功能富集分析,发现它们与氧化磷酸化、ATP代谢等生物学过程有关。结果表明,线粒体功能相关基因的异常表达与SLE有关,线粒体的能量供应及ATP、核苷酸的代谢与SLE的发生、发展有关。
在线粒体功能相关的差异表达基因中,线粒体基因MT-ND6和MT-ND1的功能以往在SLE相关的研究中已有报道[13]。在SLE患者中,线粒体相关蛋白转录本水平降低,这些蛋白可参与电子转运(MT-ND1、MT-ND6)、氧化磷酸化(ATP6)、mtDNA(TFAM、NRF-1)的复制和转录及三磷酸循环中丙酮酸向乙酰辅酶A的转化。Vyshkina等[14]研究发现,MT-ATP6和MT-ND2基因分别在线粒体基因组9 055、4 917位点的突变与多发性硬化和SLE有关,表明这两种自身免疫性疾病可能具有相同的线粒体遗传背景。但迄今为止,SLE相关线粒体基因功能的研究不多。本研究结果发现,SLE相关的8个线粒体基因表达扰动与线粒体氧化磷酸化、能量供应、ATP代谢和核苷酸代谢有关,表明SLE的发病可能伴随相关代谢的失常,这为揭示SLE的发病机制提供了新的方向。
另外,本研究筛选出的1 478个差异表达基因与DisGeNET数据库[15]收录的1 112个SLE相关基因的共同交集有53个。这53个非线粒体相关基因中差异表达最大的上调基因为DKK1、ERVW-1等;差异表达最大的下调基因为TRPC6、HRH4等。研究发现,DKK1表达上调与骨吸收有关,故DKK1可作为评估SLE骨侵蚀潜在的生物标志物[16];也有研究报道,具有神经精神病学表现的SLE患者细胞中TRPC6活性较高。TRPC6内含子多态性与SLE神经系统疾病的高发病风险相关,可影响免疫细胞功能[17]。研究发现,HRH4的表达模式预示其在炎症性疾病和免疫性疾病中具有重要作用。HRH4基因拷贝数增多可显著增加SLE的发病风险,故针对HRH4的靶向治疗为自身免疫性疾病提供了新的治疗方向[18]。综合与DisGeNET数据库比较的结果以及目前SLE相关基因的研究报道,本研究分析的差异表达线粒体功能相关基因具有一定可靠性。后续的研究要进一步确定本研究中线粒体功能相关基因与SLE发病的关系,这将为分析SLE发病机制提供新的思路。
综上所述,SLE全血样本中线粒体功能相关基因表达的异常扰动与SLE的发生、发展有关,这将为探索SLE发病的分子机制提供新的思路。但由于本研究样本量有限,亦未考虑SLE异质性对研究结果的影响,后续研究有待于进一步改进和优化。
