肺腺癌组织中PD-L1表达与18F-FDG摄取的相关性
2019-11-26宋宇飞王成龙张慧媛张岩赵伟赵起超张岩磊李囡
宋宇飞,王成龙,张慧媛,张岩,赵伟,赵起超,张岩磊,李囡
0 引言
肺癌是患病率及致死率均居首位[1]的恶性肿瘤,其中肺腺癌占50%[2]。对于晚期肺腺癌患者,肿瘤免疫逃避是放化疗等综合治疗失败的主要原因[3]。程序性细胞死亡蛋白-1(programmed death-1,PD-1)/及其配体(PD-L1)通路是机体重要的免疫调节机制之一,已有大量临床试验[4]证实PD-L1/PD-1抑制剂在晚期非小细胞肺癌(non-small cell lung carcinoma,NSCLC)中疗效显著。以18F标记氟代脱氧葡萄糖(fluorodeoxyglucose F18,18F-FDG)为示踪剂的正电子发射/计算机断层扫描(positron emission tomography/computed tomography,PET/CT)可同时提供肿瘤代谢及解剖形态双重信息。本研究旨在探索PD-L1表达与最大标准摄取值(maximum standard uptake value,SUVmax)之间的关系。
1 资料与方法
1.1 临床资料
回顾性分析2016年1月1日—2018年12月31日在北京大学肿瘤医院核医学科行18F-FDG PET/CT检查的初诊肺腺癌患者102例。入组标准:(1)术后病理证实为肺腺癌并进行PD-L1免疫组织化学检测;(2)年龄≥18岁;(3)所有患者治疗前均进行18FFDG PET/CT检查;(4)有完整的治疗和临床病理信息及数据。排除标准:(1)既往有其他恶性肿瘤病史;(2)伴有活动性或可疑活动性的、慢性不可控制的炎性反应或感染;(3)伴有心脏、肝脏或肾脏功能异常;(4)伴有糖尿病;(5)妊娠或哺乳期妇女。入组患者均对本次研究知情。
1.2 PET/CT图像采集及判读
所有患者均采用荷兰飞利浦公司生产的Gemini TF 16 PET-CT扫描仪进行显像。每例患者先注射18F-FDG(按0.1 mCi/kg),暗室平静休息1 h,排尿后行常规PET-CT检查。扫描范围头顶到大腿中段(必要时加做双下肢扫描)。CT扫描电压为120 keV,电流为 100 mAs。PET扫描通常7~8个床位,每个床位采集时间为1 min,采集方式3D模式。应用CT数据进行衰减矫正,迭代法重建,获得全身PET、CT图像及PET-CT融合图像。在肺原发病变部位设置感兴趣区(region of interest,ROI),通过系统自带计算机软件计算出该区的SUVmax。
1.3 免疫组织化学检测及结果判读
将4 μm厚的石蜡肺癌组织切片用Envision 法进行免疫组织化学染色,抗原修复后,运用3%双氧水消除内源性过氧化物酶,加入一抗孵育过夜后,用缓冲液冲洗,加入二抗室温孵育25 min后,缓冲液冲洗,DAB显色及苏木精对比染色。设置空白对照(PBS缓冲液代替一抗)和已知阳性对照。由两名病理医生双盲独立完成结果读取。PD-L1染色阳性为肿瘤细胞膜和(或)细胞质出现棕黄色或棕褐色颗粒。高倍镜下随机选择5个视野计数阳性细胞数,每个视野至少计数200个细胞,计算PD-L1阳性细胞的百分比。PD-L1表达阴性计为0分,PD-L1阳性细胞<50%计为1分,PD-L1阳性细胞≥50%计为2分。
1.4 统计学方法
采用SPSS22.0软件对数据进行统计分析。分类变量采用Pearson卡方检验或确切概率法。采用Spearman法对SUVmax及PD-L1表达之间进行相关性分析。受试者工作特征曲线(ROC)用于SUVmax预测PD-L1界值的判定,以最高敏感度为临界值,将SUVmax分为低值组与高值组,在多元Logistic回归分析中,以Hosmer-Lemeshow拟合度检验模型的拟合,采用逐步回归检测PD-L1表达与临床因素的相关性。所有检验均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 患者临床及病理特征
本研究患者中的中位年龄59.5岁(34~76岁);原发灶中位SUVmax为2.15(0~23.1);患者的临床特征见表1。
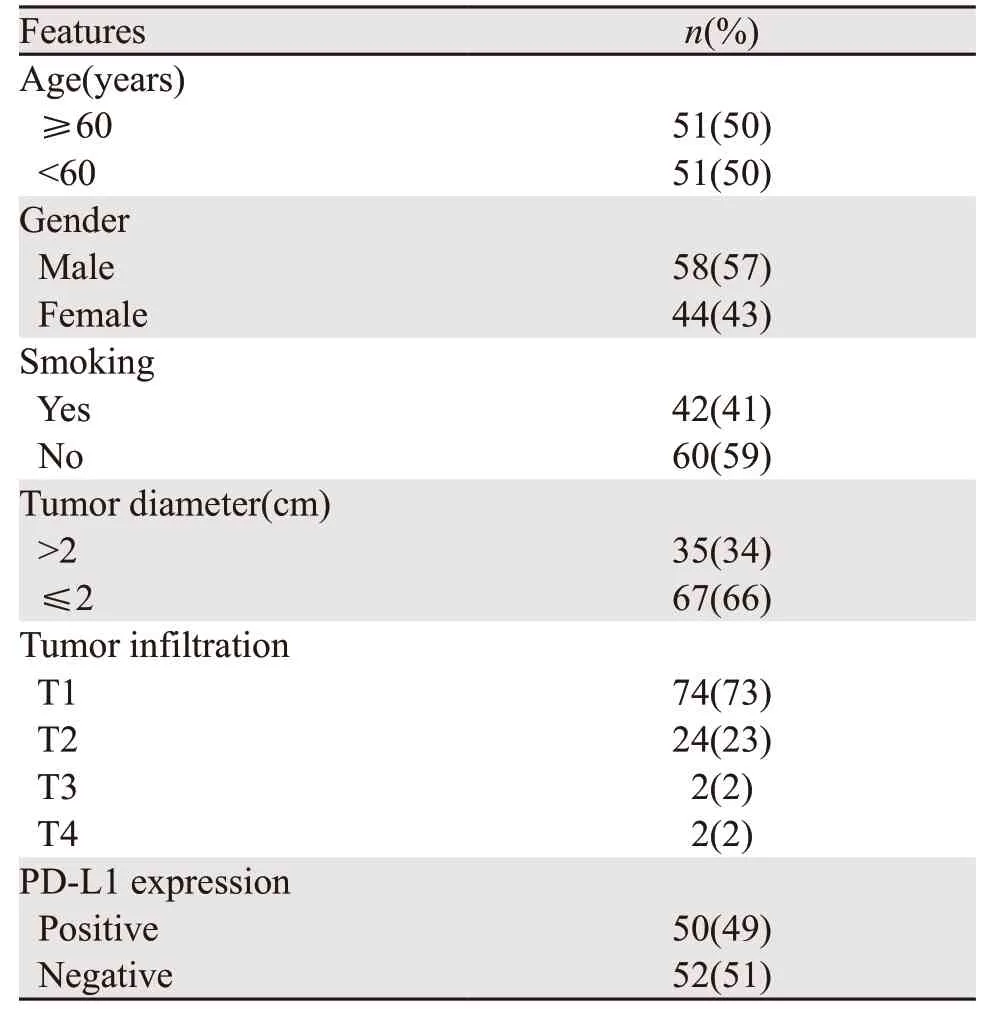
表1 102例肺癌患者的临床及病理特征Table1 Clinical and pathological features of 102 lung cancer patients
2.2 PD-L1表达及与临床相关因素分析
卡方检验分析临床特征与PD-L1表达之间的相关性,发现T2~T4期肺癌组阳性率患者高于T1组(82%vs.36%,P=0.0001),男性高于女性,吸烟者高于不吸烟者,病灶>2 cm组较≤2 cm组阳性率高。多元Logistic回归分析,发现在性别、吸烟史、病灶大小、分期均与PD-L1表达无明显相关性(均P>0.05),见表2。
2.3 PD-L1表达与SUVmax间的关系
PD-L1阳性患者的SUVmax值高于阴性患者,差异有统计学意义(6.59±5.03vs.2.89±4.65,P=0.0001)。根据ROC曲线,当AUC=0.801时,95%CI:0.708~0.895,P=0.0001,约登指数(Youden)最大(0.522),所对应的SUVmax为1.70,此时,敏感度、特异性最高,分别为81%、71.2%,因此将SUVmax=1.70作为判断PD-L1的最佳诊断临界值,见图1。以SUVmax=1.7为临界值,将本研究患者分为高SUVmax和低SUVmax两组,发现高SUVmax组更易表达PD-L1(75%vs.14%,P=0.0001),多元Logistic回归分析显示SUVmax是预测PD-L1表达的独立因子(OR:13.75,95%CI:3.53~53.63,P=0.0001),见表3。使用Spearman法分析SUVmax值与PD-L1指数的相关性显示SUVmax值与PD-L1指数在相关性散点图上存在明显直线相关关系,见图2,即病灶SUVmax值与PD-L1指数呈正相关(r=0.537,P<0.0001)。
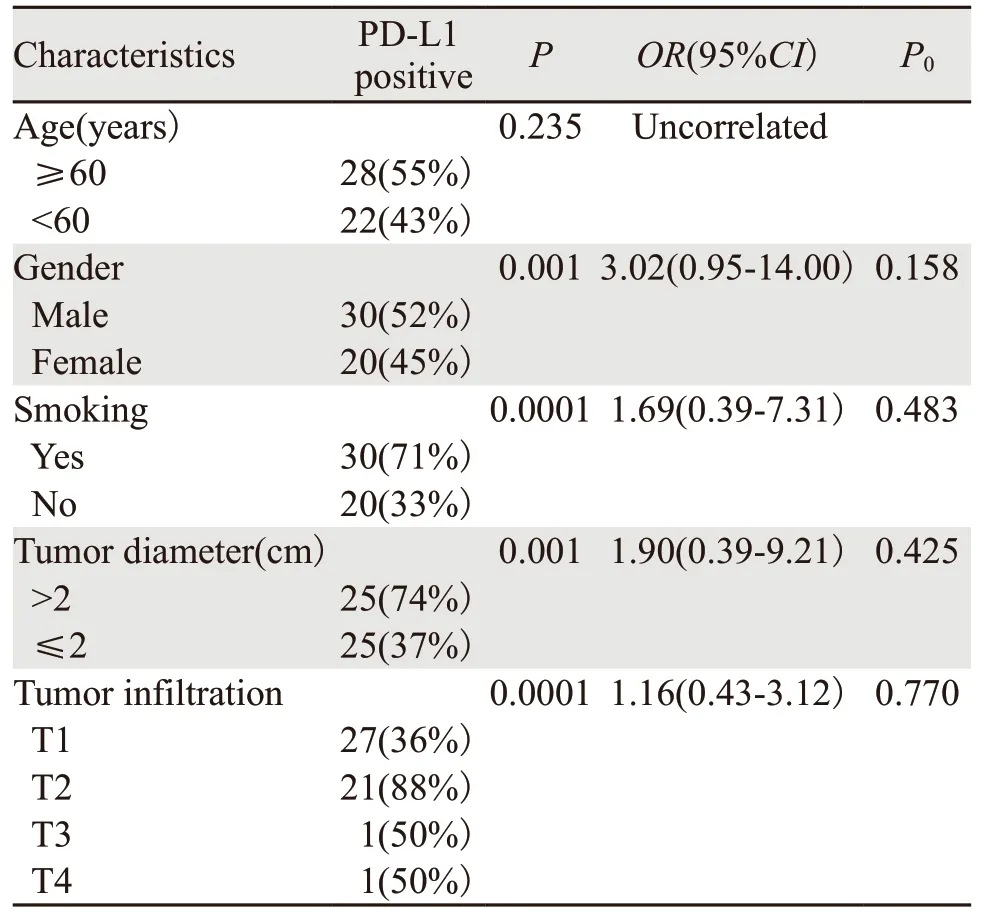
表2 肺癌患者临床病理特征与PD-L1表达之间的关系Table2 Relation between clinicopathological features and PD-L1 expression of lung cancer patients
3 讨论
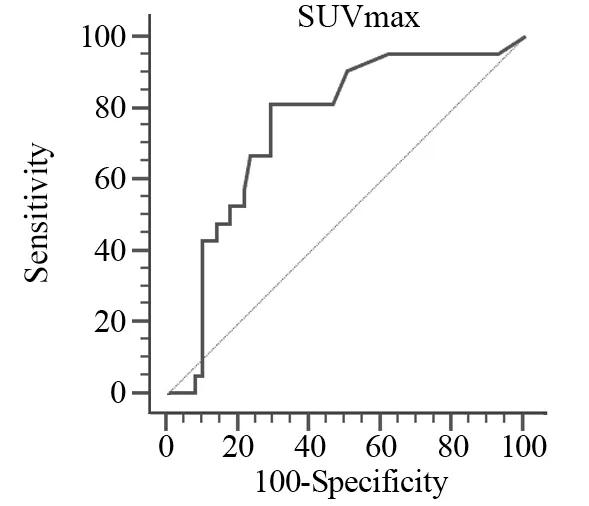
图1 SUVmax预测肺癌患者PD-L1的ROC曲线Figure1 ROC curve of SUVmaxto predict PD-L1 expression of lung cancer patients

表3 SUVmax与肺癌患者PD-L1表达之间的关系Table3 Relation between SUVmaxand PD-L1 expression of lung cancer patients

图2 肺腺癌病灶SUVmax与PD-L1指数相关性散点图Figure2 Scatter plot of correlation between SUVmaxand PD-L1 index in lung adenocarcinoma lesions
PD-1是免疫细胞的共抑制分子之一,广泛表达于活化的CD4+T细胞、CD8+T细胞、B细胞、单核细胞及树突状细胞表面,参与自身免疫耐受[5-6]。作为PD-1的配体,PD-L1是负性共刺激分子,主要表达于肿瘤细胞中。PD-1与PD-L1结合后,受抗原受体信号转导,使PD-1胞质区2个酪氨酸信号基序磷酸化,最终使效应T细胞处于无能状态或凋亡,实现肿瘤的免疫逃逸[6]。研究显示PD-L1高表达于多种肿瘤细胞表面(包括肺癌),PD-1/PD-L1抑制剂可以通过多种途径发挥T细胞对抗肿瘤的免疫效应,抑制肿瘤发展[7]。越来越多的临床试验证据支持PD1/PD-L1抑制剂在肺癌治疗方面的效果,无论使用PD-1/PD-L1抑制剂单药或联合化疗及分子靶向治疗,均可不同程度实现晚期肺腺癌患者生存获益、延缓疾病进展[8-10]。然而有研究表明在未经选择的患者中,仅20%对治疗产生反应[11]。因此,准确选择对PD-1/PD-L1抑制剂治疗有反应的患者至关重要。由于免疫组织化学检测PD-L1表达只能在术后进行且具有不稳定及不确定性,使其不能成为完美的预测因素。
18F-FDG PET/CT可同时提供病灶的糖代谢及解剖形态信息,已广泛应用于肺癌的诊断、分期及疗效评价等方面。然而,关于PD-L1表达与SUVmax的关系研究较少,尚无明确定论。本研究中SUVmax1.7为判断PD-L1的最佳诊断临界值时,其敏感度为81%、特异性为71.2%。高、低两组SUVmax差异有统计学意义。Takada等[12]对579例手术切除的非小细胞肺癌患者研究发现,吸烟、胸膜侵犯及SUVmax是PD-L1表达的独立预测因子。Zhang等[13]研究结果显示SUVmax与PD-L1表达相关,且高SUVmax及PD-L1表达可提示非小细胞肺癌患者预后不良,付立武等[14]研究也发现高SUVmax可预测PD-L1阳性的表达,与本研究结果一致。Lopci等[15]探究了FDGPET与非小细胞肺癌患者免疫标志物之间的关系,发现SUVmax和SUVmean与CD8-肿瘤浸润淋巴细胞(TILs)有关,而与PD-L1的表达无关。有研究[16]提示非小细胞肺癌患者中PD-L1表达与分期、淋巴结转移呈正相关,然而在本研究中SUVmax与分期间无明显相关性(P>0.05),可能的原因有本研究纳入患者分期较早且样本量较小等。
有研究表明PD-L1作为免疫调节蛋白,不仅可以向T细胞发出抑制信号,还在肿瘤微环境中增强肿瘤细胞糖酵解速率,从而使免疫细胞处于“饥饿”状态[17],同时有研究表明T细胞活化、CD28信号阻止T细胞失能的过程均能够增加葡萄糖摄取[18],如增加Glut1表达[19]等。因此当肿瘤细胞高表达PD-L1时,自身糖酵解增加,从而使肿瘤细胞摄取更多的“糖”,就可能会表现出高水平SUVmax,为18F-FDG PET/CT预测PD-L1表达提供了理论基础。本研究也存在一定的局限性,如研究样本量不大、多为早期腺癌等,可能存在选择偏倚。因此需要进行多中心的较大规模的临床研究探讨PET/CT在判断 PD-L1表达中的应用。
综上,肺腺癌患者中PD-L1表达阳性者FDG摄取高,且SUVmax值与PD-L1指数呈正相关,可为免疫治疗前的患者初筛提供帮助,进而对免疫分子及个体化治疗有重要的临床意义。
