HOXB7基因敲除对人肝癌细胞的增殖、侵袭及迁移能力的影响
2019-11-26伊佳虹郭亚荣王书敏宋彬仇海乐贾军梅
伊佳虹,郭亚荣,王书敏,宋彬,仇海乐,贾军梅
0 引言
肝细胞癌(hepatocellular carcinoma,HCC)是发病率居全球第五的常见恶性肿瘤[1]。一旦确诊,转移率高、预后差[2]。HOX(homeobox)基因属同源异型盒家族,与多种恶性肿瘤的发生发展及预后关系十分密切[3]。研究发现该家族成员中的HOXB7可通过调控细胞增殖、血管生成等促进胃癌[4]、肺癌[5]、胰腺癌及乳腺癌的发生发展[6-8],且HOXB7可通过诱导上皮-间充质转化(EMT)促进乳腺癌细胞的侵袭转移[9]。TGF-β(transforming growth factor-β)作为一种生长因子,过度活化与多种疾病密切相关,如肝纤维化[10]、炎性反应[11]和肿瘤[12]等。Liu等[8]认为HOXB7与TGF-β可能通过活化TGF-β/SMAD3信号通路促进细胞侵袭进而导致乳腺癌进展。Komatsu等[13]报道HOXB7在肝细胞癌组织中的表达明显高于癌旁组织,其表达水平与肝细胞癌预后显著相关,但HOXB7在HCC进程中的作用及机制尚未阐明。因此,本文采用HOXB7 shRNA转染肝癌SMMC-7721细胞,探讨HOXB7基因在肝癌细胞增殖、侵袭、迁移过程中的作用及部分机制,从而为寻找肝细胞癌的治疗靶点提供新思路。
1 材料与方法
1.1 材料
肝癌SMMC-7721及HepG2细胞购自上海一研生物科技有限公司;RIPA、PMSF购自南京凯基;抗鼠二抗、抗兔二抗以及β-actin购自武汉三鹰生物技术有限公司;HOXB7、β-actin引物由山西赛奥科技有限公司合成;TGF-β购自杭州联科公司;SMAD3购自英国Abcam公司;HOXB7 shRNA购自复能基因有限公司;PVDF膜购自美国Millipore公司;Transwell小室、酶标板购自美国Corning公司;CCK8试剂盒购自日本同仁化学研究所;转染试剂Lipofectamine 2000购自中国赛默飞世尔公司;Anchored Oligo(dT)18试剂盒、ECL显色液购自北京全式金生物技术有限公司。
1.2 方法
1.2.1 细胞培养及转染 将HepG2、SMMC-7721细胞培养于RPMI1640:FBS:PS=89:10:1的培养基中。分别对小干扰RNA组(实验组)、阴性对照小干扰RNA组(阴性对照组)、空白对照组细胞使用1.2 µg DNA。按照转染试剂Lipofectamine 2000说明手册对HOXB7的mRNA进行转染。
1.2.2 荧光定量PCR 按照说明书对肝癌SMMC-7721和HepG2细胞使用TransZol Up裂解液提取总RNA。通过Anchored Oligo(dT)18试剂盒得到反转录cDNA。利用2× TransStart® Tip Green qPCR SuperMix体系配置反应体系并放入荧光定量PCR仪,按照说明书进行PCR扩增。采用半定量分析计算HOXB7基因相关的mRNA表达水平。相关引物序列见表1。
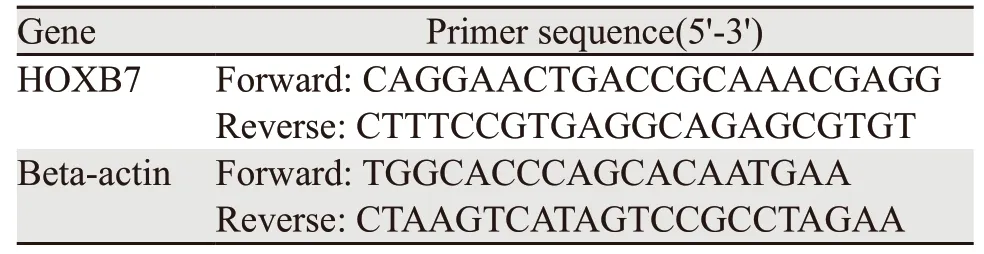
表1 PCR扩增引物序列Table1 Primer sequences amplified by PCR
1.2.3 Western blot检测 用裂解混合液提取肝癌细胞或shRNA转染后的细胞,使用BCA法测蛋白质浓度,于SDS-PAGE上取等量蛋白样品进行电泳,并用不同抗体分别行免疫印迹分析,ECL显色液避光显色,凝胶成像系统照相。使用Image J软件进行条带灰度分析,其相对表达水平用目的蛋白条带灰度与内参蛋白条带灰度的比率表示。
1.2.4 CCK8实验 将等量细胞接种于96孔板上培养24 h,根据细胞转染步骤进行转染,加入含有TGF-β抑制剂的新鲜无血清培养液再培养24 h。CCK8检测细胞活性。用酶标仪在600 nm的参比波长下测定450 nm处的吸光度值。
1.2.5 划痕实验 按照Lipofectamine 2000的试剂说明书转染细胞。24 h后,用200 μl尖端轻轻划线,1×PBS冲洗两遍,相差显微镜下分别取0、16、24 h三个时间点拍照,并计数划痕处细胞数目。
1.2.6 Transwell侵袭实验 Transwell上层小室中加入Matrigel胶母液60 μl,培养箱孵育30 min后加入50 μl无血清RPMI1640培养液,37℃孵育30 min,消化转染HOXB7 shRNA(实验组)、阴性对照shRNA(阴性对照组)及空白组细胞(空白对照组),各取200 μl接种于Transwell上层小室,加500 μl含10%胎牛血清或含抑制剂的无血清RPMI1640培养液,培养24 h,吸取上层小室内基质胶、液体,PBS擦去膜上层细胞,4%多聚甲醛固定10 min。结晶紫染色后,在200×视野下观察透膜细胞数。
1.3 统计学方法
利用SPSS23.0统计软件进行数据分析,结果以均数±标准差()表示。t检验用于两独立样本均值比较,单因素方差分析用于多样本间均数比较。P<0.05为差异有统计学意义。
2 结果
2.1 HOXB7 mRNA基因在不同肝癌细胞系中的表达水平
荧光定量PCR 实验结果显示,肝癌SMMC-7721和HepG2细胞株中HOXB7 mRNA的表达量分别为(3.198±0.9291)和(1.053±0.376),差异具有统计学意义(P=0.021),见图1。
2.2 shRNA敲除HOXB7基因表达的效果
空白对照组HOXB7 mRNA表达水平(1.038±0.395)与阴性对照组(0.943±0.006)差异无统计学意义(P=0.766),实验组HOXB7 mRNA水平(0.450±0.670)较阴性对照组明显降低(P=0.009),见图2A;同时实验组肝癌SMMC-7721细胞经HOXB7 shRNA转染后HOXB7蛋白表达量较阴性对照组及空白对照组均降低(P=0.01),而阴性对照组与空白对照组HOXB7蛋白表达量差异无统计学意义(P=0.878),见图2B。

图1 Real-time PCR检测肝癌细胞系中HOXB7 mRNA的表达量Figure1 HOXB7 mRNA expression in HCC cell lines detected by Real-time PCR
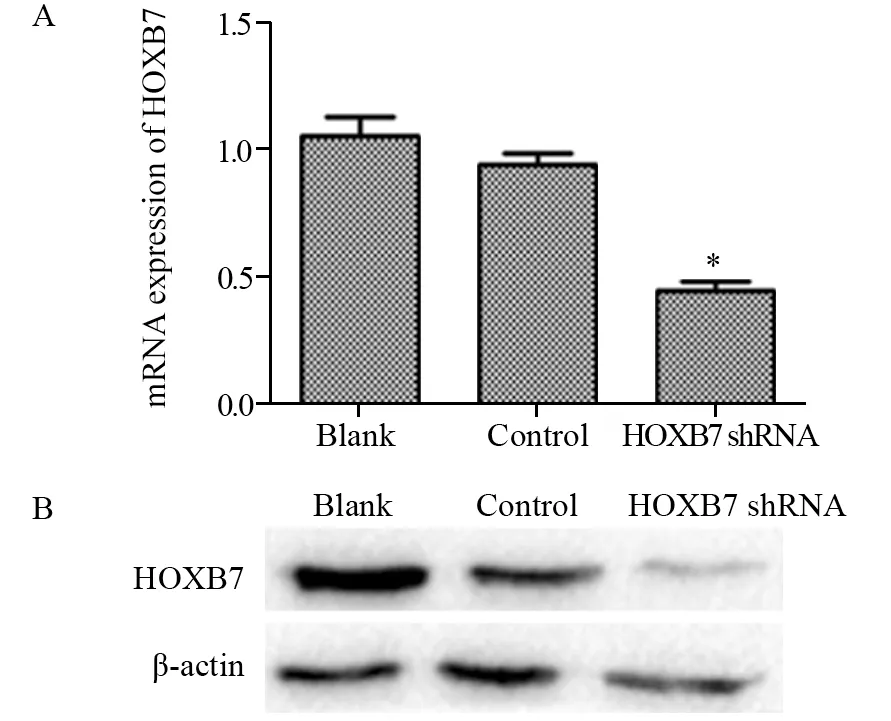
图2 shRNA转染SMMC-7721肝癌细胞的沉默效果Figure2 Silencing effect of shRNA on HOXB7 expression at mRNA(A) and protein(B) levels in SMMC-7721 cells detected by RT-PCR and Western blot
2.3 HOXB7基因敲减后对肝癌SMMC-7721细胞增殖能力的影响
CCK8 细胞活性实验结果显示,HOXB7 shRNA实验组肝癌细胞的吸光度值(0.644±0.007)显著低于空白对照组(1.068±0.006)与阴性对照组(1.096±0.052),差异有统计学意义(P=0.001),而空白对照组和阴性对照组差异无统计学意义(P=0.889),见图3。

图3 CCK8法检测shRNA转染后SMMC-7721细胞的增殖能力Figure3 Proliferation of SMMC-7721 cells after shRNA transfection detected by CCK8 method
2.4 HOXB7基因敲减对肝癌SMMC-7721细胞侵袭能力的影响
Transwell实验结果显示实验组跨膜细胞数少于阴性对照组及空白对照组,差异有统计学意义(P<0.001),阴性对照组和空白对照组间比较差异无统计学意义(P=0.782),见图4。
2.5 HOXB7基因敲减后对肝癌SMMC-7721细胞迁移能力的影响
细胞划痕实验结果显示,与阴性对照组及空白对照组相比,24 h后实验组肝癌细胞的迁移能力降低(P<0.05),说明HOXB7低表达能抑制人肝癌SMMC-7721细胞的迁移能力,见图5。
2.6 HOXB7基因敲除对肝癌SMMC-7721细胞TGF-β信号通路的影响
HOXB7基因敲除后,实验组p-Smad3蛋白表达水平(0.624±0.232)较空白对照组(1.241±0.112)及阴性对照组(1.294±0.690)水平明显降低(P<0.001),空白对照组和阴性对照组p-Smad3蛋白表达量差异无显著统计学意义(P=0.548),而实验组Smad3蛋白表达水平与空白对照组及阴性对照组比较差异无统计学意义(P>0.05),见图6。
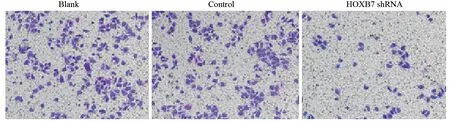
图4 Transwell检测shRNA转染后SMMC-7721细胞的侵袭能力 (×200)Figure4 Invasion ability of SMMC-7721 cells after shRNA transfection detected by Transwell assay (×200)
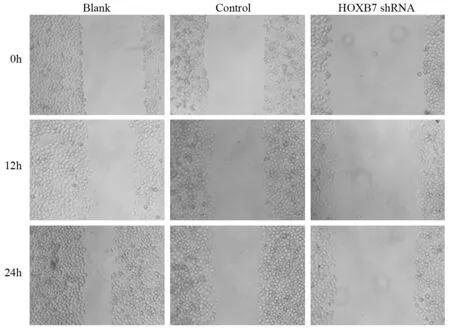
图5 划痕实验检测shRNA 转染后SSMC-7721细胞迁移能力Figure5 Migration of SSMC-7721 cells after shRNA transfection measured by wound healing assay
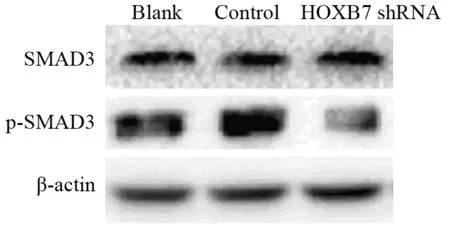
图6 Western blot法检测HOXB7基因敲除对TGF-β信号通路的影响Figure6 Effects of HOXB7 gene knockout on expressions of TGF-β signal pathway detected by Western blot
3 讨论
近年来原发性肝癌的发病率呈上升趋势[14],其中约90%的病理类型为肝细胞肝癌[15],原发性肝癌主要治疗方式为手术切除及局部治疗,但大多数患者因确诊时已为中晚期而失去手术治疗机会[16],目前晚期肝癌治疗除了传统的放化疗以外,还可以采用分子靶向药物治疗以及免疫治疗等方法[17],然而大多数转移性肝癌患者的生存现状仍不理想。因此,阐明肝细胞肝癌发展的机制有助于改善肝细胞肝癌的预后。
同源盒基因 B7(HOXB7)为HOX基因家族中的一种转录调节因子,在DNA合成与转录方面有重要作用,其高表达可导致某些肿瘤的发生。研究表明HOXB7在多种肿瘤细胞内异常表达,且与肿瘤的预后密切相关[18-19]。前期课题组研究发现在肝癌组织中HOXB7基因表达显著高于癌旁组织,这与Komatsu等[13]的研究一致,证实HOXB7作为癌基因参与了HCC的进程。为明确HOXB7对肝癌细胞增殖、侵袭和迁移的影响,本研究通过靶向HOXB7基因的shRNA转染HOXB7表达量较高的肝癌SMMC-7721细胞株,Real-time PCR及Western blot的结果表明,实验组中HOXB mRNA及蛋白表达水平受到明显抑制,CCK8实验结果表明实验组细胞增殖能力较空白对照组和阴性对照组明显下降,Transwell实验结果表明实验组跨膜细胞数较空白对照组和阴性对照组明显减少,划痕实验结果提示实验组肝癌SMMC-7721细胞的迁移能力较空白对照组和阴性对照组下降。本实验说明肝癌SMMC-7721细胞的增殖与迁移能力随着HOXB7表达下调而受到抑制,与课题组以往的研究结果一致,提示HOXB7可促进肝癌细胞的增殖活性、侵袭和迁移能力。
HOXB7在HCC进程中的作用机制目前尚无统一定论,据报道HOXB7可通过不同途径发挥作用,包括上调c-Myc和Slug表达并激活AKT通路[9]、活化FGF介导的MAPK/ERK通路[20]等。此外,HOXB7还可以通过刺激FGF等生长因子的分泌从而介导上皮-间充质转化(EMT)[21-22]发挥促癌作用,而TGF-β是参与EMT过程调节的主要因子之一[23]。TGF-β还可通过多种途径促进肿瘤的侵袭、浸润,如TGF-β可分别激活Smad和Non-Smad信号通路促进肝癌细胞EMT,从而促进肿瘤细胞的转移[24]。其中信号转导蛋白Smad3为TGF-β通路中重要的下游蛋白,该蛋白的异常表达可引起肿瘤的发生、进展与转移[23]。其下游信号也可能是通过调控其他通路调节EMT、细胞迁移等过程促进肝癌的进展,如MEK/Erk、PI3K/Akt、MAPK等通路[25]。因此,为了进一步明确HOXB7促进HCC进程的作用机制,本研究利用Western blot实验检测HOXB7基因敲除后TGF-β通路中下游蛋白的活化水平,结果显示实验组Smad3蛋白表达水平较空白对照组及阴性对照组无明显差异,而实验组p-Smad3的表达较空白对照组及阴性对照组显著下调。HOXB7敲除后Smad3的磷酸化水平下调,这提示HOXB7可能通过调节TGF-β通路中Smad3磷酸化促进肝癌细胞增殖、侵袭与迁移。然而HCC的侵袭、迁移是个复杂的过程,尤其是HOXB7在促进肝癌进展的具体分子机制尚未完全明确,后续还需开展关于TGF-β通路的一系列分子机制研究,进一步探讨HOXB7在HCC进程中的分子机制。
