肺结节活检和病理诊断在当前医疗实践中的必要性和可行性
2019-11-26荆剑张靖
荆剑,张靖
0 引言
近年来,随着肺癌筛查项目的开展以及常规体检人数的增加,肺小结节检出率显著升高。肺结节活检在早期肺癌筛查中扮演重要角色,不仅可以早期诊断肺癌及指导治疗,而且可以让患者避免不必要的手术。然而,我国肺小结节的活检率仍有待提高[1-2],并且,目前国内关于肺癌的筛查方案也主要集中于影像学检查。为此,本文综述了肺小结节活检及病理诊断在当前临床实践中的必要性和可行性。
1 肺结节活检的必要性
临床上,一般将>6 mm~≤3 cm的肺结节称为小结节[3]。近10年来,肺癌患者总体预后有所提高,这得益于逐渐普及的低剂量螺旋CT筛查和分子靶向药物、免疫治疗的应用,特别是针对非小细胞肺癌的治疗进展[4-6]。根据世界卫生组织2018年全球性癌症资料,肺癌仍然是发病率(11.6%)和死亡率(18.4%)均排名第一的恶性肿瘤[7]。2019年1月,国家癌症中心发布的最新数据显示,肺癌是我国发病率最高的恶性肿瘤[8],肺癌平均5年生存率约19.8%[9]。根据第8版癌症分级手册,按病理分期分为原位癌、Ⅰ、Ⅱ、Ⅲ及Ⅳ期,共相应的5年生存率依次为100%、77%~92%、53%~60%、13%~36%及0~10%[10],而我国约75%的肺癌患者在诊断时已为局部晚期或全身转移。这些数据表明,早期诊断肺癌对提高患者预后尤为重要。
早期肺癌一般没有明显临床症状,常在对高危人群的筛查或其他原因做胸部影像学检查时偶然被发现。肺癌风险因素包括吸烟史、年龄、家族史、肺癌相关环境接触史及慢性肺疾病史等[11-13],这些风险因素要结合实际情况作出客观评价。高危人群起始的筛查方法为低剂量螺旋CT[14]。不同的国家或地区对高危人群的定义有不同的标准,应结合实际流行病学情况作出相适应的标准。影像筛查亦有明确的标准,结节的大小、形状及特性可用于推测恶性肿瘤的概率,指导处理策略的制定,包括是否随访、随访频率和进一步的检查来确定结节的性质[14-17]。肺结节活检作为早期肺癌筛查的重要组成部分之一,有以下优势:(1)确定结节是否为恶性肿瘤,可以避免影像筛查中的假阳性而导致过度治疗;(2)明确肿瘤病理亚型,指导合适的治疗方案;(3)对肿瘤进行分子检测,选择对应靶向药物,实现精准治疗的目的;(4)小活检本身具有创伤小、风险小、花费少、效率高的特点,适用于解剖结构复杂、被骨性结构遮挡的肺结节及纵隔病灶。其中第一点在目前医疗条件下尤其重要,筛查带来的假阳性增加了不必要的医疗支出,阻碍了肺癌筛查的大范围普及。肺结节活检在发达国家很普及,因其对肺结节的准确诊断保证了肺癌筛查在一些地区被纳入医疗保险计划[18]。
2 肺结节活检的可行性
准确评估肺结节的性质依赖于对结节的病理分析,对肺结节的取样根据位置和大小有多种方案[19]。针对小活检,本文重点讨论适用于肺癌筛查和病理分期的B型超声引导下经支气管纵隔淋巴结穿刺或经皮肺穿刺,以及CT引导下经皮肺穿刺活检术获取标本。
虽然经皮B型超声引导穿刺优点颇多,如实时、方便、操作时间短及无辐射风险等,但它有较为严格的适应证。譬如,要求周围型肺病灶紧贴胸膜或位于胸膜下,常需采用超声增强准确区分肿瘤组织、坏死组织及肺不张[20]。一项小样本(n=52)研究显示,增强超声引导下行周围型肺病灶(>2 cm)穿刺病理诊断准确率高达96.15%[21]。另外,经支气管B型超声引导穿刺还可用于纵隔淋巴结的分期。
CT引导已广泛用于肺小结节穿刺活检术,相对而言,直径6 mm~1 cm的小结节穿刺难度大,然而,只要遵循肺占位穿刺活检技术的基本原则,如仔细评估适应证及禁忌证,确定最优的穿刺体位,选择最短的肺内穿刺径路,避开血管、叶间裂等,该技术便可成功开展。另外,C臂CT可以实时透视,从不同角度观察病灶,并结合三维重建,确定最优的穿刺径路,准确、快速、安全地对小病灶实施活检术,值得临床推荐。Choo等[22]应用C臂CT引导穿刺小于1 cm的肺结节(n=107),穿刺活检敏感度、特异性及诊断准确率分别为96.7%、100%及98%,穿刺操作平均时间约10.5 min,气胸发生率仅为6.5%,咯血率为5.6%,显示了C臂CT虚拟导航引导肺小结节穿刺的显著优势。与大病灶穿刺活检相同,同轴技术穿刺有利于多次活检,而不增加并发症和种植风险,在部分肺小结节穿刺中亦可应用。
根据取样针内径的大小分为粗针(18~20 G)和细针(21~25 G)。用不同型号针取样主要取决于结节的位置、大小和相应的医疗资源。细针所获取的样品主要是依据细胞的形态来进行病理诊断,缺乏组织的结构信息;粗针所获取的组织包含有结构和细胞形态的信息。虽然目前多数研究表明,在能取到样品的前提下,两者诊断的准确性和副作用差异无统计学意义[23]。但在临床实践中二者仍具有以下的差别:(1)取样范围:粗针适用于短距离取样而局限于进针点附近,而细针取样距离长,适用的范围更广;(2)结节内取样:细针相对灵活,在达到结节后可以小范围内扇形取样,而粗针不适于前后左右移动;(3)细针适用于细胞成分多的肿瘤,在影像上表现为非实性结节(磨玻璃样),而粗针无此限制,但要避开血管丰富区域;(4)样品量:上皮源性的恶性肿瘤具有向间质组织转化而丢失上皮细胞间紧密连接的特点,细胞之间疏松而容易被细针吸取[24];粗针有可能取到相对多的间质结缔组织,但可以通过较多的切片来弥补单张切片细胞少的问题;(5)对分子检测的影响:细针、粗针所取样品的固定方式不一样,导致DNA的质量有所不同。研究显示细针获取的标本固定时DNA质量更好[25-27],但仍需大量样本验证此结论。在实践中两种取样方式为互补关系,譬如,在粗针活检取得组织的同时,将组织在玻片上涂抹制作细胞学涂片。近年来,分子检测在肺癌的诊治中具有重要地位。一般情况下,应用18~25 G穿刺针活检获取的细胞或组织可足够用于肺癌单基因或多基因分子检测[28-29]。
穿刺引起气胸的比例取决于操作者的经验、活检针的直径、穿刺的距离以及是否伴有肺部阻塞性疾病。肺小结节(<2 cm)穿刺气胸发生率为6.8%~42.0%[30-34],与肺占位性病变穿刺气胸发生率9%~54%并无明显差异[35],表明小结节穿刺活检并未增加气胸风险。此外,经皮CT引导下穿刺增加了出血风险[36]。然而,因气胸和出血需要住院处理的患者比例很低[30-34]。肿瘤经针道种植转移至肺、胸膜、胸壁极其少见,特别是同轴穿刺针的应用,该并发症在临床罕见。一项大样本(n=68 346)综述研究显示经皮胸部肿瘤穿刺活检术后针道转移率仅为0.012%,穿刺活检术与针道转移的时间间隔平均为2.6月[37]。总之,肺结节穿刺活检术较为安全,阳性诊断率高,临床可常规开展。
3 肺活检病理的重要性
对肺癌患者而言,医学的最大价值在于早期发现侵袭性强的肿瘤,从而达到降低肺癌死亡率的目的。这需要多个学科的密切合作,包括胸部内科、胸部外科、肿瘤科、影像科和病理科等,其中,病理诊断是最终确定肺结节性质的方法。在当前的医疗实践中,随着分子病理的进展,病理的作用尤为重要。
3.1 结节的定性
现代影像技术与临床相结合诊断肺恶性肿瘤有很高的敏感度,在实践中面临的主要问题是假阳性结节。根据目前的资料,即使在国内顶尖的专科医院,影像检查仍然有高达20%的假阳性率,这是由于影像本身的局限性所致。临床怀疑肺癌的庞大人群基数会带来很多个人和社会问题,诸如患者和家庭的精神与经济压力、随访的困难及医疗资源的消耗。影像上有多种类似肺癌的疾病,最常见的是各种原因引起的炎性结节,包括感染或者非感染性因素,这种结节因为炎性细胞代谢率高,PET-CT的信号会有轻度到中等程度的升高,进一步增加了错误判断的概率。让诊断变得更复杂的另一个原因是一些肿瘤本身代谢低,PET-CT信号弱,如高分化角化型鳞状细胞癌、低度恶性内分泌肿瘤及贴壁生长型腺癌[38]。因此,当PET-CT应用在筛查诊断时,对于轻度到中度糖代谢升高的肺结节,应特别注意其特异性。
病理对恶性肿瘤在组织细胞形态上的诊断基本原则是“克隆性异常生长的细胞”,挑战性在于:(1)克隆性生长可以被炎性细胞背景遮掩;(2)各种原因引起的细胞反应性变化和一些高度分化、形态异型性不明显的肿瘤具有组织形态上的类似性;(3)缺乏可以区分良恶性肿瘤的生物标志物。判断良恶性肿瘤的主要依据是形态学,免疫组织化学检测有助于对分化差的肿瘤进行分型。对病理专业医生而言,难点在于良恶性疾病的诊断不是由某一个形态学特点来决定的,而是由多个因素综合决定的。总体来说,主要基于组织结构和细胞形态两方面来定性诊断:一方面是复杂的生长结构,表现为细胞拥挤、重叠生长,形成突起、乳头状、腺泡样及筛状结构,图1A显示了肺腺癌的克隆性生长,虽然细胞核的异型性不明显,但出现了复杂的生长结构,局部形成筛状结构;另一方面是细胞核的异型性,具体表现为细胞核增大(至少是成熟淋巴细胞的两倍)、核质比增加、核深染、核膜不规则、染色质粗糙及具有明显增大的核仁,见图1B,虽然没有图1A的复杂结构,但细胞核的异型性明显,细胞核深染、不规则及高核质比,局部有瘤细胞的叠加和紊乱性生长,而且脱落进了肺泡腔;此外,细胞核染色质的性质是定义细胞异同的主要指征,如图1B所示,虽然细胞核相互之间异型大,但核染色质形态相似,所以仍属于克隆性生长。
小活检取样少,存在样品是否具有代表性的内在问题。部分标本病理特征可能不典型,存在一些和低度恶性肿瘤细胞形态相似的良性细胞,如反应性增生的肺泡上皮细胞、鳞状化生细胞、巨噬细胞及间皮细胞,后两者可以通过免疫组织化学检测来区分细胞的来源,而反应性增生的肺泡上皮细胞和鳞状化生细胞需要结合临床、影像和其他病理信息来综合判断是否有引起肺细胞反应性变化的原因,见图2。
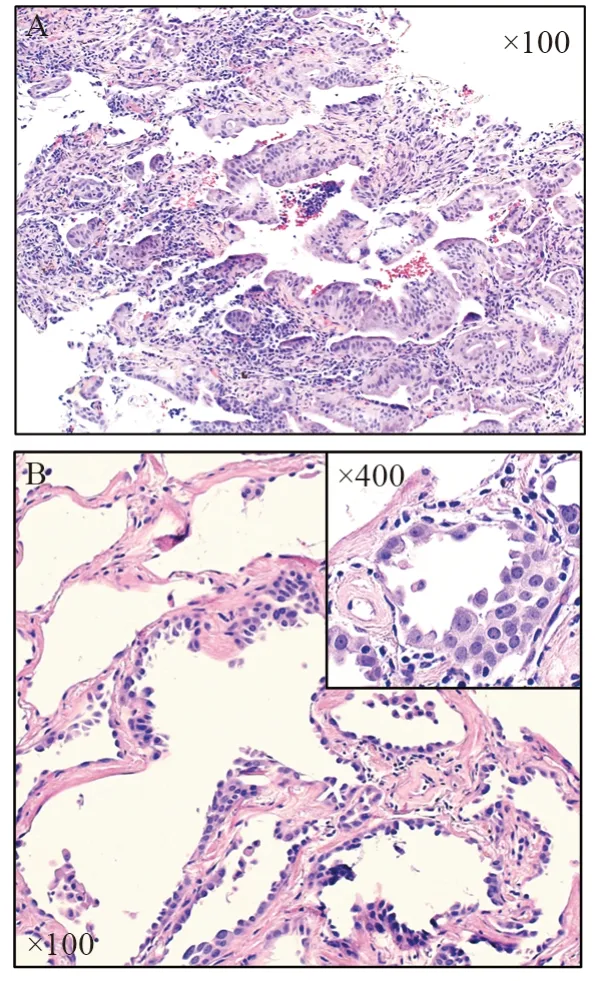
图1 恶性肿瘤的复杂结构和异型细胞Figure1 Adenocarcinoma with complex structure or atypical cytology features
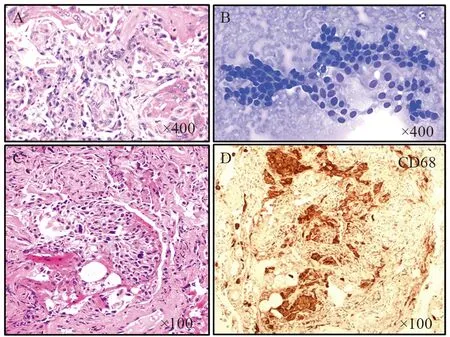
图2 形态学上与分化好的恶性肿瘤细胞类似的常见反应性增生细胞Figure2 Benign conditions mimicking malignant cells
3.2 肺癌的分型
肺癌病理分型决定了不同的治疗方案。例如,因为潜在出血,不推荐血管内皮生长因子抑制剂(Bevacizumab)用于晚期肺鳞状细胞癌[39]。最常见的三种肺癌类型是腺癌、鳞癌和内分泌肿瘤,占所有肺恶性肿瘤的99%以上。内分泌肿瘤分为低度恶性和高度恶性,最常见的是高度恶性的小细胞肺癌,占肺恶性肿瘤的13%。对于小活检的病理分型,旧版世界卫生组织关于肺肿瘤分型(2004年)只要求区分是否是小细胞肺癌。随着肺癌分子病理和靶向治疗的进展,新版肺肿瘤分型(2015年)重点添加了关于小活检对肺癌分型的要求和标准。表1来源于世界卫生组织对肺癌小活检的分型和诊断建议,结合当前实践,我们稍作修改,特别增加了常见细胞病理诊断报告术语[24,40]。形态学是首要的判断标准,见图3A,小细胞肺癌粗针取样的典型病理形态特点为低倍镜下成团或者成片的深染细胞浸润性生长,常伴有肿瘤细胞坏死和挤压状假象。高倍镜下细胞核深染,胞质较少,核质比高,核膜不规则,细胞核相互靠近挤压可形成铸模样结构,伴有大量的核分裂相和细胞凋亡核碎片。在细针取样的细胞病理中,镜下可见相对细碎、均一的染色质,偶有小核仁和中等程度的胞质量,但出现明显的核仁(定义为低倍镜下即可明确观测,核仁和核的直径比接近1:3)和大量胞质时要慎重考虑。图3B~3F显示了在小活检中其他具有相似形态学的疾病,主要包括淋巴瘤、小细胞型肉瘤、黑色素瘤、低度恶性内分泌肿瘤、低分化鳞癌及腺癌。鉴别诊断主要依靠免疫组织化学检测,但要在形态学的基础上有针对性地选用。对于小活检标本要尽量保存足够量的瘤细胞用于可能的分子检测。原则上,角蛋白抗体阳性基本排除了前三种疾病(淋巴瘤、小细胞型肉瘤及黑色素瘤),细胞分裂标记指数Ki67高于50%基本排除了低度恶性内分泌肿瘤,p40/p63弥漫性细胞核强阳性支持鳞癌。鉴别诊断的最大难点来自于低分化腺癌伴有神经内分泌分化特征,以及约10%的小细胞肺癌丢失了神经内分泌分化的特点[41],这需要结合更多的临床特征加以鉴别。
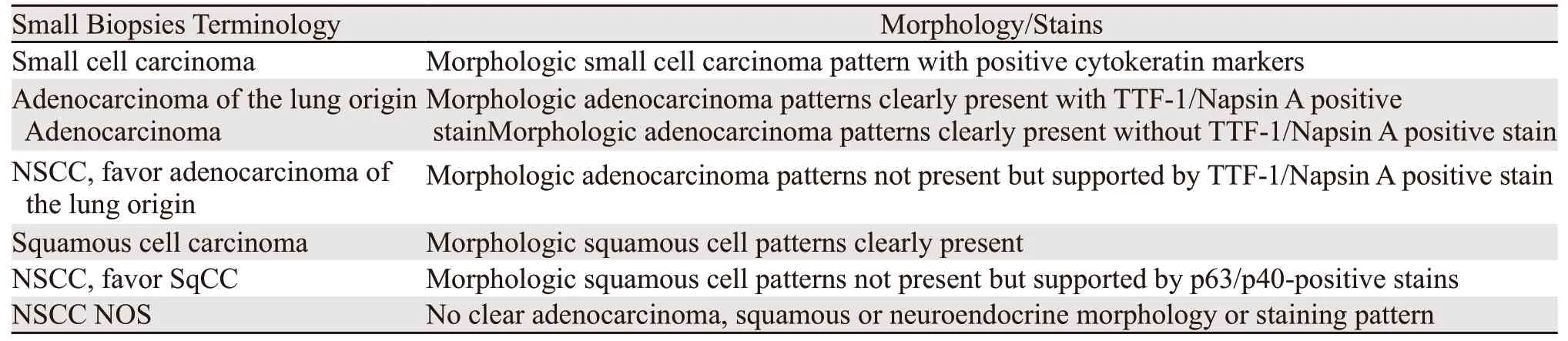
表1 肺结节小活检临床报告相关术语Table1 Terminology and interpretation in small biopsies
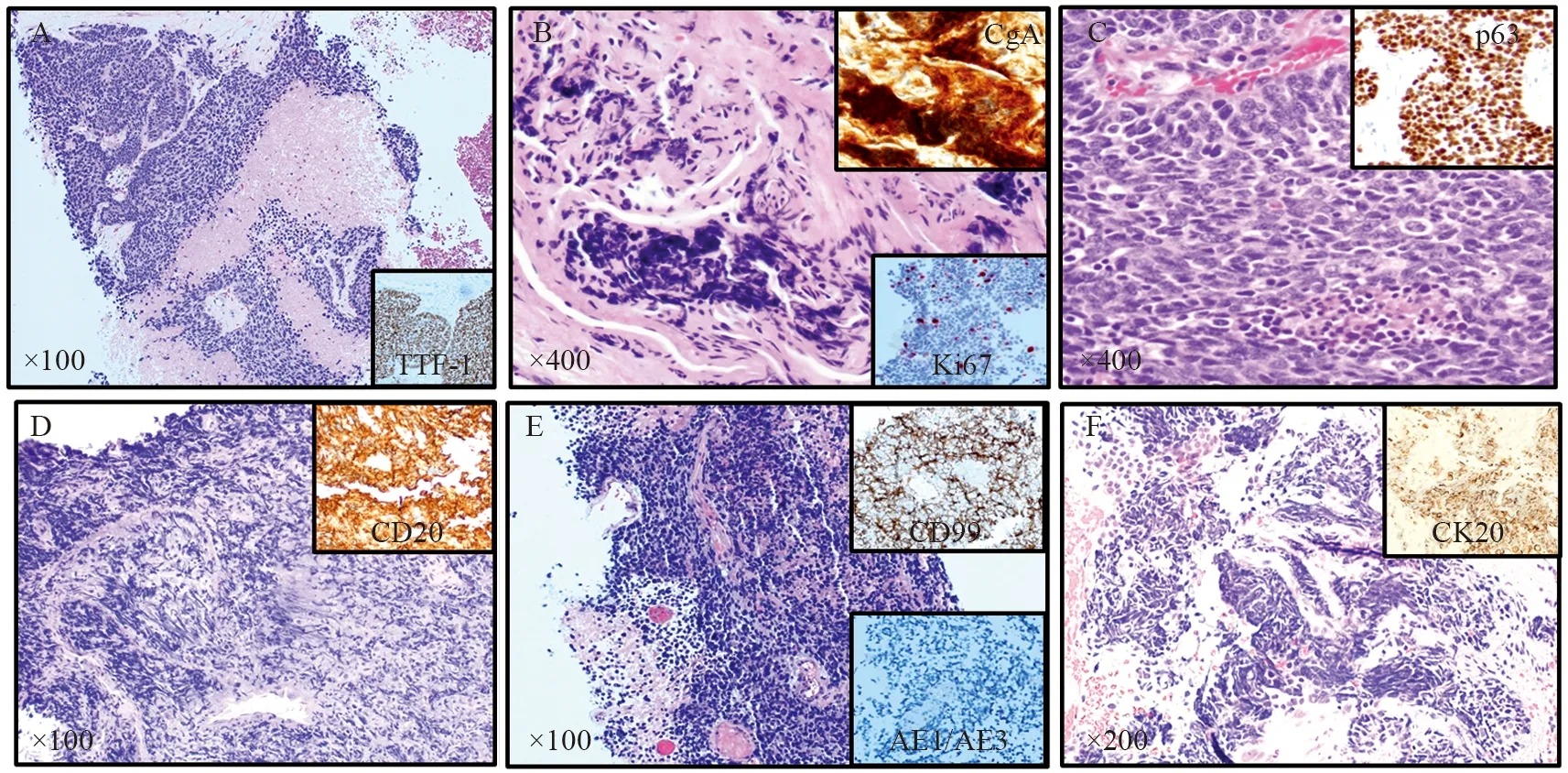
图3 肺活检小细胞癌病理特征及鉴别诊断Figure3 Small cell carcinoma and mimickers in small biopsy
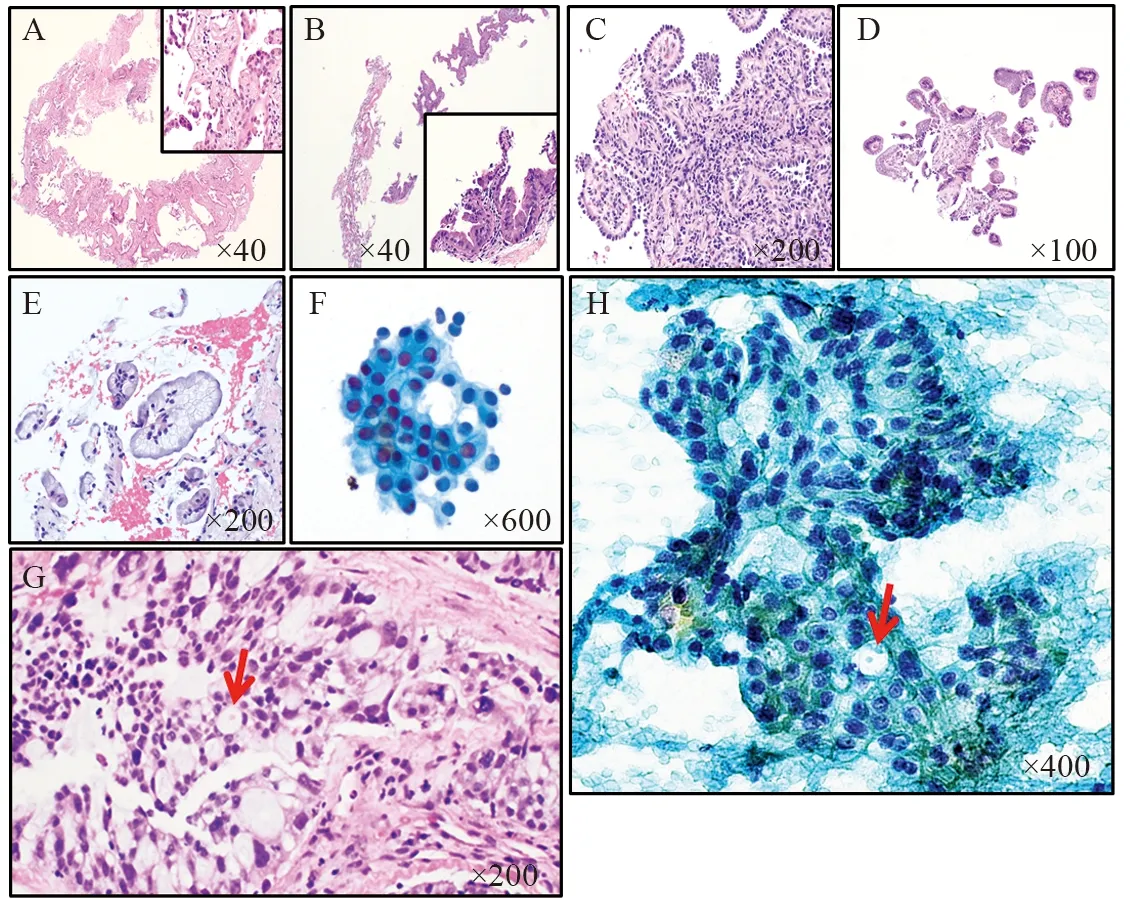
图4 肺腺癌的多形性Figure 4 Morphologic variants of lung adenocarcinoma
腺癌是肺癌最常见的类型,表现为多形性,见图4。镜下见腺体结构或者胞质内黏液,便可诊断为腺癌,免疫组织化学检测TTF-1细胞核染色或者NapsinA胞质颗粒样染色都支持肺原发腺癌的诊断,特别注意局部或弱的免疫组织化学染色亦支持腺癌的诊断。腺癌主要有5种病理形态:贴壁生长型、腺泡型、乳头型、微小乳头型及实性生长型,后两种形态的预后最差,贴壁生长型预后最好(肿瘤直径>5 mm~≤3 cm定义为原位癌)。因为肺癌病灶异质性大,对小活检来讲,不建议对腺癌提出进一步分型的要求,作出腺癌诊断即可,并保留样品做分子病理检测。粗针样品因为有结构信息,诊断相对明确。细针样品缺乏一定的组织结构,多数样品需要免疫组织化学检测的支持,对于样品量有额外的要求。所以在条件具备的情况下,安排细胞病理专业技术人员或者病理医生现场对取样进行初步的评判,指导操作医生每次取样的合格程度,这个过程称为“快速现场评判”(rapid on site evaluation,ROSE)[42],具有经济高效、减少穿刺的不良反应及基于初步判断合理处理样品的优点[43],缺点是需要有相应的资源配备,更适合有丰富资源和专业人员的大医院。
鳞癌在肺癌中的发生率仅次于腺癌。小活检对于分化好的角化型鳞癌在形态上就可以作出评判,例如,图5A~5B角化蛋白和细胞间桥都是鳞状细胞分化的标志,在细针取样巴氏染色中表现为桔红色细胞质和异型性细胞核,见图5C。但是,对于分化差的鳞癌需要免疫组织化学检测的支持。不同于TTF-1或NapsinA局部弱染仍然支持腺癌的情况,鳞状细胞分化的支持需要弥漫性细胞核p40/63的强染,以避免小样品中肺正常基底细胞和化生细胞局部染色导致的过度评判[44]。小活检诊断的难点之一是与鳞状化生细胞的鉴别。鳞状化生是支气管上皮细胞对外界刺激的反应。一些刺激因素所致的肺部影像可能类似肺肿瘤,特别是伴有空腔的病变。由于取样代表性的问题,细针取样分化好的鳞癌和鳞状化生在形态学上可能完全相似,见图5C~5D。
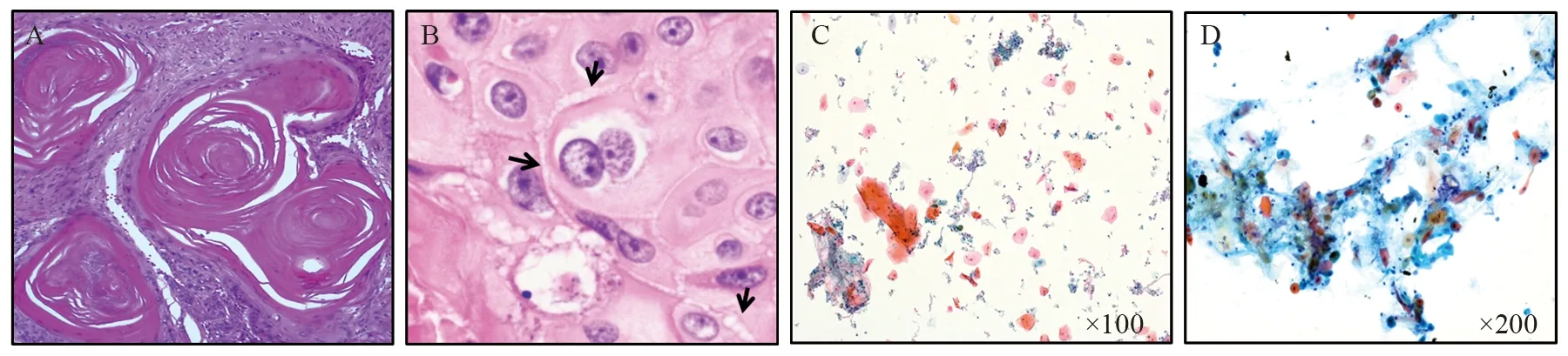
图5 肺小活检鳞状细胞癌及鳞状化生的特征Figure5 Characteristics of squamous metaplasia and SqCC in small biopsy
3.3 小活检对治疗的指导作用
虽然病理的形态学对预后有一定的影响,但目前尚不能通过组织细胞形态特点来预测肿瘤的侵袭性。肿瘤对生存率的影响最可靠的因素仍是临床或病理分期。在筛查中,一旦确诊恶性肿瘤,一般依据临床或病理分期制定相应的治疗策略。手术仍然是早期(Ⅰ期和Ⅱ期)肺癌最为有效的治疗手段。小活检诊断为小细胞肺癌,基本上多数患者无手术适应证,主要治疗方案为传统的放化疗。小活检诊断为腺癌,对于手术不可切除的病例,除了传统的化放疗外,还有近些年发展迅速的靶向治疗和免疫治疗,这需要进一步的分子检测来确定,目前FDA批准的分子检测主要包括免疫组织化学检测ROS1、ALK和PD-L1;基因测序检测EGFR、Ras等驱动基因突变;FISH检测ROS1和ALK的转位。其他靶向治疗相关的检测仍在进一步临床试验中,相信不久的将来会有更多特异的治疗选择。基因测序的前提之一是要求有腺癌的成份。基于肺癌的异质性,若小活检不能确定肿瘤类型,一般建议行基因检测,以免错失更精确的治疗。另外,对于分化好的鳞癌不推荐基因突变检测,但建议行PD-L1免疫组织化学检测。最新的分子病理肺癌指南特别强调了关于细胞病理各种样品的分子检测适用性,但需要分子病理实验室的进一步验证[45]。目前基于肺癌分期临床处理的基本原则见图6,具体细节还需结合临床实际情况。
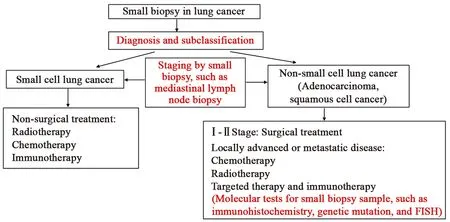
图6 肺小活检病理在临床诊治中的作用Figure6 Pathological role of small lung biopsies on clinical diagnosis and treatment
4 结论
肺结节活检是肺癌早期筛查及规范处理早期肺癌的关键环节。在当前的医疗实践下,其作用不限于传统的病理确诊和分型,还包括病理分期,以及为分子检测提供标本。随着肺癌研究的快速进展,小活检病理将发挥更大的作用,多学科医生间协作是当前和未来更有效地通过小样品诊断和指导肺癌治疗的保证。
