二代线性探针技术在结核分枝杆菌耐药性检测中的价值
2019-11-12江丽娜穆成孙蕊王志锐戴文汐王春花
江丽娜 穆成 孙蕊 王志锐 戴文汐 王春花
结核病作为单一感染源的全球十大致死疾病之一,目前因其死亡的患者例数已经超过艾滋病[1]。世界卫生组织(World Health Organization,WHO) 报告指出,2017年全球大概有1000万例结核病患者,单耐利福平患者55.8万例,其中82%为耐多药肺结核(MDR-PTB),约50%的MDR-PTB患者集中在印度(24%)、中国(13%)、俄罗斯(10%)[1]。MDR-TB已经迅速发展为全球重要的公共健康问题,特别是在发展中国家,给传染病的预防和控制带来了巨大的挑战。
及早发现和治疗MDR-TB对有效控制及遏制结核病的传播和预防起着重要的作用[2]。一直以来,表型药物敏感性试验(简称“比例法药敏试验”)是抗结核药物耐药性检测的金标准,但是长达几周至2个月的检测时间严重影响了临床诊断和治疗。故而基因型分子药敏试验检测技术快速发展起来。2008年,WHO推荐可以应用分子线性探针技术作为快速检测MDR-TB的手段[3]。GenoType®MTBDRplus assay是德国Hain公司研发的已被临床广泛应用于检测结核分枝杆菌复合群及其对利福平和异烟肼耐药性,以及识别耐药相关基因突变位点的分子生物学技术[4]。2012年Hain公司在原有基础上改进研发了GenoType MTBDRplus VER 2.0(简称“GenoType 2.0”),较GenoType®MTBDRplus assay具有更高的敏感度和特异度,在临床及全球结核病疫情严重地区被大力推广[3-4]。为了解GenoType 2.0的检测效能,天津结核病控制中心参比实验室使用GenoType 2.0试剂盒检测培养阳性菌株,并与比例法药敏试验进行检测效能比较,为该技术的应用提供一定参考。
材料和方法
一、研究材料
1.样本来源:收集2017年4月至2019年4月天津市结核病控制中心参比实验室中疑似肺结核患者的痰标本共6315份,对其中412份痰涂片阳性标本行BACTEC MGIT 960液体培养,排除39份培养阴性标本;对373株培养阳性菌株进行菌种鉴定,排除23株经鉴定为非结核分枝杆菌(non-tuberculosis mycobacteria,NTM)、1株培养阳性但GenoType 2.0无法判读的菌株,将鉴定为结核分枝杆菌(MTB)的349株菌株作为研究对象,分别采用比例法药敏试验和GenoType 2.0检测其对利福平、异烟肼的耐药性,比较比例法药敏试验、GenoType 2.0,以及GenoType 2.0+比例法检测情况,其中GenoType 2.0+比例法的耐药数据统计以其中任一方法耐药即判定为“耐药”。并以比例法为标准,分析GenoType 2.0的检测效能和GenoType 2.0检测的突变基因分布情况。
2.试剂及设备:GenoType 2.0试剂盒(德国HAIN Lifescience公司);BACTEC MGIT 960液体培养基(珠海贝索生物技术有限公司);线性探针耐多药检测设备GTblot-20全自动杂交仪(德国HAIN Lifescience公司);超声仪D-78224(德国Elma 公司);基因扩增仪Ag-22331(德国 Eppendorf 公司);低温离心机5430R(德国Eppendorf公司);恒温金属浴D-91052(德国PEQLAB公司)。
二、菌种鉴定和比例法药敏试验
使用硝基苯甲酸(PNB)培养基对373株培养阳性的菌株进行菌种鉴定。根据《结核病诊断实验室检验规程》[5],按照实验室标准化程序,分别采用含利福平40 μg/ml、异烟肼0.2 μg/ml的培养基按照WHO推荐的比例法药敏试验进行菌株耐药性检测及结果判定[6-7]。
三、GenoType 2.0检测
本实验基于多重聚合酶链式反应(polymerase chain reaction,PCR)扩增,扩增产物通过反向杂交技术与预先固化在试纸条上的特异性探针杂交,通过杂交条带的显色情况来判定MTB对利福平和异烟肼的耐药性。基于线性探针方法条带技术,严格按照说明书进行操作,步骤包括结核分枝杆菌复合群的基因组提取、生物素标记引物的PCR扩增、反向杂交三部分。实验检测的3个突变基因分别为:rpoB为利福平耐药;inhA为异烟肼低水平耐药;katG为异烟肼高水平耐药,在杂交带上3个基因的野生型和突变型均可以体现。每个标本需要1个探针试条,每个探针试条有27个反应区,包括标记物质量控制(简称“质控”,CC)、 扩增质控(AC)、 结核分枝杆菌复合群(TUB)、野生型和突变型探针。
1.核酸提取与PCR扩增:DNA提取试剂盒GenoLyse®kit包括裂解液(LA-LYS) 与中和缓冲液(A-NB)。每个菌株取1平环菌落放入含100 μl裂解液的1.5 ml离心管中,振荡混匀。将悬浮液 放于95 ℃金属浴灭活5 min,短暂离心后(离心半径为10 cm,3000 r/min 离心30 s),加入100 μl的中和缓冲液,振荡5 s后混匀。再采用离心半径为10 cm,14 000 r/min 离心5 min 后转移上清至另一1.5 ml离心管,用于扩增。扩增体系50 μl:由10 μl的AM-A 试剂(包括10×PCR缓冲液,4种核苷酸,DNA扩增酶)、35 μl的AM-B试剂(包括MgCl2,生物素标记的引物和染液)和5 μl提取的基因组模板组成。扩增条件:95 ℃ 15 min,1个循环;95 ℃ 30 s,65 ℃ 2 min,10个循环;95 ℃ 25 s,50 ℃ 40 s,70 ℃ 40 s,20个循环;70 ℃ 8 min,1个循环;4 ℃ 保存。
2.反向杂交检测:杂交反应在预热的GTblot-20全自动杂交仪上进行。使用前,45 ℃预热杂交缓冲液(HYB)和严格漂洗液(STR)直至溶液没有结晶。分别取20 μl PCR产物与20 μl分离试剂混合,加入杂交盘,室温变性5 min。分别谨慎加入带有探针的测试条,并将杂交盘放入已经预热的GTblot-20全自动杂交仪,进行杂交及显色。其余步骤严格按照说明书进行。
3.结果判读:按照使用手册判读结果,即标记物质控条带(CC)显色,表示标记物结合并与底物反应有效;扩增质控条带(AC)显色,可排除提取过程、扩增和扩增抑制剂引起的错误;TUB显色判读为结核分枝杆菌复合群,未显色则为未检测到MTB。所有野生探针(利福平有8个野生探针;异烟肼katG基因有1个野生探针,inhA基因有2个野生探针)均显色且所有突变探针均未显色判读为敏感;任一野生探针未显色或任一突变探针显色判读为耐药。
四、统计学处理
采用SPSS 11.5软件对结果数据进行统计学分析。不同方法检测MTB耐药性结果的比较采用χ2检验,以P<0.05为差异有统计学意义。以比例法检测结果为标准,计算GenoType 2.0的检测效能,即敏感度、特异度、阳性预测值、阴性预测值、符合率、Kappa值。其中Kappa值<0.40表示一致性差,0.40
结 果
一、GenoType 2.0和比例法药敏试验检测结果分析
采用GenoType 2.0和比例法药敏试验分别对349株MTB临床分离株进行利福平和异烟肼的耐药性检测,并统计两种方法联合检测情况。结果显示,GenoType 2.0、比例法药敏试验和GenoType 2.0+比例法药敏试验检测菌株对利福平和异烟肼在敏感、单耐、耐利福平+异烟肼(简称“耐两药”)检出率间的差异均无统计学意义(P值均>0.05),见表1。
二、GenoType 2.0对利福平和异烟肼的耐药性检测效能
以比例法药敏试验为参考标准,GenoType 2.0对利福平和异烟肼耐药性检测的敏感度、特异度、阳性预测值、阴性预测值、符合率、Kappa值见表2。其中,2种技术对利福平和异烟肼耐药性检测结果进行一致性检验,Kappa值分别为0.91、0.97,均有较好的一致性。对其中GenoType 2.0检测利福平为敏感而比例法检测为耐药的4株菌株经GeneXpert MTB/RIF重复试验后,结果仍然为对利福平敏感,但未进行基因型鉴定。

表1 不同药敏试验方法检测349株MTB菌株对利福平和异烟肼的耐药情况 [株(检出率,%)]
注在敏感、单耐、耐两药菌株间的分布比较上,a为GenoType 2.0与比例法比较,b为GenoType 2.0与GenoType 2.0+比例法的比较,c为比例法与GenoType 2.0+比例法的比较;GenoType 2.0+比例法的耐药数据统计以其中任一方法耐药性即判定为“耐药”,其中单耐利福平菌株在GenoType 2.0检测中为单耐药,而在比例法检测中为耐两药,统计时纳入“耐两药”组中
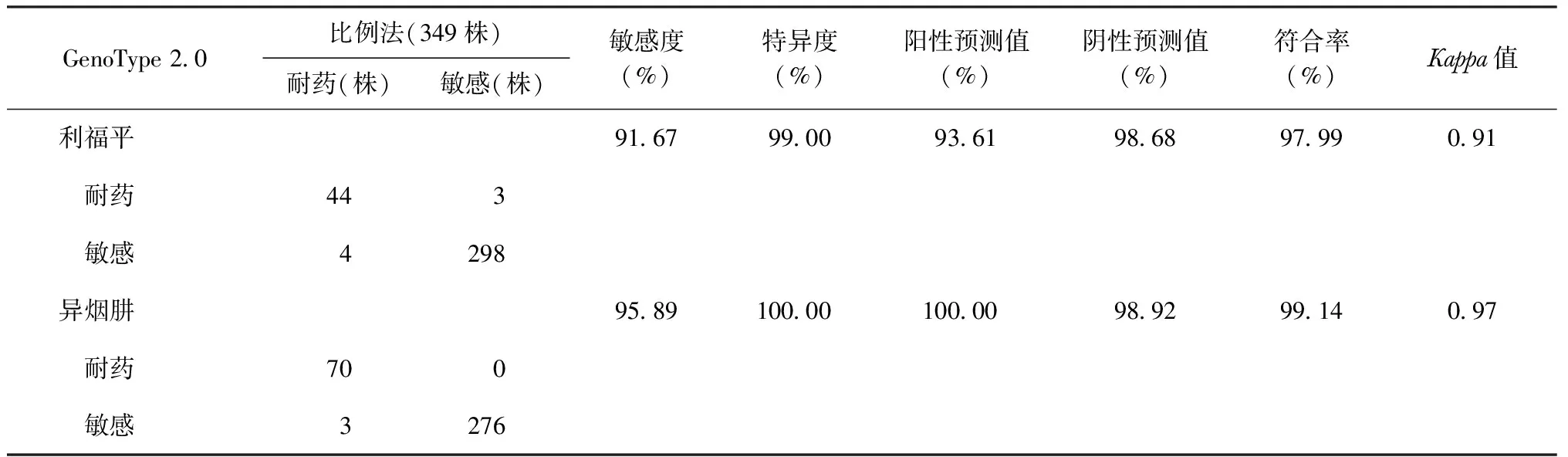
表2 以比例法药敏试验为参考标准评价GenoType 2.0对利福平、异烟肼耐药性检测的效能
注敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%;符合率=(真阳性例数+真阴性例数)/患者总例数×100%
三、GenoType 2.0检测利福平和异烟肼耐药性相关的突变基因
利福平和异烟肼耐药性相关的突变基因发生频率的分布见表3。在47株对利福平耐药的菌株中,25株(53.19%)野生型(WT)8条带缺失(530~533密码子),且rpoBMUT3探针显色;19株(40.43%)rpoB位点突变发生在WT 1、2、3、4、7中,其中发生在WT1有2株、WT2与3有2株、WT3与4有7株、WT7有8株,且相关突变探针显色;1株(2.12%)仅出现WT2条带的缺失,判读为对利福平耐药;2株(4.26%)仅出现WT8条带缺失,且未有相关突变探针显色,判读为对利福平耐药。在70株异烟肼耐药菌株中,katG高浓度耐药突变共51株(72.86%),其中以S315T1突变为主(47株),占katG突变总数的92.16%;inhA低浓度耐药突变共19株(27.14%),其中以C15T位点突变为主(17株),占总数的89.47%。GenoType 2.0 技术检测的部分条带见图1。
讨 论
耐药结核病的出现不仅给结核病的感染控制增加了难度,而且也严重威胁着人们的健康。因此,及时准确检测出MTB的耐药性,不仅有助于及早发现MDR-TB患者,有效控制结核病的传播,也可为患者的治疗用药提供依据。传统的比例法药敏试验因其能给出最准确的药敏试验结果而成为一直以来的检测金标准,但由于其检测周期过长,需2~3个月的时间,明显延误患者的诊断及治疗。自2008年开始,WHO向全世界推荐德国Hain公司生产的GenoType 1.0代耐多药结核分子检测方法(GenoType®MTBDRplus assay),并在临床上广泛推荐使用,但是,这种方法只能检测培养阳性或者涂片阳性的标本,且敏感度和特异度都不是很高[8];至2012年,Hain公司对GenoType 1.0代试剂盒进行了改进,推出了可应用于涂片阴性的标本、且检测周期短(24 h即可完成检测)、敏感度和特异度大幅提高的Hain 2代试剂盒(GenoType 2.0)。

表3 GenoType 2.0检测MTB对利福平与异烟肼耐药性相关突变基因的分布
注“-”指未检出

从左到右:条带1,阴性对照(水);条带2,阳性对照(MTB标准菌株,ATCC27294);条带3,inhA突变低水平单耐异烟肼;条带4,非结核分枝杆菌;条带5,单耐利福平;条带6,耐低水平异烟肼的耐多药肺结核;条带7,MTB并对利福平和异烟肼敏感;条带8,单耐利福平;条带9,MTB并对利福平和异烟肼敏感;条带10,katG突变耐高水平异烟肼的耐多药肺结核;条带11,GenoType 2.0检测自带比对条图1 GenoType 2.0 检测的带型及基因型的部分条带展示
从2012年GenoType 2.0问世以来,这种改进的方法在国外被陆续采用,而我国还没有在临床上大范围地推广。目前为止,只有上海一家医院采用了此方法,并分析了其在临床应用中的价值。该报道中,对利福平耐药性检测的敏感度为100.00%、特异度为97.30%,对异烟肼耐药性检测的敏感度为84.44%、特异度为96.94%[9];而在本实验中,对利福平耐药性检测的敏感度(91.67%)低于上述研究,也低于其他的研究报道[3,10](认为GenoType 2.0对利福平和异烟肼耐药性检测的敏感度和特异度均在95%~100%之间),而对利福平耐药性检测的特异度(99.00%),对异烟肼耐药性检测的敏感度(95.89%)和特异度(100.00%)均高于上海的研究,但与文献[3,11]一致。认为本研究对利福平耐药性检测的敏感度低,可能与有4株GenoType 2.0技术检测为敏感而比例法药敏试验结果为耐药的菌株,对利福平耐药的基因突变发生在GenoType MTBDRplus检测的基因之外,导致本检测方法未能检测到有关。而且,这4株菌株经GeneXpert MTB/RIF重复试验后,结果仍然为对利福平敏感,进一步证明4例菌株对利福平的耐药基因突变发生在GenoType 2.0 检测范围以外。且认为不能检测到的基因突变可能与同一国家不同地区流行菌株基因型的差异有关,但本研究未能进一步验证菌株基因型。另外,上海的报道是以痰涂片阳性为纳入标本,而本研究则以培阳菌株为实验标本,使得本实验对利福平和异烟肼耐药性检测的特异度均很高。最新的一篇报道指出,在125株MDR-MTB中,有38株(30.4%)菌株的利福平耐药位点都不在利福平耐药核心区域内,如果使用目前利福平核心区域的方法检测就会遗漏约1/3的利福平耐药菌株[11],说明分子生物学检测耐药基因的范围不仅需要进一步扩大,而且也说明比例法药敏试验仍然是检测MTB耐药表型的金标准,并不能被分子生物学方法完全替代。
本研究结果显示,对于利福平和异烟肼的耐药菌株,联合检测(以任一方法耐药即判定为耐药)的总耐药检出率(13.75%和20.34%)高于GenoType 2.0(13.47%和20.05%)和比例法(12.03%和19.77%),说明联合检测能提高耐药性检测的阳性率,但三组间两两比较差异均无统计学意义,且Kappa值较高,说明两种方法对于培阳患者耐药菌株的检测结果具有高度一致性,也进一步说明了GenoType 2.0 技术可以独立作为临床诊断的标准[12];但考虑到GenoType 2.0技术仅能检测到最常见的katG/inhA和rpoB基因突变,对其他基因的沉默突变或罕见突变不能准确判定,故目前临床诊治中仍进行联合检测,以避免漏诊,有利于耐药结核病的防控和患者及时诊治。
本研究结果显示,47株利福平耐药菌株中,有rpoB基因突变且出现突变条带的利福平耐药一共44株(93.62%),提示rpoB基因突变是利福平的高发耐药基因,与其他研究结论是一致的[11,13]。在44株rpoB特异性突变菌株中,有25株发生在WT8(密码子S531L)上,且rpoBMUT3探针显色,占总数的56.82%,与其他国家的研究报道一致[10,13],说明密码子S531L突变是利福平耐药最常见的相关突变;8株发生在WT7条带(密码子H526D)上,占总数的18.18%;7株发生在WT3/4条带(密码子D516Y)上,占总数的15.91%;2株出现WT2/3条带缺失(510~517密码子缺失),参照说明书判读标准,即任何一种野生型探针缺失,菌株则判定为对利福平耐药,且比例法药敏试验鉴定为利福平耐药,与说明书一致,故判定该2株为利福平耐药;2株出现WT1条带缺失(505~509密码子缺失),占总数的4.55%,这种突变导致的利福平耐药非常少见,可能与细菌基因型差异相关。rpoB基因突变且未出现突变条带的利福平耐药3株,其中1株是WT2条带缺失(510~513密码子缺失)、2株是单独WT8缺失(530~533密码子缺失),若参照说明书判读标准,菌株应判定为对利福平耐药,但这3株菌株比例法药敏试验结果为利福平敏感,则以比例法为标准认为此3株为利福平敏感株,提示引起WT2、WT8缺失的密码子可能与基因的沉默突变有关,即虽然发生了基因的耐药突变,但是基因氨基酸的种类和序列并没有改变,不会影响菌株的耐药表型,故参考比例法药敏试验结果,菌株判定为对利福平敏感。
在70株异烟肼耐药菌株中,katG高浓度耐药突变共51株(72.86%),虽然略低于其他国家报道的异烟肼耐药比率[10,14],但仍是异烟肼耐药高发的主要因素,其中47株发生在密码子S315T1上,占总数的92.16%。余下19株(27.14%)的异烟肼低水平耐药是由于inhA突变引起,其中以C15T突变为主,这一比率高于其他报道[10-11,14]。考虑与不同国家和地区的结核病流行情况、菌株基因型的差异导致MTB基因突变有关[15],尤其是异烟肼低水平耐药和高水平耐药比率间的差异是比较大的,如不同国家和地区之间异烟肼耐药由katG突变引起的报告比率在31.8%~96.9%之间,由inhA突变引起的在1.5%~45.9%之间[16]。
GenoType 2.0技术虽然检测利福平和异烟肼的特异度高、检测周期短,但作为分子生物学方法对利福平耐药性检测仅限于rpoB基因,异烟肼耐药性检测只限于katG基因和inhA基因,而对于其他耐药基因和耐药位点的改变引起的耐药,或者其他耐药机制造成的耐药基因型与耐药表型不一致的耐药,本方法不能检测到,具有一定的局限性。但作为结核病高负担国家,GenoType 2.0 在耐药性检测的快速、高敏感度和高特异度方面对结核病患者的早诊断、早治疗意义重大,可以在有条件的地区推广使用。
