肾素原受体在IgA肾病中的表达及意义
2019-11-06徐晋徉何常胡斌
徐晋徉, 何常, 胡斌
(1.贵州医科大学 病理学教研室, 贵州 贵阳 550004; 2.贵州医科大学附院 病理科, 贵州 贵阳 550004)
IgA肾病(IgA nephropathy)是亚洲地区最常见的原发性肾小球疾病[1],也是导致终末期肾病的主要病因之一,其发病机制尚未完全明确,亦缺乏特异性治疗方法。有研究表明,肾脏局部肾素-血管紧张素(RAS)系统的激活在IgA肾病的发生发展过程中可能发挥着重要作用[2]。本研究选取肾素原受体(prorenin receptor,PRR)作为突破点研究RAS系统在IgA 肾病发病和进展过程中的作用。
1 资料与方法
1.1 临床资料
收集2010年1月-2017年9月病理科54例IgA肾病患者肾穿刺活检标本作为IgA肾病组,按病变程度分为局灶增生型20例(局灶增生组)、IgA肾病合并膜性肾病(membranous nephropathy,MN)20例(合并MN组)、新月体型14例(新月体组)。纳入标准:(1)肾脏穿刺活检标本经苏木素-伊红染色、过碘酸六胺银染色、马松三色染色、过碘酸雪夫染色,结合新鲜组织免疫荧光结果[免疫球蛋白IgG、IgA、IgM,补体C3、C1q,纤维蛋白原(fibrinogen,Fib)、乙肝表面抗原、乙肝核心抗体、幽门螺杆菌]以及电镜检查后,确诊为IgA肾病;(2)光镜下肾小球数目>8个/标本。另随机抽取20例经肾活检确诊为微小病变肾病患者为对照组。排除肝硬化、过敏性紫癜、乙型肝炎感染、系统性红斑狼疮、强直性脊柱炎及恶性肿瘤等系统性疾病引起的继发性肾小球疾病,排除先天性遗传性肾脏疾病,排除肾穿刺前有血管紧张素转换酶抑制剂或血管紧张素2受体阻滞剂药物治疗经历患者。两组患者性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。见表1。

表1 两组患者一般情况
1.2 方法
采用免疫组织化学染色法检测两组患者肾脏活检标本中PRR表达,按照试剂盒说明书进行操作。兔抗人浓缩型多克隆抗体ATP6IP2北京百奥思科生物医学技术有限公司,工作浓度为1 ∶200;通用二步法试剂盒(小鼠/兔增强聚合物检测系统)及DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。用PBS代替一抗作为阴性对照。
1.3 观察指标
PRR在肾脏组织中的表达情况,以每个标本切片分别选取肾小球区和肾小管区评估PRR的相对表达量。肾小管区:在显微镜下放大400倍摄取随机肾小管视野10个/高倍镜,对所选视野阳性信号用Image-pro Plus图像分析软件进行分析、以积分光密度(integrated optical density, IOD)表示PRR在肾小管间质中的相对表达量[3-4]。肾小球区:以阳性肾小球所占百分比[阳性肾小球所占百分比分为6级评分,无阳性肾小球计0分、阳性率≤20%计1分、阳性率 21%~40%计2分、阳性率41%~60%计3分、阳性率 61%~80%计4分、阳性率≥81%计5分]及染色强度两项评分之积来判断PRR表达程度[染色强度分为4级评分,不着色(-)计1分、浅黄色(+)计2分、棕黄色(++)计3分、黄褐色(+++)计4分]。每张切片分别由两位有经验的临床病理科医生单独读片,当评分存在差异时,通过同时使用双头显微镜阅片以达成共识。 免疫荧光IgA、IgG、IgM、C3、C1q、Fib沉积分为5级进行评分,(-)计0分、(+)计1分、(++)计2分、(+++)计3分、(++++)计4分。
1.4 统计学方法
2 结果
2.1 PRR在肾脏组织中的表达
在对照组和IgA肾病组肾组织中PRR均有不同程度的表达,肾小管区中PRR主要表达在肾小管上皮细胞,以胞质及胞膜为主,棕黄色,呈弥散性分布,但肾间质血管中未见明显表达;肾小球区中肾小球壁层、脏层上皮细胞均有表达,以胞膜为主,棕黄色,呈线性或颗粒性分布,见图1。肾小管区:IgA肾病组患者PRR表达水平高于对照组,差异有统计学意义(P<0.05);在IgA肾病组,随着病变程度的加重,PRR表达水平逐渐减少,局灶增生组PRR表达水平高于其余各组,差异有统计学意义(P<0.05)。肾小球区:对照组PRR表达水平低于IgA肾病各组,差异有统计学意义(P<0.05);在IgA肾病组,随着病变程度的加重,PRR在肾小球区域的表达逐渐增加,局灶增生组PRR表达水平低于新月体组,差异均有统计学意义(P<0.05)。见表2。
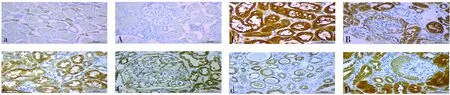
注:a、b、c、d为肾小管区,A、B、C、D为肾小球区;A、a为对照组,B、b为 IgA肾病局灶增生组,C、c为IgA肾病合并MN组,D、d为 IgA肾病新月体组。
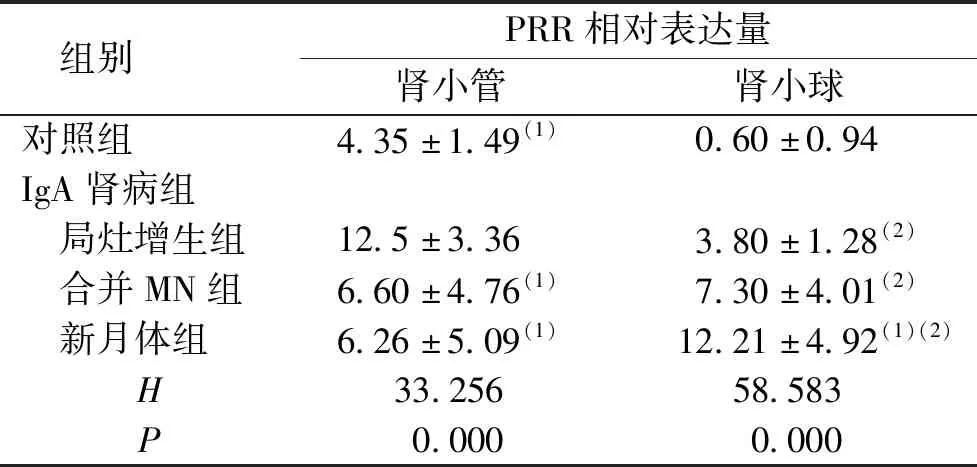
表2 IgA肾病组和对照组中PRR的相对表达量
注:(1)与局灶增生组比较,P<0.05;(2)与对照组比较,P<0.05。
2.2 PRR表达水平与免疫球蛋白及补体在肾小球沉积的关系
IgA肾病组PRR在肾小管区表达水平与IgA、IgM及Fib沉积呈正相关,与IgG沉积呈负相关,而在肾小球区的表达水平与IgA及Fib沉积呈负相关(P<0.05)。见表3。
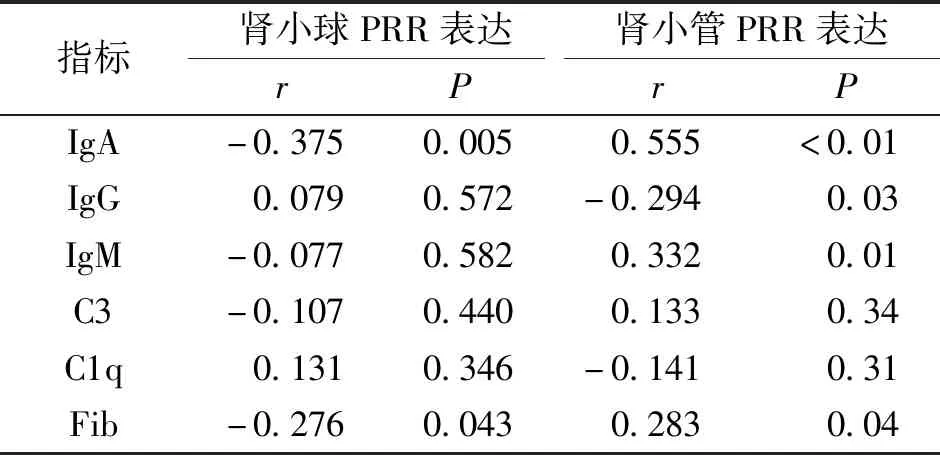
表3 PRR的表达水平与免疫球蛋白及补体在肾小球沉积的相关性
3 讨论
IgA肾病是世界上最常见的原发性肾小球疾病[5],肾活检免疫病理显示IgA或以IgA为主的免疫球蛋白及补体成分在肾小球系膜区呈弥漫性颗粒状或团块状沉积,有时伴有这些成分在毛细血管襻沉积而引起一系列临床及病理改变[6]。该疾病呈进展性,最终20%~40%的患者在20年内发展为终末期肾病[7]。尽管目前对于IgA肾病在基础和临床方面做了很多研究,但其真正的发病机制尚未明确,亦缺乏针对该疾病的特异性治疗。明确IgA肾病发病机制是指导预防、临床治疗、改善预后的关键。对于RAS系统基因的多态性的研究已经将肾脏疾病导致高血压的发病机制与IgA 肾病联系起来[8-9]。除经典RAS(循环RAS)外,局部组织如肾脏、心脏、血管壁、脑等组织还具有独立的RAS,主要对局部组织的生长分化和病理生理进行调节[10],肾脏中存在高水平的RAS中各种成分[11]。有研究发现,RAS系统基因多态性与IgA肾病的发生有密切关系[12]。也发现了血管紧张素Ⅱ-1型受体在IgA肾病患者系膜细胞中的过度表达与系膜细胞增殖、肾小球节段硬化和新月体形成有关[13]。有研究报道,可能与IgA肾病高度相关的蛋白中包括肾素原受体(PRR/ATP6AP2)[14],当其与肾素或肾上腺素结合时,能激活并增强RAS系统,其激活的通路可能独立于血管紧张素Ⅱ形成的通路[15-16]。
本研究结果显示,在MCD和IgA肾病中PRR均有不同程度的表达,但IgA肾病的表达量明显高于MCD,PRR主要定位在肾小管上皮细胞上,以胞质和胞膜为主,棕黄色,呈弥散性分布,肾小球壁层、脏层上皮细胞也有少量表达,以胞膜为主,棕黄色,呈线性或颗粒性分布,在肾间质血管及各类炎症细胞中未见明显表达。随着肾脏病变程度的逐渐加重,PRR在肾小管区域的表达量逐渐下降,而在肾小球区域的表达量逐渐增加,尤其在形成新月体的肾小球的壁层上皮细胞中明显表达,推测可能由于疾病进展至中晚期,大量的肾小管上皮细胞出现萎缩而导致蛋白的分泌的减少。通过相关分析可知, PRR在肾小管区表达与IgA沉积呈正相关,而在肾小球区的表达与IgA沉积呈负相关。
目前对于IgA 肾病发病机制的研究发现,IgA肾病是一种多因素作用的结果[5,17-19],原始缺陷在于异常的IgA1分子的产生,形成的半乳糖缺乏型Gd-IgA1对系膜细胞有较大亲和力,能抵抗肝脏清除,从而刺激系膜细胞活化增生。但系膜 IgA1 沉积后肾损伤的机制仍然不完全清楚。本研究发现,PRR在肾脏中的表达不仅与肾脏病变程度有关,也与IgA的沉积有关。综上推测,在IgA肾病的发生发展过程中,RAS系统可能起到一定作用,但其具体的作用机制还不十分清楚,其中PRR可能参与了IgA1在系膜细胞沉积后的一系列肾脏损伤机制中,通过检测PRR的表达对于推测IgA 肾病肾脏损伤程度及预后有一定参考价值,PRR可能成为调节肾素-血管紧张素系统新的治疗位点,目前公认的PRR拮抗剂柄区肽能对PRR竞争性抑制[20]。但其对于糖尿病肾病的治疗尚不可行[21]。对于其能否用于治疗IgA肾病仍需进一步研究。
