lncRNA ASB16-AS1在结直肠癌组织中的表达及对结直肠癌细胞增殖的影响*
2019-11-06石峰唐青魏晓为
石峰, 唐青, 魏晓为
(1.阜宁县人民医院, 江苏 盐城 224000; 2南京医科大学附属南京医院 肿瘤 内科, 江苏 南京 210006)
结直肠癌(colorectal cancer,CRC)是全球最常见的消化道恶性肿瘤之一。随着我国生活水平提高及饮食结构改变,CRC在国内的发病率及死亡率逐渐上升,位居全部恶性肿瘤的第4位[1-3]。随着医疗技术的发展,大多数CRC患者可以及时的进行手术治疗,但其平均存活率仍然小于30个月[4],因此,深入探索CRC的发病机制并寻找潜在的治疗靶点具有重要的临床意义。长链非编码RNA(long-non coding RNA,lncRNA)是一类长度大于200个碱基的非编码RNA,其在细胞增殖、凋亡、侵袭及转移的过程中起着重要的作用[5-6]。近期研究显示,LncRNA ASB16-AS1在恶性胶质瘤组织中表达量显著升高[7],提示与肿瘤发生发展存在潜在的关联,但其在CRC中的作用尚未见报道。本研究首先检测了LncRNA ASB16-AS1在CRC组织及其配对的癌旁组织中的表达,再采用特异性干扰片段下调了4株CRC细胞中ASB16-AS1的表达,比较4株CRC细胞的增殖情况及miR-185-5p表达;将含有ASB16-AS1野生型序列或突变序列的质粒与miR-185-5p mimic或阴性对照 mimic共转染至293T细胞,采用双荧光素酶法检测转染24 h后细胞的荧光强度,观察lncRNA ASB16-AS1对miR-185-5的调控作用,探讨ASB16-AS1与CRC发病的关系。
1 资料与方法
1.1 资料
1.1.1患者资料 选取2016年1月-2018年12月行手术治疗的CRC患者26例,其中女10例、男16例,平均年龄(61.4±8.5)岁;所有患者在手术前均未经过放化疗,无家族性肠息肉病史、肠道慢性疾病史。在患者签署知情同意书后于术中收集CRC组织及距离肿瘤边缘5 cm以上的结直肠组织作为癌旁样本,取材后迅速置于-80 ℃冷冻保存,术后病理检查均诊断为肠腺癌。
1.1.2细胞株 人CRC细胞株(HT-29、SW-480、SW-620及LOVO)以及T293细胞均购自上海中乔新舟生物科技有限公司,细胞均培养于含有10%胎牛血清及1%双抗的高糖DMEM培养液中,细胞置于37 ℃含有5% CO2培养箱中培养,每2~3 d传代1次,取对数生长期的细胞进行后续研究。
1.1.3主要试剂 细胞培养液及胎牛血清均购自Gibco公司, lncRNA ASB16-AS1 干扰片段及阴性对照干扰片段购自上海吉玛基因公司,Lipofectamine RNAiMAX、Opti及Lipofectamine 2000转染试剂购自Invitrogen公司;总RNA提取试剂及逆转录试剂盒购自TaKaRa公司,SYBR Green 逆转录定量 PCR(qRT-PCR) Mix购自TOYOBO公司,CCK-8检测试剂购自碧云天生物技术有限公司,双荧光素酶检测试剂盒购自Promega公司。
1.2 方法
1.2.1qRT-PCR 按照试剂盒说明书提取组织及细胞总RNA,并逆转录成cDNA。采用SYBR Green qPCR Mix进行qRT-PCR反应,以GAPHD作为ASB16-AS1的内参照,以U6作为miR-185-5p的内参照,采用2-(ΔΔCt)法计算ASB16-AS1及miR-185-5pmRNA的相对表达量。研究所用引物序列见表1。
1.2.2细胞转染 ASB16-AS1的干扰靶点为5′- GGTTCTGAATCATTCAGTT-3′,将此序列打乱后,选择不干扰其他基因表达的序列合成阴性对照干扰序列。将细胞接种于6孔板,待细胞长至80%时,采用Lipofectamine 2000转染试剂进行细胞转染。

表1 qRT-PCR引物序列
转染24 h后采用qRT-PCR验证转染效率。实验设置对照组(不转染)及阴性对照组(转染阴性对照干扰片段)。
1.2.3细胞增殖检测 采用对数生长期的细胞进行实验,将细胞按照5 000个/孔的密度接种于96孔板,每孔加入完全培养液100 μL。分别在细胞转染后的0、24、48、7及96 h时,加入CCK-8试剂10 μL孵育细胞2 h,最后测量各组细胞450 nm处的吸光度值。
1.2.4双荧光素酶实验 分别将含有ASB16-AS1野生型序列和其突变序列的质粒与miR-185-5p mimic或者阴性对照 mimic共转染至293T细胞,采用双荧光素酶检测试剂检测转染24 h时的荧光强度。以荧光素酶的荧光强度为内参,分析各组荧光素酶的活性。
1.3 统计学分析

2 结果
2.1 LncRNA ASB16-AS1 表达
如图1A所示,qRT-PCR检测结果显示,ASB16-AS1在CRC组织中的表达水平显著高于配对癌旁组织,差异具有统计学意义(P<0.01)。在4株CRC细胞(HT-29、SW-480、SW-620及LOVO)中,ASB16-AS1表达水平最高的为HT-29及LOVO细胞(图1B),因此选择这2株细胞进行后续实验。
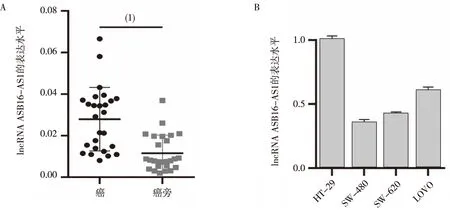
注:A为人CRC,B为CRC细胞;(1)与癌组织比较,P<0.01。
2.2 ASB16-AS1干扰效率
采用ASB16-AS1干扰片段分别转染HT-29和LOVO细胞,结果如图2所示,转染24 h时,与阴性对照组比较,转染ASB16-AS1干扰片段的HT-29和LOVO的细胞中ASB16-AS1表达水平均显著降低(P<0.01),提示该干扰片段能够显著下调HT-29和LOVO细胞中ASB16-AS1的表达水平,可以用于后续实验。
2.3 干扰ASB16-AS1对CRC细胞增殖的影响
转染ASB16-AS1干扰片段后,采用CCK-8法检测对HT-29和LOVO细胞增殖的影响,结果如图3所示,与阴性对照组比较,ASB16-AS1干扰48、72及96 h时,HT-29和LOVO细胞的增殖能力均显著降低,差异有统计学意义(P<0.01),提示下调ASB16-AS1能够显著抑制CRC细胞株HT-29和LOVO的增殖。
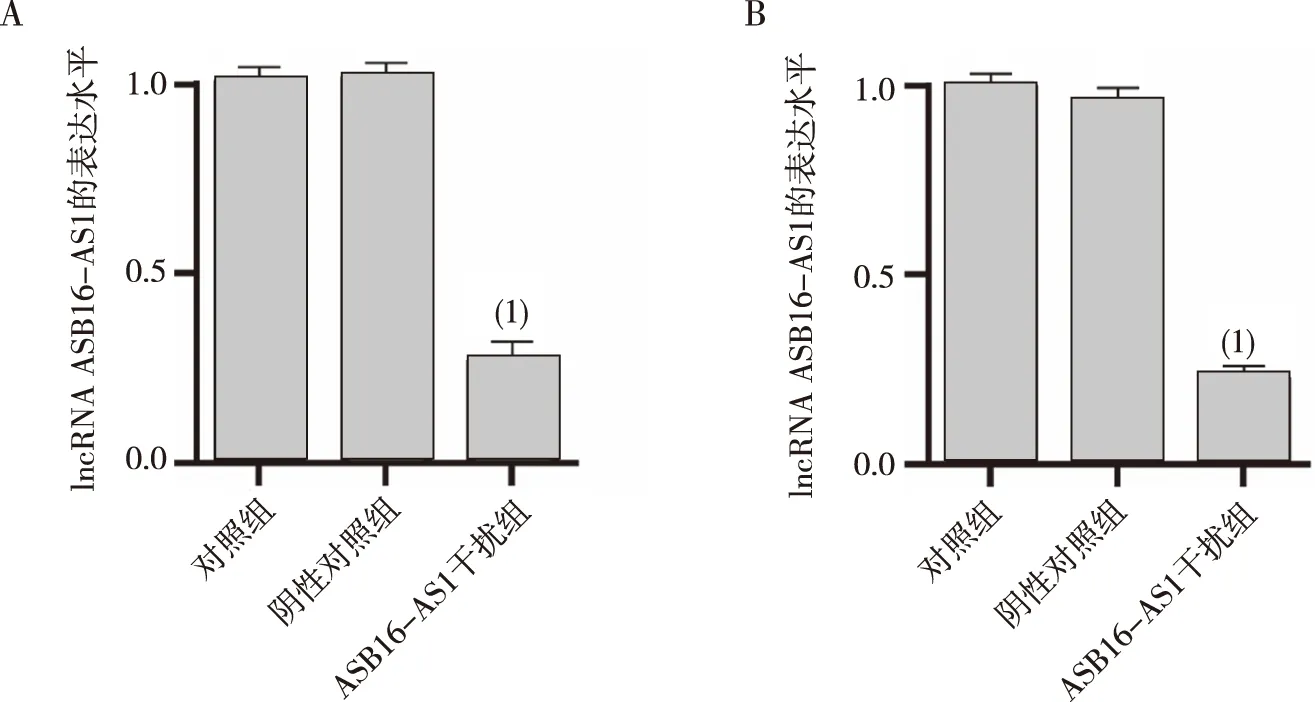
注:A为HT-29细胞,B为LOVO细胞;(1)与阴性对照组比较,P<0.01。

注:A为HT-29细胞,B为LOVO细胞;(1)与同时点阴性对照组比较, P<0.01。
2.4 干扰ASB16-AS1对miR-185-p表达的影响
采用双荧光素酶检测ASB16-AS1与miR-185-p在293T细胞中的结合关系,结果如图4所示,含有野生型ASB16-AS1片段的载体和miR-185-5p mimic共转染的细胞,其荧光素酶的活性显著低于其他各组,差异有统计学意义(P<0.01),提示ASB16-AS1上存在有miR-185-5p的特异性结合序列。本研究还在ASB16-AS1干扰片段转染的HT-29及LOVO细胞中检测了miR-185-5p的表达,结果如图5所示,下调ASB16-AS1后HT-29及LOVO细胞中miR-185-5p的表达水平显著降低,差异有统计学意义(P<0.01),提示ASB16-AS1能够调控miR-185-5p的表达。
3 讨论
研究发现,人类大多数基因组被转录成非编码核糖核酸[8-9]。LncRNA是指长度超过200个碱基的非编码RNA,最近的研究表明lncRNA在各种病理生理过程中都发挥了重要作用[10],其在肿瘤发生发展中的作用尤其受到关注,其中包括CRC[11-12]。CRC从正常上皮细胞发展为恶性肿瘤的过程涉及多种正常生长机制的破坏,包括细胞增殖、分化及凋亡等[13]。异常的细胞增殖被认为是肿瘤细胞的典型特征,因此,抑制癌细胞的增殖成为抗肿瘤研究的关键,也是研究抗CRC的关键。lncRNA对CRC增殖的影响正逐渐受到重视,lncRNA MALAT1[14]、lncRNA RP4[15]、lncRNA SNHG1[16]、lncRNA CRNDE[17]、LncRNA-AK001058[18]等多个lncRNA均被证明在CRC的病理性增殖过程中发挥了重要作用。本研究也证明了lncRNA ASB16-AS1在CRC组织中表达升高,下调ASB16-AS1能够抑制CRC细胞HT-29和LOVO的增殖及miR-185-5p的表达,并且ASB16-AS1上具有miR-185-5p的特异性结合位点。这些结果表明,高表达的ASB16-AS1可能促进了CRC细胞的增殖,ASB16-AS1可作为CRC潜在的预后生物标志物以及治疗靶点。张德龙等[7]在胶质瘤细胞中的研究发现,lncRNA ASB16-AS1显著促进了细胞的增殖、迁移及侵袭。结合本研究结果,推测lncRNA ASB16-AS1可能是一个促肿瘤的lncRNA。

注:A为双荧光素酶结果,B为2种ASB16-AS1与miR-185-5p结合关系;(1)与野生型ASB16-AS1+miR-185-5p mimic组比较,P<0.01。
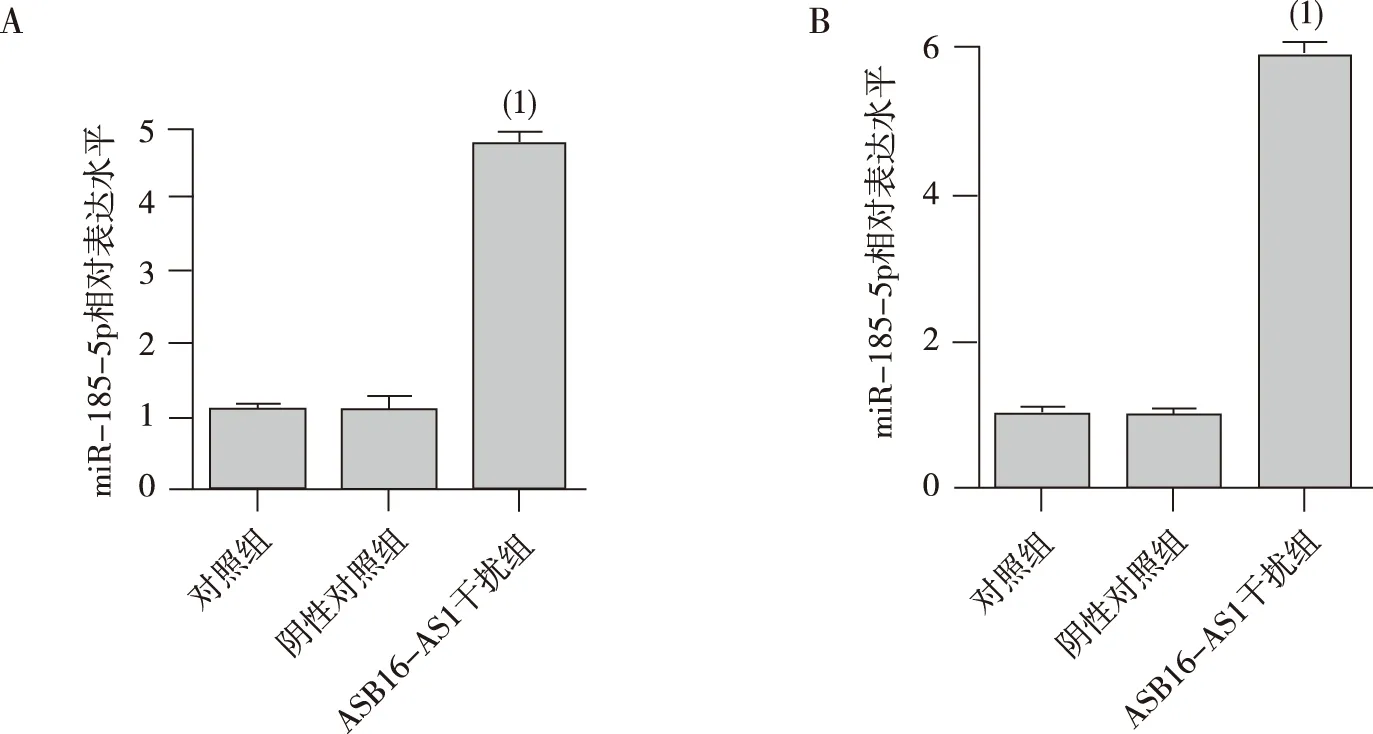
注:A为HT-29细胞,B为LOVO细胞;(1)与阴性对照组比较,P<0.01。
LncRNA的作用机制十分复杂,他们可以与DNA、蛋白、mRNA或者miRNA结合,调控它们的表达[19-20]。更进一步的研究表明lncRNA可以与miRNA的特异性位点结合、竞争性的调节miRNA下游靶基因的表达[21-22]。本研究的结果也显示ASB16-AS1上具有miR-185-5p的结合位点,下调ASB16-AS1后,2株CRC细胞中miR-185-5p的表达显著升高。唐海林等[23]的研究也证实与癌旁组织相比,miR-185-5p在CRC组织中表达显著降低,并且其在淋巴结转移组织中的表达水平低于无淋巴结转移的组织。此外,上调miR-185-5p能够抑制CRC细胞的增殖并且减少myc、cyclinD1等促肿瘤基因的表达[24]。结合本研究结果,提示抑制ASB16-AS1能够释放miR-185-5p进而抑制这些促肿瘤基因的表达,从而发挥抗CRC的作用。
综上,本研究结果表明lncRNA ASB16-AS1在CRC组织中表达升高,下调lncRNA ASB16-AS1可显著抑制CRC细胞的增殖。lncRNA ASB16-AS1上具有miR-185-5p的调控位点,抑制lncRNA ASB16-AS1能够上调miR-185-5p的水平。lncRNA ASB16-AS1可能是治疗CRC的潜在靶点。
