活性氧物质调节因子1和癌胚抗原在恶性胸腔积液中的诊断价值研究*
2019-11-04胡琼英
肖 严 ,肖 玲 ,刘 勇,胡琼英
1.攀枝花市攀钢集团总医院 检验科(攀枝花 617023);2.成都中医药大学附属医院 检验科(成都 610072)
胸腔积液是临床较为常见的问题,病因主要有结核、恶性肿瘤、心衰、感染等,成因复杂,鉴别诊断较为困难[1]。研究[2]报道,出现转移的肿瘤患者随着疾病进展,约50%伴有恶性胸腔积液(malignant pleural effusion, MPE)。合并MPE后,肿瘤患者生活质量明显下降,中位生存时间仅3~12个月[3]。细胞学诊断是确诊MPE的金标准,但其敏感性不高(约40%~70%)[4-5]。近年来兴起的胸腔镜下胸膜活检虽具有较高敏感性,但创伤大、费用高,只适用于部分人群。本研究对48例MPE和26例良性胸腔积液(benign pleural effusion, BPE)中活性氧物质调节因子1(reactive oxygen species modulator 1, Romo1)和癌胚抗原(carcinoembryonic antigen, CEA)的表达水平进行检测、分析,旨在探讨Romo1和CEA在MPE诊断中的应用价值,并评估二者联合对MPE的诊断价值,以期为MPE诊断寻找应用简便、可靠、微创,且敏感性和特异性更高的标志物。
1 资料与方法
1.1 临床资料
收集2016年1月至2018年5月攀钢集团总医院和成都中医药大学附属医院收治的初诊胸腔积液74例患者的标本及临床资料,其中MPE 48例(MPE组),BPE 26例(BPE组)。MPE组纳入标准:经细胞病理学明确诊断为恶性的胸腔积液;BPE组纳入标准:结核和非结核性良性胸腔积液。排除标准:诊断不明确的胸腔积液。MPE组:男22例,女26例;年龄(61.2±7.4)岁;肺腺癌21例,鳞癌13例,小细胞癌7例,乳腺癌胸膜转移5例,结直肠癌2例;MPE组诊断标准为胸腔积液沉淀中查到恶性肿瘤细胞或胸膜活检组织经病理组织学证实为恶性肿瘤。BPE组:男14例,女12例;年龄(59.7±6.2)岁;结核性胸水15例,炎性胸水11例;均由胸部X线、CT、结核感染T细胞斑点实验、胸水细胞学检查等综合确诊。两组患者在性别、年龄方面比较,差异无统计学意义(P>0.05),具有可比性。本研究所有患者或家属均签署知情同意书,并获得医院伦理委员会批准。
1.2 试剂和方法
胸腔穿刺抽液约10 mL,<4 ℃, 3 000 r/min,离心半径13.5 cm,匀速离心10 min,留取上清5 mL装入EP管内,-80 ℃保存检测。Romo1、CEA、酶联免疫吸附测定检测试剂盒分别购于伊莱瑞特生物公司(武汉)和Abcam公司(上海),采用URANUS AE全自动酶联免疫检测仪(深圳),按照厂家说明进行操作。
1.3 统计学方法

2 结果
2.1 Romo1、CEA在MPE和BPE中的表达
Romo1在两组间(MPE vs. BPE)的表达水平分别为(152.4±40.8)vs.(107.2±34.3)ng/mL;CEA为(95.7±36.9)vs.(48.2±28.1)ng/mL,差异均有统计学意义(P<0.001)(表1)。
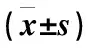
表1 MPE和BPE患者一般资料及Romo1、CEA测量值
2.2 Romo1、CEA联合检测对MPE诊断价值评估
Romo1、CEA联合诊断恶性胸腔积液的敏感度、特异度分别为72.9%、96.2%,AUC为0.916(95%CI:0.853~0.973,P<0.001)。二者联合检测时诊断的敏感性、特异性均优于Romo1、CEA任一单独检测(表2、图1)。
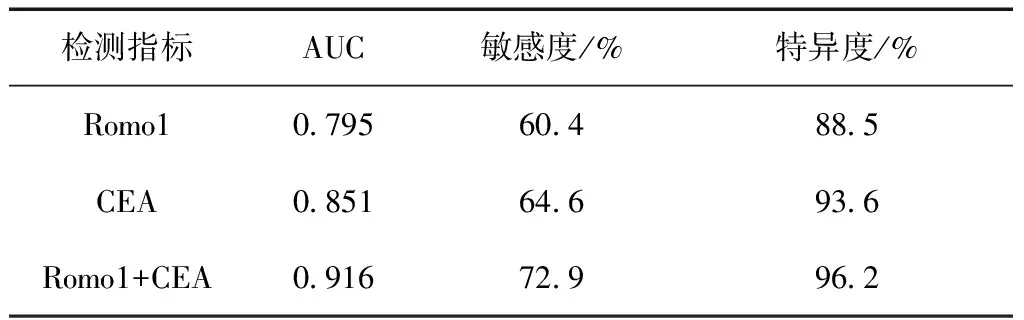
表2 Romo1、CEA单独检测及联合检测对MPE诊断效能评估

图1 Romo1和CEA联合检测对MPE诊断的ROC曲线
2.3 Romo1、CEA单项检测对MPE诊断价值评估
根据Romo1、CEA在胸腔积液中的表达量绘制ROC曲线。结果显示Romo1的最佳诊断界值为141.2 ng/mL,相应敏感度、特异度为60.4%、88.5%,AUC为0.795(95%CI:0.695~0.895,P<0.001);CEA的最佳诊断界值为84.3 ng/mL,相应敏感度、特异度为64.6%、93.6%,AUC为0.851(95%CI:0.766~0.937,P<0.001)(图2)。

图2 Romo1和CEA单独检测对MPE诊断的ROC曲线
3 讨论
MPE是由于肿瘤细胞侵犯胸膜导致,最常见于肺癌[6]。最近一项大宗病例回顾性研究[7]发现,在840例MPE中,肺癌来源最多,占37%;乳腺癌次之,占16%;血液肿瘤10%,来源不明者约10%。MPE临床较为常见且严重影响患者预后,以肺癌为例,约15%的患者初次就诊即合并MPE[8],患者平均生存时间不到1年[9],因此,提高MPE的诊断效率,尽早进行相应治疗,对改善患者症状及预后具有重要的临床意义。
随着医学技术的发展,MPE病因诊察手段已较丰富,但临床实践中各有不足之处:CT、PET/CT等无创性检查应用方便,但检出率不高;影像学引导下穿刺活检或胸腔镜下胸膜活检诊断特异性高,但对患者身体状态及配合要求也更高,无法适用于所有患者;胸腔积液细胞学检查创伤性介于上述二者间,但阳性率有待提高,往往需要结合免疫染色或积液生化分析进一步确诊[5]。
CEA作为临床应用最广泛的肿瘤标志物之一,已有大量文献表明其在MPE中表达量明显高于BPE,一项文献荟萃[10]汇总了2 834例MPE和3 251例BPE,分析显示,CEA诊断的敏感度为54%,特异度为94%。本研究CEA单独应用,诊断的敏感度、特异度为64.6%、93.6%,与上述报道基本一致。本研究将CEA纳入研究的目的,是希望借助于CEA公认的诊断价值,重点考察Romo1在MPE、BPE中的诊断意义及二者联合在MPE诊断中的价值。
活性氧化物质(reactive oxygen species, ROS)在机体酶的活化、信号传导及基因表达等一系列重要生命活动中发挥作用,Romo1是ROS的重要调节因子,二者协同,参与维持正常细胞稳态以及肿瘤细胞的增殖[11]。研究[12]报道,Romo1高表达与肝细胞癌侵袭性相关;在多种肿瘤中均发现,Romo1诱导ROS生成,造成DNA损伤和基因组不稳定,进而引起肿瘤发生和促进肿瘤进展。在肺癌中,Romo1可通过调控ROS水平,使肺癌细胞产生5-氟尿嘧啶等化疗药物抵抗性,与非小细胞肺癌预后不佳有关[11,13]。Romo1可通过细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)通路、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)通路及Myc蛋白来调控正常细胞和肿瘤细胞的增殖[13]。Lee等[14]评估了Romo1在胸水中用于诊断肺癌患者MPE的临床效果,发现肺癌相关恶性积液中Romo1水平显著高于BPE(P<0.001)。胸腔积液Romo1可以区分肺癌和良性疾病,具有较高敏感性和特异性,与其他学者在肺癌相关胸腔积液中的研究结果相似。研究发现Romo1在 MPE和BPE中的表达差异明显,有望作为鉴别MPE和BPE的诊断指标之一。目前,尚未有Romo1、CEA联合应用对MPE诊断价值的文献报道。本研究对此进行了初探,结果发现二者联合应用对MPE诊断的敏感度为72.9%,特异度为96.2%,AUC为0.916,诊断效能较高,均优于Romo1、CEA单独应用时的诊断价值。
综上所述,本研究初步发现Romo1和CEA对MPE诊断均具有重要意义,而二者联合可提供更好的诊断价值。未来将加大样本量进一步验证,为其临床推广应用提供理论基础。
