芍药苷调控酸敏感离子通道发挥镇痛作用*
2019-10-30熊哲谢家璇朱鲲博张雅婷杨荣
熊哲,谢家璇,朱鲲博,张雅婷,杨荣
(江汉大学医学院1.生理教研室;2.2017级临床实验班,武汉 430056)
芍药苷(paeoniflorin,Pae)源于毛茛科植物芍药的根,是芍药的主要有效成分。该药具有扩张血管、解痉镇痛、抗炎等作用,但其作用机制未被完全阐明。研究表明,多个受体和离子通道可能是芍药苷发挥神经保护作用的靶点[1-2]。酸敏感离子通道(acid-sensing ion channels,ASICs)是H+门控的阳离子通道,在外周神经系统,ASICs作为酸感受器参与痛觉产生与调制,也是笔者前期研究工作的主要靶点之一[3-4]。芍药苷是否能通过调控ASICs发挥镇痛作用,笔者尚未见研究报道。笔者在本研究运用行为学和全细胞膜片钳方法观察芍药苷镇痛作用与大鼠三叉神经节(trigeminal ganglion,TG)神经元上ASICs关系,探讨其可能作用机制,以期为芍药苷用于临床疼痛治疗提供实验依据。
1 材料与方法
1.1实验动物 行为学和膜片钳实验均选用健康 SD 雄性大鼠,7~8周龄,体质量180~200 g,由华中科技大学同济医学院实验动物中心提供[动物生产许可证号:医动字第 19-025号;实验动物合格证号:SCXK(鄂)2010-0007号],均自由饮食,饲养室温度(23±2)℃,光暗周期同昼夜周期,相对湿度 (60±5)%。
1.2药品与试剂 芍药苷购自南京替斯艾么中药研究所(淡黄色粉末,相对分子质量480.46,含量>98%,批号:TCM068-100316);腺苷A1受体拮抗剂1,3-二丙基-环戊黄嘌呤(8-cyclopentyl-1,3-dipropylxanthine,DPCPX,批号:9A/70155,Tocris公司 ),ASICs拮抗剂阿米洛利(amiloride,批号:BCBB4202)、三磷酸腺苷镁(MgATP)、4-羟乙基哌嗪乙磺酸(4-[2-hydroxyethyl]-1-piperazineethanesulfonic acid,HEPES) 、 2-吗啉乙磺酸 (2-[N-morpholino] ethanesulfonic acid,MES)均购自Sigma公司;木瓜蛋白酶(Roche公司,批号:201206);DMEM/F-12培养基(Gibco公司,批号:12400-016),其他药品均为国产分析纯。记录 ASICs 电流细胞外液组成成分(mmol·L-1):氯化钠(NaCl) 150,氯化钾(KCl) 5,氯化镁(MgCl2) 2,氯化钙(CaCl2) 2,葡萄糖(glucose)10,HEPES 10,辣椒平(Capsazepine,CPZ) 0.01;分别用10 mmol·L-1MES在pH值6.9~5.9,或者10 mmol·L-1醋酸(acetate)在pH值<5.9范围内替代10 mmol·L-1HEPES调整pH值。
记录ASICs电流的电极内液组成成分(mmol·L-1):KCl 140,HEPES 10, MgCl22,二醇-双-(2-氨基乙基)四乙酸(EGTA) 10,MgATP 2,用氢氧化钾(KOH)调整pH值为7.2~7.4。
1.3仪器与设备 Axon patch 200B型膜片钳放大器,P-97型微电极拉制仪和MP-285型微操纵器(美国Sutter 公司) ,Axiovert 200型倒置显微镜(德国Zeiss公司)。
1.4动物分组、模型制备与给药方法 采用随机数字表法,将大鼠分为5组,每组5只:对照组,模型组,阿米洛利组,芍药苷组,DPCPX+芍药苷组。造模前15 min,分别在上述各组大鼠右侧触须垫中央部位皮下注射0.9%氯化钠溶液(NS)、NS、阿米洛利(30 μg)、NS和DPCPX(10 μg)各50 μL;5 min后分别腹腔注射NS、NS、NS、芍药苷(50 mg·kg-1)和芍药苷(50 mg·kg-1)。芍药苷、阿米洛利和DPCPX于实验前用NS溶解。腹腔注射10 min后开始制作面部炎性疼痛模型,对照组利用微量注射器取NS 50 μL注射到大鼠右侧面部触须垫皮下,其余4组右侧面部皮下注射5% 甲醛50 μL。注射完毕后,立即将大鼠置有机玻璃观察箱 (30 cm×30 cm×30 cm),视频捕捉系统记录大鼠自发痛行为。以大鼠抓搔注射部位时间( s )作为衡量疼痛行为指标,以3 min 为一观察时段,连续记录45 min。
1.5细胞的培养 SD大鼠腹腔注射20%乌拉坦麻醉(1.2 g·kg-1),断头,迅速取出三叉神经节,置于冷无钙Hank’s平衡盐溶液(Hank’s balanced salt solution,HBSS)。HBSS中冲洗2次,剪碎并加入木瓜蛋白酶150 μL、L-半胱氨酸5 mg,HBSS定容至3 mL,37 ℃,5% CO2培养箱消化40~50 min。然后用Pasteur管轻轻吹打使细胞分散,将细胞悬液转入10 mL离心管,用含10%胎牛血清DMEM/F-12培养基定容5 mL,1 000 r·min-1离心3次(r=8 cm),每次5 min。将分离的单个三叉神经节细胞滴到多聚赖氨酸包被的盖玻片,37 ℃,5%CO2培养箱培养过夜。
1.6全细胞膜片钳记录及数据的采集和分析 采用全细胞膜片钳技术,在电压钳模式下记录酸敏感离子通道电流。微电极由微电极拉制器两步拉制而成,使其在充满电极内液后的电阻维持在2~5 MΩ。通过微操纵器控制电极使封接电阻达GΩ 后,轻施负压使细胞破膜,调节相应电容补偿,即可获得全细胞模式。实验过程中,细胞均钳制在-60 mV。信号采集频率10 kHz,滤波频率5 kHz,采样后数据应用Clampfit 8.2进行分析。给药通过快速换液装置的排管进行,管口距所记录的细胞约50 μm。
酸性液体作用的量效曲线用Hill方程拟合:I/Imax=[1+ {(pH)/pH50}n]-1,n为Hill系数,I为特定pH值时记录到的电流幅度。pH50为半数有效pH。药物对ASIC电流的抑制率按照下列公式计算:抑制率(%)=(对照ASIC电流幅值-药物作用时ASIC电流幅值)/对照ASIC电流幅值×100%。
1.7统计学方法 采用Sigmaplot 9.0版软件进行统计学分析,实验结果以均数±标准误表示,t检验,以P<0.05为差异有统计学意义。
2 结果
2.1芍药苷对大鼠TG神经元上ASICs介导的酸诱导电流(Iasic)的调制作用 为研究芍药苷对TG神经元上Iasic影响,在细胞外液中加入10 μmol·L-1TRPV1阻断剂Capsazepine(CPZ),以排除TRPV1介导的酸诱导电流对实验的干扰。选择在中小直径大鼠TG神经元 (15~30 μm)通过全细胞膜片钳技术记录Iasic。实验中大部分受检细胞(82.4%,98/119)对pH 5.9外液敏感,产生一个内向电流,阿米洛利(100 μmol·L-1)可明显抑制酸性外液在TG神经元上诱发的内向电流,提示该内向电流由ASICs介导。该电流主要表现出3种形态:S型(slow type)为缓慢失活的内向电流(59.2%)、F型(fast type)为快速失活的内向电流(8.2%)、B型(biphasic inward current)是双内向电流(32.6%),B型先出现一个快速失活的内向电流,紧跟着出现一持续内向电流(图1)。
单独应用芍药苷未诱导出电流。实验中预加100 μmol·L-1芍药苷5 min 后,再给予酸性外液(pH值5.9),结果发现,芍药苷对3种形态Iasic峰值均有明显抑制作用,100 μmol·L-1芍药苷使S型、F型和B型Iasic峰值分别减少了(36.8±5.1)%(n= 6,P<0.01)、(34.8±4.9)% (n=8,P<0.01) 和(37.4±6.6)% (n=6,P<0.01),提示芍药苷对3种形态Iasic有类似抑制作用(图1)。

芍药苷(100 μmol·L-1)和阿米洛利(100 μmol·L-1)对酸性外液(pH 5.9)诱发的缓慢失活型(A) 、快速失活型(B)和双内向电流(C)抑制作用。
图1 芍药苷和阿米洛利对大鼠TG神经元ASICs电流的抑制作用
Representative slow inactivated current type (A), fast inactivated current type(B) and biphasic inward current type(C) activated by acid extracellular solution (pH 5.9) were inhibited by Pae (100 μmol·L-1) and amiloride (100 μmol·L-1).
Fig.1InhibitionofPaeandamilorideonASICscurrentinTGneuronsofRats
在10~1000 μmol·L-1浓度范围内,随着芍药苷浓度增加,其对Iasic(pH值5.9)抑制率也增加,最大抑制率(60.2±3.2)% (n=7),IC50为78.12 μmol·L-1(图2)。
2.2预加和不预加芍药苷时Iasic量效关系 图3A为100 μmol·L-1芍药苷对不同pH值酸性外液诱发的Iasic的抑制作用。图3B为不含和含有100 μmol·L-1芍药苷时Iasic量效曲线。从图3可见,预加100 μmol·L-1芍药苷 5 min,Iasic量效曲线明显下移,阈值和最大反应pH值不变,预加芍药苷前后两条曲线pH50较接近,分别为6.46和6.38。
2.3芍药苷对Iasic抑制作用机制 联合应用腺苷A1受体特异性拮抗剂DPCPX ( 1 μmol·L-1) 时,DPCPX能部分逆转芍药苷 (100 μmol·L-1) 对Iasic(pH值5.9)的抑制作用(n=7)(图4)。

A.不同浓度芍药苷(10~1000 μmol·L-1)抑制Iasic(pH值5.9)的典型电流图;B.芍药苷对Iasic(pH值5.9)的抑制作用有浓度依赖性。
图2 芍药苷浓度依赖性抑制大鼠TG神经元Iasic
A.Representative current ofIasic(pH 5.9 ) inhibited with different concentration of Pae(10~1000 μmol·L-1); B.concentration-dependent inhibition of Pae onIasic(pH 5.9).
Fig.2Concentration-dependentinhibitionofPaeonIasicinTGneuronsofRats
2.4芍药苷对甲醛诱导的面部炎性自发痛反应的作用 大鼠颌面部皮下注射甲醛 (5%,50 μL)可诱发典型双相(第一相:0~3 min,第二相:12~36 min)自发疼反应,见图5B。阿米洛利(30 μg)可明显减少40%甲醛(福尔马林)诱导的第二相(15~24 min)自发痛反应,在第二相15~18 min时间段,阿米洛利预先处理使大鼠抓脸持续时间由(52.8±4.6)s减少到(33.1±4.2)s(P<0.01),提示ASICs参与甲醛诱发的面部炎性自发痛的产生,见图5A。预先腹腔注射芍药苷 (50 mg·kg-1),能明显抑制甲醛注射后18~27 min内自发痛反应,此外,大鼠面部皮下预先注射DPCPX,可部分翻转芍药苷抗伤害性作用,见图5B。

A.芍药苷(100 μmol·L-1) 抑制不同pH值酸性外液诱导的Iasic;B.预加100 μmol·L-1芍药苷后,Iacid量效曲线明显下移。
图3 芍药苷对Iasic量效曲线的影响
A.Current traces showed that Pae(100 μmol·L-1) inhibitedIasicinduced by different pH acid extracellular solution; B.The Concentration-response curve ofIasicwith Pae(100 μmol·L-1) pretreatment shifted downwards significantly.
Fig.3EffectofPaeonDose-responsecurveofIasic
3 讨论
笔者在本实验中发现,ASICs参与了5%甲醛溶液皮下注射诱发的头面部持续性疼痛反应,芍药苷可减轻该疼痛反应。组织酸化是致痛的原因之一,H+可通过激活外周伤害性感受器上的辣椒素受体(transient receptor potential vanilloid-1,TRPV1)和ASICs产生疼痛[6]。研究报道芍药苷可抑制TRPV1介导的炎症因子释放,从而产生抗伤害性作用[7]。在全细胞膜片钳实验,笔者在细胞外液加入TRPV1特异性阻断剂CPZ,整个实验过程中都能观察到芍药苷对阿米洛利敏感的H+诱导电流的抑制作用,说明TG上的ASICs是芍药苷产生镇痛作用的新分子靶点。
在10~1000 μmol·L-1范围内,随着芍药苷浓度增加,芍药苷对TG神经元上的ASICs电流的抑制率也增加,呈现明显浓度依赖性。如图3所示,芍药苷(100 μmol·L-1)非常有效地抑制了各pH值诱导的ASICs电流,即使是pH 4.9诱导出ASICs电流最大值也被芍药苷抑制,提示芍药苷可能通过非竞争性机制抑制ASICs。非竞争性作用方式存在两种可能性:一种是芍药苷可通过跨膜信号转导途径来抑制ASICs;另一种是芍药苷直接结合到ASICs,然后通过变构调节作用,进而抑制ASICs电流。比较预加和不预加芍药苷时ASICs电流的量效曲线有以下特点:①预加芍药苷后浓度反应曲线明显下移;②两种情况下pH50值非常接近,分别为(6.31 ± 0.13)和(6.21 ± 0.15);③预加芍药苷后最大反应浓度时ASICs电流幅值减小(54.89±4.94)%。结果表明,两种情况下ASICs对H+亲和力基本不变,提示芍药苷可能通过受体介导的跨膜信号转导途径来抑制ASICs,而不是通过变构调节来发挥作用。
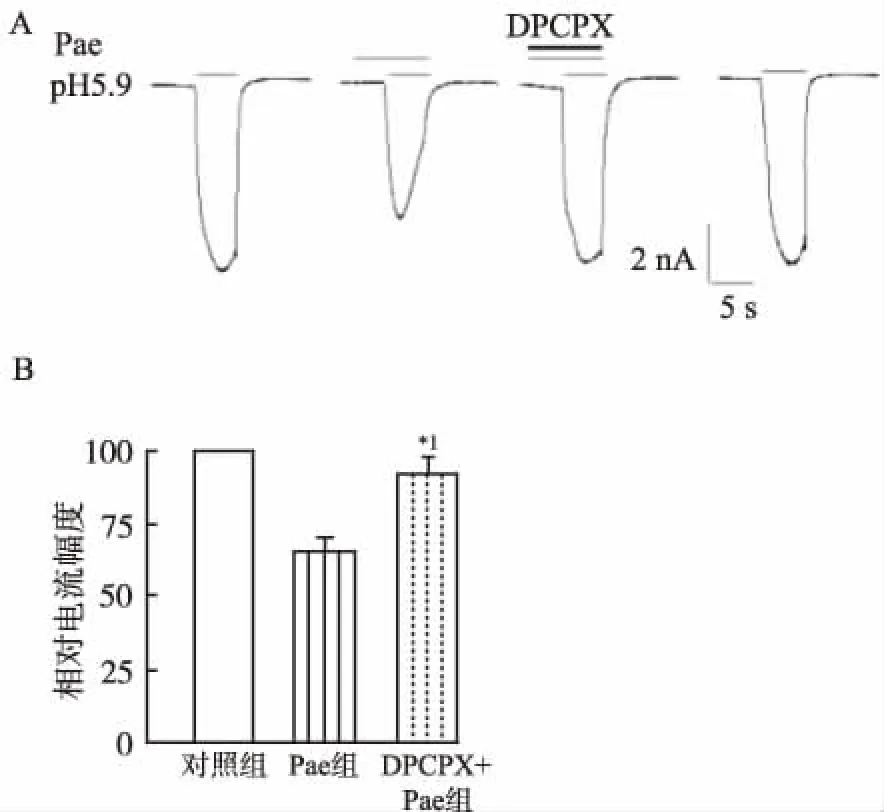
A.腺苷A1受体拮抗剂DPCPX阻断了芍药苷抑制Iacid(pH=5.9)的典型电流图;B.联合应用DPCPX(1 μmol·L-1)阻断了芍药苷(100 μmol·L-1)对Iacid(pH=5.9)抑制作用;与芍药苷组比较,*1P<0.01。
图4 芍药苷抑制Iasic与腺苷A1受体关系
A.Adenosine A1 antagonist (DPCPX) abrogated the inhibition of Pae onIasic(pH=5.9) ; B.DPCPX combination abrogated the inhibition of Pae(100 μmol·L-1) onIasic(pH=5.9);*1P<0.01 versus Pae.
Fig.4RelationshipoftheinhibitionofPaeonIasicandadenosineA1antagonist
ASICs拮抗剂对口面部炎性疼痛有镇痛作用,提示ASICs 参与口面部炎性疼痛信息的产生和(或)传导。研究报道芍药苷可激活腺苷A1受体来产生神经保护作用[8-10]。腺苷A1受体在神经系统分布广泛,在三叉神经节中也存在大量A1受体[11-12]。本实验中,面部皮下注射A1受体拮抗剂DPCPX可部分阻断芍药苷镇痛效应,提示外周A1受体参与了芍药苷镇痛作用。此外,笔者还发现DPCPX可部分阻断芍药苷对ASICs电流抑制作用,表明TG神经元上A1受体是芍药苷发挥镇痛作用的靶点之一。

A.阿米洛利对Formalin诱发疼痛反应的抑制作用;B.Pae的面部镇痛作用;与模型对照组比较,*1P<0.01,*4P<0.05;与对照组比较,*2P<0.01,*3P<0.05;与芍药苷组比较,*5P<0.05。
图5 芍药苷抗伤害性作用与腺苷A1受体关系
A.amiloride attenuated formalin-induced pain response;B.analgesic effect of Pae on face;Compared with model group,*1P<0.01,*4P<0.05;Compared with control group,*2P<0.01,*3P<0.05;Compared with Pae group,*5P<0.05.
Fig.5Relationshipofanti-nociceptiveresponseofPaeandadenosineA1antagonist
综上所述,芍药苷对口面部外周炎性痛的镇痛效应与其作用于A1受体进而下调TG神经元上ASICs的敏感性有关。本研究结果对阐明芍药苷的镇痛作用机制提供了一定的理论和实验依据。
