细胞内Ca2+对可释放囊泡库的影响
2019-10-11阳小飞荣伊周仲燕
阳小飞,荣伊,周仲燕
(中南民族大学 生物医学工程学院,脑认知国家民委重点实验室,医学信息分析及肿瘤诊疗湖北省重点实验室,膜离子通道与药物研发实验室,武汉430074 )
在神经网络中,神经元细胞间的信号传递需要囊泡释放包裹的神经递质,单个囊泡释放出的神经递质与突触后膜上的受体结合,引起电流的变化,即微小型兴奋性突触后电流(mEPSC)或微小型抑制性突触后电流(mIPSC)[1,2].神经元细胞中可释放囊泡库(RRP)[3]的大小影响囊泡的自发性释放.Ca2+在囊泡释放中发挥重要作用.当囊泡靠近突触前膜时,随着Ca2+的通透性增加,细胞外的Ca2+内流,推动囊泡与突触前膜的融合、释放,引起突触后的电位变化[4-6].在正常情况下,当细胞内Ca2+浓度过高时,激活某些蛋白酶、磷脂酶及内源性核酸酶等,导致细胞凋亡[7];但当神经元细胞内Ca2+浓度过低甚至无Ca2+存在时,对细胞会造成什么样的影响,目前尚无定论.
BAPTA-AM是一种乙酰甲酯衍生物,细胞膜对其通透性较强,当它进入细胞内,在酯酶的作用下分解出BAPTA,后者是一种高效Ca2+络合剂,它亲和力强,能快速与细胞内游离的Ca2+结合,在细胞内营造出无Ca2+的状态[8,9].运用此方法,可有效地去除细胞内Ca2+.本文通过全细胞膜片钳记录的方法,探讨去除细胞外Ca2+及同时去除细胞内外Ca2+,对大脑皮层神经元自发性囊泡释放的影响及原理,为研究中枢神经系统的囊泡分泌提供参考.
1 材料与方法
1.1 材料和仪器
胎牛血清、MEM培养基、0.25%胰蛋白酶、转铁蛋白、B-27 supplement(Gibco);BAPTA-AM、胰岛素、葡萄糖、HEPES 、阿糖胞苷、EGTA、多聚赖氨酸(Sigma);二甲苯、丙酮、无水乙醇等(国药集团化学试剂);印防己毒素,Tocris 1128,1 g;河豚毒素,Affix Scientific 4368-28-9,1 mg;CNQX,Tocris 1045,10 mg.
倒置显微镜(Olympus);全套自动膜片钳放大器(HEKA);P-97微电极拉制仪(普升科技);CO2恒温细胞培养箱(Thermo);超净工作台产(苏州Air Tech);高压灭菌锅(上海博讯).
1.2 实验溶液配制
按照文献[10,11],配制神经元解剖液、神经元培养基、电生理正常细胞外液、0 Ca细胞外液、电生理细胞内液、10 mmol/L BAPTA-AM 母液(溶于DMSO).
1.3 原代鼠脑皮层神经细胞的获取
取出生<24 h的新生KM小鼠,无菌环境下断头取脑,分离出大脑皮层,用0.25%的胰蛋白酶在37 ℃恒温环境中消化12 min,用神经元培养基离散细胞后,滴种在用多聚赖氨酸处理过的玻片上,放入细胞培养箱,分别在第1,4,9 d换液.
1.4 电生理记录
将获取的大脑皮层神经细胞体外培养13,14 d后,对细胞进行电生理记录.采用全细胞膜片钳技术,在-70 mV的钳制电压下记录电流.记录mEPSC时,在细胞外液中加入100 μmol/L的GABA受体阻断剂PTX 和1 μmol/L的Na通道阻断剂TTX;记录mIPSC时,在细胞外液中加入10 μmol/L的AMPA受体阻断剂CNQX和1 μmol/L的Na通道阻断剂TTX[12,13].
1.5 数据处理
用Pclamp 10记录并导出数据后,再用Igor Pro Folder,GraphPad Prism进行处理分析.3次独立实验之后进行数据分析,用t检验进行差异分析,*表示显著性差异.
2 结果
2.1 细胞外Ca2+和细胞内Ca2+对大脑皮层神经细胞囊泡释放的影响
为研究神经元细胞外Ca2+和细胞内Ca2+对神经递质释放的影响,对体外培养成熟的神经元细胞进行电生理记录.实验分为3组,取大脑皮层细胞在正常外液、0 Ca外液、加入10 μmol/L BAPTA-AM的0 Ca外液中孵育30 min后,分别在上述3种外液中记录mEPSC,结果见图1.
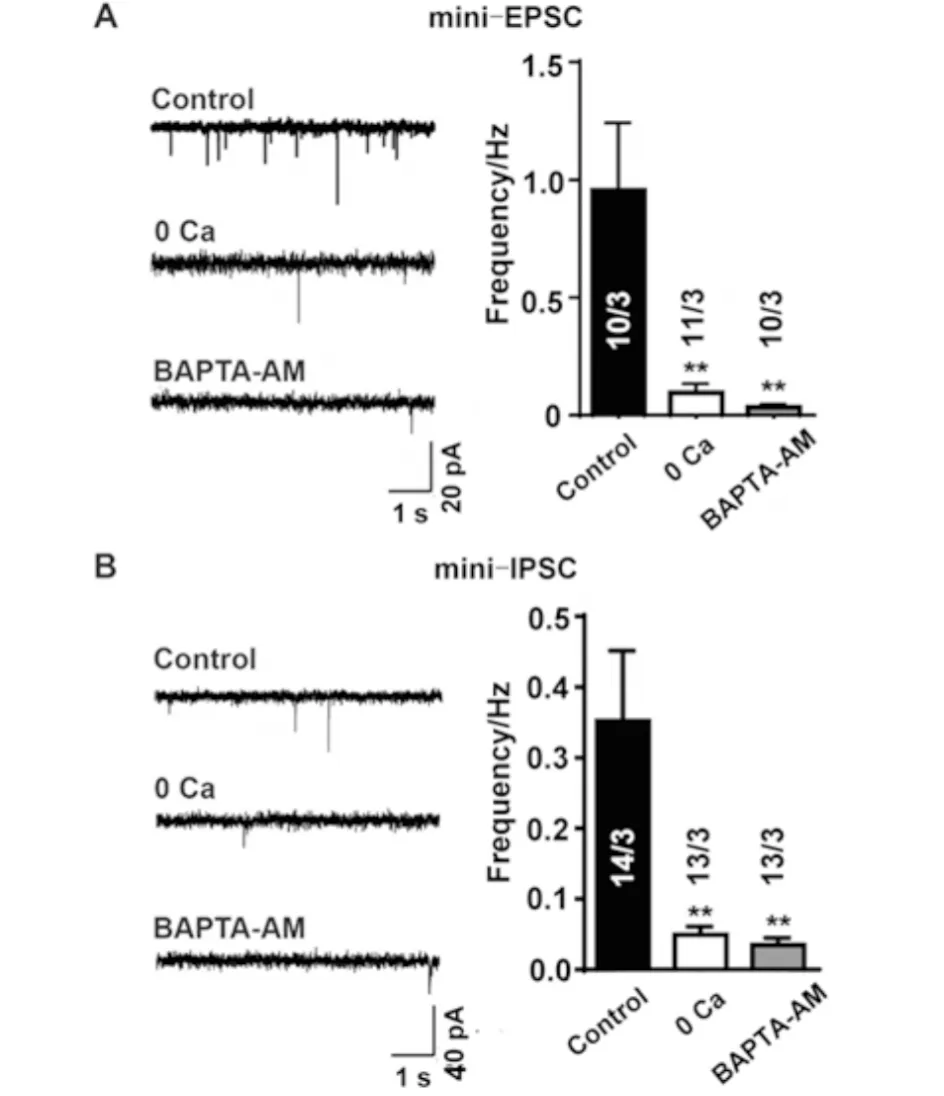
A)在正常外液、0 Ca外液、加入10 μmol/L BAPTA-AM的0 Ca外液中孵育30 min后分别在正常外液、0 Ca外液、0 Ca外液中记录mEPSC;B)在正常外液、0 Ca外液、加入10 μmol/L BAPTA-AM的0 Ca外液中孵育30 min后分别在正常外液、0 Ca外液、0 Ca外液中记录mIPSC.**P<0.01 vs.
当外液中无Ca2+时,mEPSC频率降低;当外液中的Ca2+和细胞内的Ca2+同时不存在时,mEPSC频率进一步降低(见图1A);同样的方法记录mIPSC时,发现在0 Ca外液中mIPSC的频率降低,进一步络合细胞内Ca2+后,mEPSC的频率稍微降低(见图1B).结果表明:去除细胞外Ca2+对神经细胞的囊泡释放有抑制作用(P<0.01),同时去除细胞外Ca2+和细胞内Ca2+,对囊泡释放也有抑制作用.
2.2 细胞外Ca2+对大脑皮层神经细胞内可释放囊泡库的影响
取体外培养13 d的大脑皮层神经元细胞分别在加入TTX和PTX的正常外液和0 Ca外液中记录兴奋性突触可释放囊泡库大小,即在记录过程中给予所记录细胞30 s的0.5 mol/L 蔗糖溶液的刺激,在高渗溶液下,通过物理刺激将细胞中的囊泡都释放出来,引起电流变化,记录细胞的可释放囊泡库[14],结果见图2.
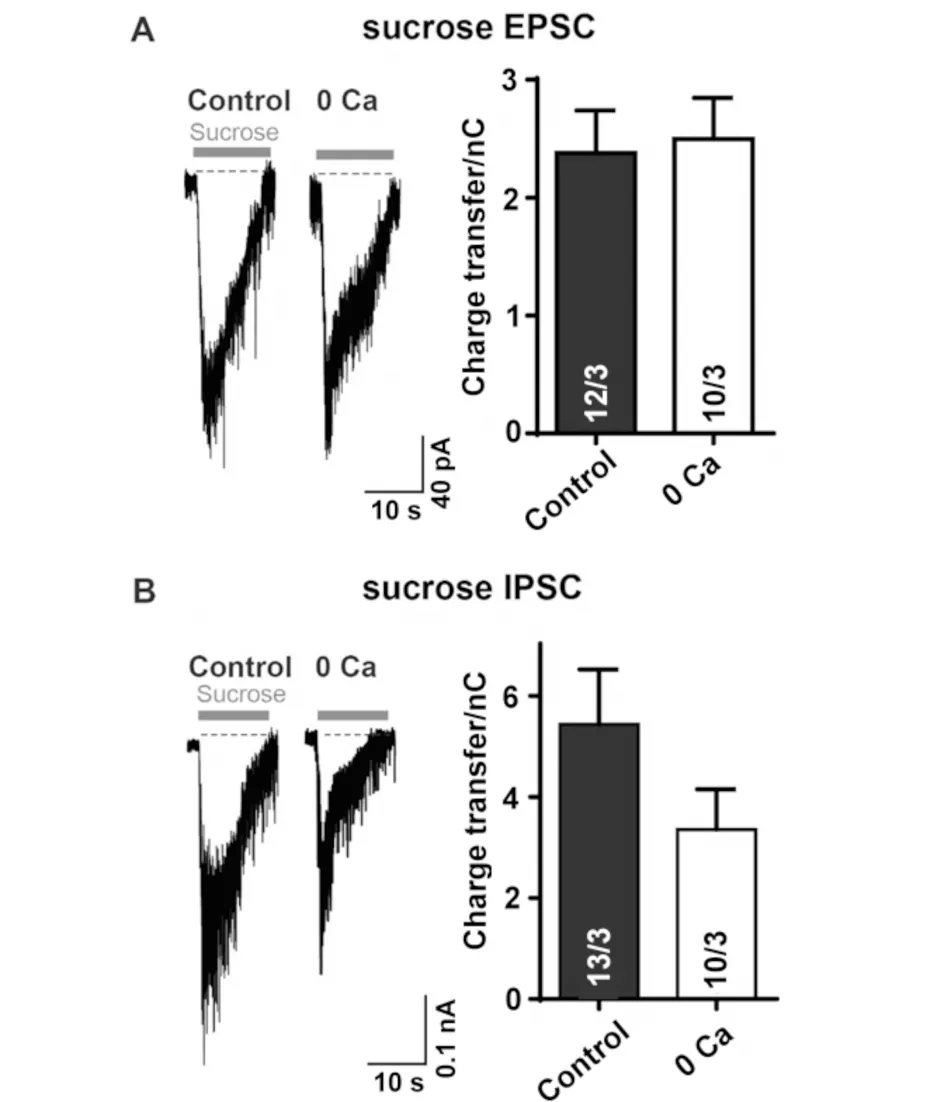
A)正常外液、0 Ca外液中兴奋性突触可释放囊泡库大小;B)正常外液、0 Ca外液中抑制性突触可释放囊泡库大小.
在正常外液中和0 Ca外液中的可释放囊泡库无显著性差异(见图2A);同等条件下,在加入TTX和CNQX的正常外液中和0 Ca外液中记录抑制性突触可释放囊泡库大小,同样无显著性差异(见图2B).因此,认为细胞外Ca2+对大脑皮层神经细胞内可释放囊泡库无影响.
2.3 细胞内Ca2+对大脑皮层神经元细胞内可释放囊泡库的影响
正常外液中加入DMSO,在0 Ca外液中加入10 μmol/L的BAPTA-AM,将体外培养成熟的大脑皮层神经元分别置于两组外液中孵育30 min,再分别在加入TTX和PTX的正常外液和0 Ca外液中记录细胞的兴奋性突触可释放囊泡库大小,结果见图3.加入BAPTA-AM络合细胞内Ca2+后,细胞内可释放囊泡库显著降低(P<0.01,见图3A);相同条件下,改变两组外液中的阻断剂,加入TTX和CNQX,记录抑制性突触可释放囊泡库大小,发现在去除细胞内Ca2+之后的神经元内,可释放囊泡库较正常神经元的可释放囊泡库显著减小(P<0.001,见图3B).
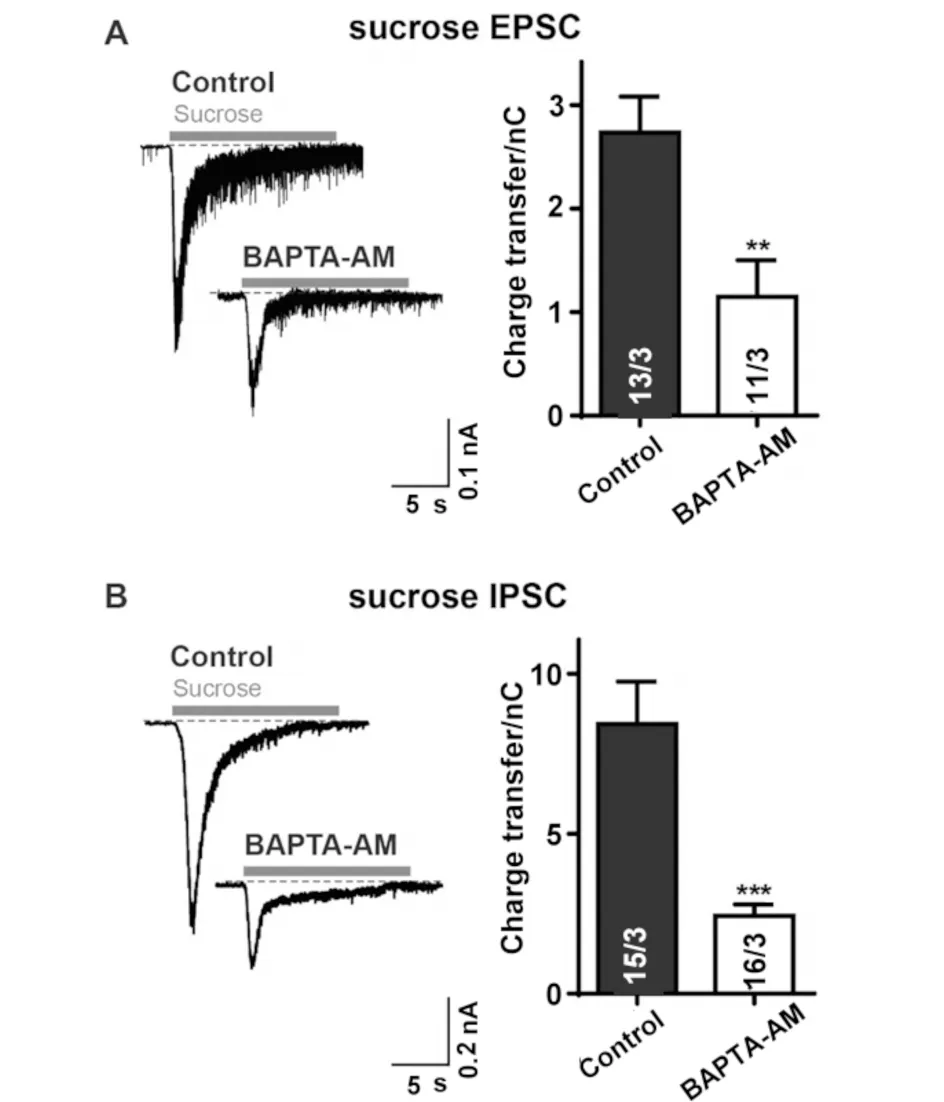
A)分别在正常外液、加入10 μmol/L BAPTA-AM的0 Ca外液中孵育30 min后,在正常外液、0 Ca外液中记录兴奋性突触可释放囊泡库大小;B)分别在正常外液、加入10 μmol/L BAPTA-AM的0 Ca外液中孵育30 min后,在正常外液、0 Ca外液中记录抑制性突触可释放囊泡库大小.**P<0.01 vs.control ,***P<0.001 vs
因此,无论兴奋性还是抑制性突触,去除细胞内Ca2+,均能引起细胞内可释放囊泡库的减小,引起自发性囊泡释放的减少,即mEPSC和mIPSC频率的降低.故认为当同时去除细胞外Ca2+和细胞内Ca2+后,抑制自发性囊泡释放的原因是缺乏Ca2+引起囊泡膜与细胞膜融合和可释放囊泡库减小的综合结果.
3 讨论
在神经元囊泡释放的过程中,突触前膜对Ca2+的通透性增强,Ca2+内流,细胞内Ca2+浓度越高,对囊泡与突触前膜的融合作用越强,因此囊泡释放的频率越高.本实验中,当细胞外Ca2+浓度为0时,其囊泡释放的频率较正常细胞外Ca2+浓度下显著降低,而两种状况下的细胞内可释放囊泡库无显著变化.说明细胞外Ca2+仅仅参与囊泡释放的过程,对于囊泡释放前的反应并无太大的影响,频率降低的原因是当细胞外液无Ca2+时,细胞本身的游离内Ca2+浓度达不到促进囊泡释放的浓度,导致囊泡释放频率降低.
去除细胞外Ca2+并同时用BAPTA-AM络合细胞内Ca2+时,囊泡释放的频率较仅去除细胞外Ca2+时的频率进一步降低,本实验结果显示:去除细胞内Ca2+后,细胞内可释放囊泡库显著减小,因此囊泡释放频率的降低,除了无细胞Ca2+促进囊泡释放这一过程外,也受到可释放囊泡库减小这一因素的影响.
囊泡在成熟之前要经过不同的阶段,在神经元细胞里存在着发育到不同阶段的囊泡,而可释放囊泡库是由感应到细胞内Ca2+浓度变高时,就能迅速与突触前膜融合并释放出神经递质的囊泡组成.
当去除细胞内Ca2+,引起细胞内可释放囊泡库的减小,原因是细胞内Ca2+在囊泡产生及发育的过程中起重要作用,当细胞内Ca2+为0时,囊泡形成的某一阶段受影响,导致生成的囊泡数量减少.此外,还可能是细胞内Ca2+不会影响囊泡的形成,但在维持可释放囊泡库的过程中起至关重要的作用[15-17],因此,当细胞内Ca2+为0时,可释放囊泡库里的囊泡不能正常储存,造成囊泡的流失,使可释放囊泡库减小;但细胞内Ca2+对神经元细胞的可释放囊泡库的减小的具体影响有待深入研究.
