响应面法优化褶牡蛎多糖多肽联产工艺
2019-10-29杨大俏王锦旭李来好杨贤庆马海霞岑剑伟王悦齐
杨大俏,王锦旭,李来好*,杨贤庆,马海霞,岑剑伟,王悦齐
(1.中国水产科学研究院南海水产研究所,农业农村部水产品加工重点实验室,广东 广州 510300;2.上海海洋大学食品学院,上海 201306;3.韩山师范学院食品工程与生物科技学院,广东 潮州 521041)
牡蛎俗称蚝或海蛎子,具有很高的药用价值[1-2],富含锌、铁、钙等元素,素有“海洋牛奶”之称[3]。褶牡蛎(Alectryonella plicatulaGmelin)分布于中国南部海域,是一种高蛋白高碳水化合物的重要经济贝类,经研究发现褶牡蛎具有较强的体外抗氧化活性及体内抗疲劳特性[3],但是目前中国对牡蛎产品除直接食用外,大多通过简单加工直接进入食品市场,产品附加值不高[4],牡蛎产业发展受到制约。相关研究报道显示牡蛎多糖[5]具有抗肿瘤、降糖、增强免疫力等功能[6];天然海洋活性多肽具有较高的稳定性[7-8],但是海洋鱼虾贝类中的生物活性肽的研究尚处于实验室阶段[9-12]。国内外对牡蛎的研究主要集中于多肽的活性和序列分析,少量研究针对于牡蛎多糖的提取工艺和结构研究[13-14],而关于联产制备牡蛎多糖多肽的研究较少。本研究旨在得到同时提取褶牡蛎中功能多糖和活性多肽的工艺,达到褶牡蛎多糖和多肽联产制备[15-16],以提高褶牡蛎利用率。
本实验以褶牡蛎全脏器为原料,采用单因素试验研究胰蛋白酶添加量、酶解时间及料液比对多糖多肽联产制备的影响,在此基础上进一步通过响应面法[17-19]分析各因素及其交互作用对多肽质量分数、总糖质量分数、水解度及酸性糖质量分数[20-21]的影响,并最终得到最优多糖多肽联产工艺条件,以期为连续膜分离联产制备褶牡蛎多糖及多肽的中试化放大生产提供基础。
1 材料与方法
1.1 材料与试剂
褶牡蛎全脏器(于-20 ℃冷冻保藏备用)来源于广东省潮州市。
碱性蛋白酶(210 AU/mg)、木瓜蛋白酶(≥800 U/mg)、胰蛋白酶(≥250 U/mg)、菠萝蛋白酶(≥500 U/mg)、胃蛋白酶(≥10 000 NFU/mg)、中性蛋白酶(≥100 U/mg)广州齐云生物技术有限公司;甘氨酸、氯化钠、氢氧化钠、无水乙醇、三氯乙酸、苯酚、无水硫酸铜、甲醛、盐酸、浓硫酸(均为分析纯) 广州佳研生物科技有限公司;硫酸软骨素、葡萄糖、Gly-Gly-Tyr-Arg(标准品)、1,9-二甲基亚甲基蓝 美国Sigma公司。
1.2 仪器与设备
JS30-230搅拌机 苏泊尔股份有限公司;T50均质机德国IKA公司;Sunrise-basic吸光酶标仪 瑞士Tecan公司;ZDJ-4A雷磁自动电位滴定仪 上海仪电科学仪器股份有限公司;三联高压平板膜设备 厦门福美科技有限公司。
1.3 方法
1.3.1 联产提取工艺
褶牡蛎全脏器→匀浆→均质10 min→热水浸提→调pH 8.0→酶解→煮沸灭酶→离心→上清液调pH 7.0→0.22 μm滤膜除杂→200 kDa膜分离→收集滤过液与截留液→滤过液经8 kDa膜分离[22]→收集8 kDa以下滤过液(粗多肽)、8 kDa以上截留液(粗多糖)→冻干得粗多肽、粗多糖。
操作要点:热水浸提:将牡蛎匀浆与水混匀后在55 ℃水浴0.5 h;离心:将经过煮沸灭酶后的牡蛎酶解液9 000 r/min离心10 min;0.22 μm微滤条件:操作压力0.12 MPa,操作温度10 ℃;8 kDa膜分离超滤条件:操作压力1.05 MPa,操作温度10 ℃;200 kDa膜分离超滤条件:操作压力0.5 MPa,操作温度10 ℃;冻干:旋转蒸发温度55 ℃。
1.3.2 蛋白酶种类选择
以褶牡蛎全脏器为原料,匀浆均质、热水浸提后分别按照质量分数0.2%添加碱性蛋白酶、木瓜蛋白酶、胰蛋白酶、菠萝蛋白酶、胃蛋白酶及中性蛋白酶6 种酶,分别在6 种酶的最适条件下(pH 8.0、6.0、8.0、7.0、4.0、7.0,温度55 ℃)单酶酶解80 min,酶解液9 000 r/min离心10 min,取上清液测定多肽质量分数及水解度,酶解液上清液pH值调至中性,加入无水乙醇至终体积分数为65%,4 ℃醇沉24 h,过滤取沉淀,丙酮洗涤3 次,干燥后配制成溶液检测酸性糖及总糖质量分数。以酶解液中多肽、总糖及酸性糖质量分数的极大值为指标,判定最佳酶种类(水解度作参考指标)。
1.3.3 褶牡蛎肉多糖多肽联产工艺的单因素试验
1.3.3.1 酶添加量对褶牡蛎肉多糖多肽联产工艺的影响
取50.0 g褶牡蛎全脏器匀浆均质后,加入150 mL去离子水,于55 ℃热水浸提0.5 h,调节pH 8.0,分别加入质量分数0.1%、0.2%、0.3%、0.4%及0.5%的胰蛋白酶,在55 ℃酶解80 min。酶解后煮沸灭酶,离心取适量上清液测量水解度以及多肽质量分数,调节pH 7.0,加入无水乙醇至终体积分数为65%,4 ℃醇沉24 h,过滤取沉淀,丙酮洗涤3 次,干燥后配制成溶液检测酸性糖质量分数以及总糖质量分数。以酶解液中多肽、总糖及酸性糖质量分数的极大值为指标,判定最佳酶添加量(水解度作参考指标)。
1.3.3.2 酶解时间对褶牡蛎肉多糖多肽联产工艺的影响
在胰蛋白酶添加量0.2%、料液比1∶3(g/mL)的情况下,分别酶解20、40、60、80 min及100 min。以酶解液中多肽、总糖及酸性糖质量分数的极大值为指标,判定最佳酶解时间(水解度作参考指标)。
1.3.3.3 料液比对褶牡蛎肉多糖多肽联产工艺的影响
在酶解时间80 min、胰蛋白酶添加量0.2%条件下,分别按照1∶1、1∶2、1∶3、1∶4、1∶5(g/mL)的料液比添加去离子水。以酶解液中多肽、总糖及酸性糖质量分数的极大值为指标,判定最佳料液比(水解度作参考指标)。
1.3.4 响应面法优化褶牡蛎肉多糖多肽联产工艺
通过单因素试验[23]确定选取酶添加量、酶解时间、料液比3 个因素进行编码[14],以多肽、酸性糖和总糖质量分数作为响应值,试验因素与水平设计见表1。

表1 响应面试验设计因素与水平Table 1 Factors and levels of response surface experiment
1.3.5 指标测定
多肽质量分数的测定采用三氯乙酸沉淀法[24];总糖质量分数的测定采用苯酚-硫酸法[25];水解度的测定依照甲醛滴定法[26-27];酸性糖质量分数的测定采用1,9-二甲基亚甲基蓝法[28]。
1.3.6 水解度及含量计算公式

式中:C1为滴定氢氧化钠浓度/(mol/L);V1为1 mL酶解液消耗氢氧化钠体积/L;V0为所得酶解液总体积/mL;M为—NH2摩尔质量/(g/mol);M0为所用褶牡蛎全脏器质量/g;C0为褶牡蛎全脏器蛋白质质量分数/%。

式中:C为褶牡蛎酶解液中多肽质量浓度/(mg/mL);V为所得褶牡蛎酶解液上清液的体积/mL;M为所用褶牡蛎全脏器的质量/mg。

式中:C为褶牡蛎酶解液中酸性糖质量浓度/(mg/mL);V为所得褶牡蛎酶解液上清液的体积/mL;M为所用褶牡蛎全脏器的质量/mg。

式中:C为褶牡蛎酶解液中葡萄糖的质量浓度/(mg/mL);D为褶牡蛎酶解液上清液的稀释倍数;V为所得褶牡蛎酶解液上清液的体积/mL;M为所用褶牡蛎全脏器的质量/mg。
1.3.7 多糖、多肽得率计算公式

式中:M1为多糖、多肽冻干品质量/g;M2为500 g褶牡蛎全脏器匀浆干质量/g。
1.4 数据分析
以上实验均经过3 次重复操作,采用IBM SPSS Statistics 20.0对数据进行统计分析,数值采用的形式表现,运用单因素方差分析(ANOVA)检测平均值显著性。
2 结果与分析
2.1 酶种类及添加量选择

图1 6 种酶对褶牡蛎匀浆各指标的影响Fig. 1 Comparison of hydrolysis efficiencies of A. plicatula with six proteases
由图1可知,经过胰蛋白酶水解的褶牡蛎酶解液中水解度、多肽、总糖及酸性糖质量分数最高,故选择胰蛋白酶酶解褶牡蛎匀浆,以期同时得到所需多糖多肽。
2.2 单因素试验结果
2.2.1 酶添加量对褶牡蛎多糖多肽联产的影响
如图2所示,水解度随酶添加量的增多逐渐升高,酶添加量0.2%以上数值间存在显著性差异(P<0.05);多肽、总糖及酸性糖质量分数随酶添加量的增加均呈现先增加后下降的趋势,并在胰蛋白酶添加量为0.2%时达到最大值(P<0.05),故最佳酶添加量为0.2%。

图2 胰蛋白酶添加量对褶牡蛎多糖多肽联产的影响Fig. 2 Effects of trypsase addition amount on production of polysaccharides and polypeptides from A. plicatula
2.2.2 酶解时间对褶牡蛎多糖多肽联产的影响


图3 胰蛋白酶酶解时间对褶牡蛎多糖多肽联产的影响Fig. 3 Effects of hydrolysis time on production of polysaccharides and polypeptides from A. plicatula
如图3所示,水解度随酶解时间的延长逐渐升高,各数值间存在显著性差异(P<0.05);多肽、总糖及酸性糖质量分数随酶解时间延长而先增大后减小,并在酶解时间为80 min时达到最大值(P<0.05),故胰蛋白酶最佳酶解时间为80 min。
2.2.3 料液比对褶牡蛎多糖多肽联产的影响


图4 料液比对褶牡蛎多糖多肽联产的影响Fig. 4 Effects of solid-to-water ratio on production of polysaccharides and polypeptides from A. plicatula
如图4所示,随溶剂用量增大,水解度逐渐减小;多肽、总糖及酸性糖质量分数随溶剂用量的增大呈现先增加后减小,并在料液比1∶3时达到最大值(P<0.05),故选择最佳料液比为1∶3(g/mL)。
2.3 响应面试验结果

表2 响应面试验设计与结果Table 2 Experimental design and results for response surface analysis
由图2~4可知,在不同酶添加量、酶解时间及料液比下,褶牡蛎酶解液的多肽、总糖及酸性糖质量分数均呈先增高后降低趋势,且水解度达到12%左右,可以同时得到较高含量的多肽、总糖及酸性糖,故而在单因素试验的基础上,根据Box-Behnken设计原理,选取酶添加量(A)、酶解时间(B)、料液比(C)作为3因素,并以具有显著性差异的多肽质量分数(Y1)、总糖质量分数(Y2)、水解度(Y3)、酸性糖质量分数(Y4)作为响应值,试验方案及结果见表2。
运用Design-Expert 8.0.5.0软件对实验结果进行回归拟合,得到的回归方程如下:

为检验上述方程的有效性,运用Design-Expert 8.0.5.0软件对上述结果进行数据分析,可信度分析见表3,方差分析结果见表4。4 种响应值的可信度分析的模型相关系数R2分别为0.98、0.99、0.97、0.78,前3 种响应值的模型相关系数都接近于1,表示Y1、Y2、Y3模型相关度很好;变异系数分别为1.63%、1.46%、1.44%、10.03%,数值越小表明置信度越好,说明该数学模型的对Y1、Y2、Y3的置信度极高,对响应值Y4的置信度较高,该模型可以较好地反映试验的真实值[29]。由表4可知,对于多肽质量分数、总糖质量分数、水解度和酸性糖质量分数4 个响应值,该模型的F值分别为70.52、149.70、52.51、7.34,P值均小于0.01,可以判断该模型是极显著的;同时4 个响应值的模型失拟项P值均大于0.05,说明模型失拟项不显著。综上所述,该回归模型对4 个响应值的拟合程度较好,试验误差小。

表3 模型的可信度分析Table 3 Reliability analysis of models

表4 回归方程的方差分析Table 4 Analysis of variance (ANOVA) of regression equations

续表4
利用此模型可拟合出对4 个响应值相应的响应面分析图,其三维图形是响应值对试验因素(单因素变量)所构成的三维空间曲面图,当因素交互作用时,三维曲面图可直观看出响应值的变化趋势[30]。二维等高线图则进一步总结出各个变量间的交互作用并确定最优点。图5a中,随着酶添加量和酶解时间水平的增加,多肽质量分数呈现先增加后降低的趋势,且其二维等高线图偏圆形,判断两个因素之间的交互作用不显著;图5b中,随着酶添加量和料液比水平的增加,多肽质量分数呈现先增加后降低的趋势,等高线图偏圆形,说明两因素之间交互作用不显著;图5c中,随着酶解时间和料液比水平的增加,多肽质量分数先增加后降低,其等高线图偏椭圆形,表明两个因素之间有一定的交互作用。结合表4可知,3因素对多肽质量分数影响力为:酶解时间>料液比>酶添加量。


图5 酶添加量、酶解时间和料液比交互作用对褶牡蛎多肽提取的影响Fig. 5 Interactive effects of enzyme dosage, hydrolysis time and solidto-water ratio on the yield of polypeptides from A. plicatula
图6 a中,随着酶添加量的增加和酶解时间的延长,总糖质量分数呈现先增加后减小的趋势,其等高线图偏椭圆形,判断两个因素之间有一定的交互作用;图6b中,随着酶添加量和料液比水平的增加,总糖质量分数先增加后减小,两者的等高线图偏椭圆形,说明两者有一定的交互作用;图6c中,随着酶解时间和料液比水平的增加,总糖质量分数同样先增加后降低,且两因素的交互作用较弱。综合图6可以看出对总糖提取,3 种因素之间交互作用不显著。结合表4可知,3因素对总糖含量影响力为:酶添加量>酶解时间>料液比。


图6 酶添加量、酶解时间和料液比交互作用对褶牡蛎总糖提取的影响Fig. 6 The interactive effects of enzyme dosage, hydrolysis time and liquid-solid ratio on the yield of total-sugar from A. plicatula
图7 a中,随着酶添加量和酶解时间水平的增加,水解度呈现先增加后降低的趋势,且其二维等高线图偏椭圆形,判断两个因素之间有一定的交互作用;图7b中,随着酶添加量的增加,水解度呈现先增加后降低的趋势;随着料液比水平的增加水解度逐渐降低,与单因素试验结果一致。图7c中,随着酶解时间的延长,水解度先增加后降低;随着料液比水平的增加水解度逐渐降低,其等高线图表明两个因素之间无交互作用。结合表4可知,3因素对水解度影响力为:酶添加量>料液比>酶解时间。


图7 酶添加量、酶解时间和料液比两两交互作用对褶牡蛎水解度的影响Fig. 7 The interactive effects of enzyme dosage, hydrolysis time and liquid-solid ratio on the degree of hydrolysis from A. plicatula
图8 a中,随着酶添加量和酶解时间水平的增加,酸性糖质量分数呈现先增加后降低的趋势,且其二维等高线图偏椭圆形,判断两个因素之间有交互作用显著;图8b中,随着酶添加量和料液比水平的增加,水解度呈现先增加后降低的趋势,其二维等高线图偏椭圆形,表明两个因素之间交互作用显著。图8c中,随着酶解时间的延长和料液比水平的增加,酸性糖先增加后降低,其等高线图表明两个因素之间交互作用显著。结合表4可知,3因素对酸性糖质量分数影响力为:料液比>酶添加量=酶解时间。

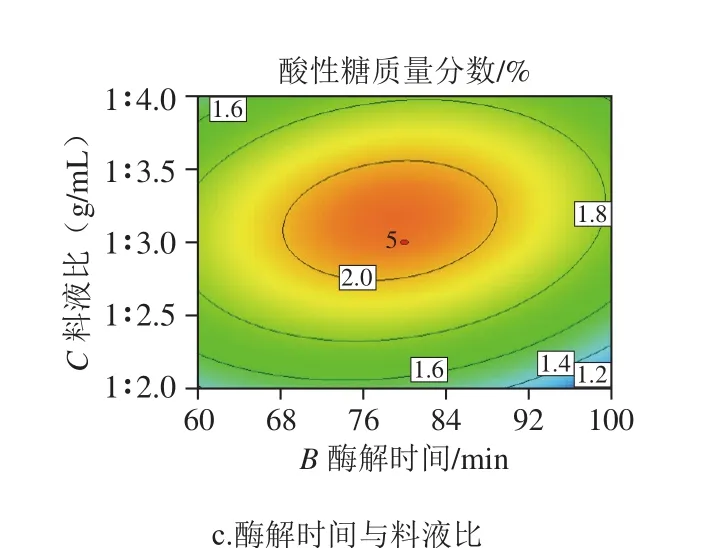
图8 酶添加量、酶解时间和料液比两两交互作用对褶牡蛎酸性糖提取的影响Fig. 8 Interactive effects of enzyme dosage, hydrolysis time and solidto-water ratio on the yield of glycosaminoglycan from A. plicatula
经Design-Expert 8.0.5.0软件分析可得最佳工艺条件为添加胰蛋白酶0.21%、酶解时间79.26 min、料液比1∶3.08(g/mL),相应的响应面二次模型预测多肽质量分数为86.31%,总糖质量分数为31.40%,水解度为11.79%,酸性糖质量分数为2.07%。为验证该响应面法的可行性,考虑到实际操作问题,选取最佳提取工艺为胰蛋白酶添加量0.2%、酶解时间80 min、料液比1∶3(g/mL),重复3 次实验得到褶牡蛎酶解液中多肽质量分数为(85.14±1.67)%,总糖质量分数为(28.35±2.72)%,水解度为(11.12±0.61)%,酸性糖质量分数为(1.60±0.10)%,与回归方程预测值相近,说明褶牡蛎多糖多肽联产工艺是可行的,并在此条件开展以下实验。
取500.0 g褶牡蛎匀浆,按照所得最佳工艺酶解褶牡蛎,经过超滤膜分离酶解上清液,得粗多糖制品和粗多肽制品,重复3 次,粗多糖冻干品(19.11±0.41)g,得率为(2 9.3 9±0.4 1)%;粗多肽冻干品(23.93±0.74)g,得率为(36.81±0.47)%。得率与褶牡蛎干粉中总糖质量分数及蛋白质含量相近,判断其可用于联产制备褶牡蛎多糖及多肽制品。
另外,经过8 kDa超滤膜超滤分离后,使用三氯乙酸沉淀法、苯酚-硫酸法、1,9-二甲基亚甲基蓝法测定各浓缩冻干粉,其颜色反应证实8 kDa超滤膜分离效果良好,可用于褶牡蛎多糖多肽联产工艺。
3 结 论
通过响应面法建立3 种影响因素酶添加量、酶解时间及料液比与4 个响应值多肽质量分数、总糖质量分数、水解度及酸性糖质量分数相互作用的模型,得出褶牡蛎多糖多肽联产的最优工艺为匀浆褶牡蛎全脏器后,添加3 倍体积水,55 ℃水浴0.5 h,调节pH 8.0,添加质量分数为0.2%的胰蛋白酶,酶解80 min,即可得到最大含量的褶牡蛎多糖与多肽。本研究具有高效、简洁、生物友好性等特点,为褶牡蛎活性多糖和多肽的联产制备提供了理论依据,为企业创造更大的经济效益,实现褶牡蛎资源的综合利用。
