混合发酵剂对发酵香肠脂肪酸败和蛋白质氧化的影响
2019-10-29张香美尚莉文冯浩桐
卢 涵,张香美 ,彭 澎,尚莉文,冯浩桐,李 鑫
(河北经贸大学 生物科学与工程学院,石家庄 050061)
原料肉能够在微生物的发酵作用下形成口味鲜美、香味浓郁、安全性高、无需冷藏的发酵肉制品[1]。微生物在发酵过程中能够水解原料肉的蛋白质及脂肪,产生大量游离的风味物质,使得发酵肉具有滋味鲜美、香味浓郁的特点。另外,微生物还能够将原料肉中的糖原转化为乳酸等有机酸,使肉的pH降低,抑制其他腐败菌的生长,并经后续加工使水分活度下降,使得发酵肉安全性高且无需冷藏,因此,发酵肉受到广大消费者的 喜爱。
脂肪和蛋白质作为发酵肉中最主要的干物质,很容易发生氧化,近些年来,研究者开始关注发酵肉制品加工贮藏过程中的氧化变化。李静等[2]以四川香肠为研究对象,探索了脂肪氧化对四川香肠成熟过程中蛋白质降解及感官品质的影响。吴雪燕[3]研究了中式香肠在成熟过程中蛋白质氧化对感官品质的影响。发酵肉中的氧化主要是由于自由基(例如NO、羟自由基、过氧化氢、超氧阴离子等)与蛋白质及脂肪发生的自由基链式反应引起的。脂肪氧化会形成带有酸败气味的醛、酮、酸等,令人不悦。另外脂肪氧化会促进肌红蛋白质氧化导致肉褐变。一般认为,脂肪氧化会引发蛋白质氧化。蛋白质氧化会造成侧链氨基酸的改变,产生羰基化合物及蛋白交联等大分子聚合物,最终会影响到产品的颜色、质构、风味及营养价值[4-5]。
有研究表明,与传统发酵工艺相比,定向接种发酵技术能够大大缩短产品的生产周期,并提高产品的安全性。且很多定向接种发酵技术所用的发酵菌种的抗氧化活性已经得到广泛验证,例如某些乳酸菌及某些发酵用葡萄球菌种在生产过程中产生过氧化氢酶和超氧化物歧化酶,能够提高发酵肉的氧化稳定性[6]。因此,本试验采用植物乳杆菌及模仿葡萄球菌接种到猪肉中制作发酵猪肉香肠,在其发酵及后熟过程中测定发酵猪肉香肠的菌落总数及乳酸菌数、蛋白及脂肪氧化情况及感官品质,探究混合发酵剂对猪肉香肠产品脂肪和蛋白质氧化的影响,为发酵肉的定向接种发酵奠定理论基础,有利于发酵肉质量的提高,促进中国发酵肉加工业的健康发展。
1 材料与方法
1.1 试验材料及仪器设备
原料:从超市购买新鲜猪里脊肉和背部肥膘(宰后24~48 h)。
菌种: 植物乳杆菌、模仿葡萄球菌来自于河北经贸大学生物科学与工程学院微生物实验室。
仪器设备:Sigma 3K15低温冷冻离心机,Sigma扬州有限公司;福玛SPX-250B生化培养箱,上海福玛实验设备有限公司;雷磁PHS-3C pH计,上海仪电科学仪器有限公司;759CKT紫外可见分光光度计,上海菁华科技仪器有限公司;金正JM-JR51绞肉灌肠机,中山市金正生活电器有限公司。
1.2 工艺流程
参照吴雪燕[3]的方法并作调整,从超市购买新鲜猪里脊肉和肥膘(宰后24~48 h),按照4∶1的质量比混匀后搅碎成肉馅,放置于冰箱冷藏备用。按照上述肉质量,称取1.5%食盐、1.5%白砂糖、0.3%味精、0.2%肉制品护色剂(亚硝酸钠及曲红素混合品,比例均为质量分数),与水按照m(护色剂)∶V(水)=1∶10的比例溶解混匀后,加入到肉馅中再次混合均匀。流程如下:肉馅→添加辅料→接种(植物乳杆菌及模仿葡萄球菌的最终的接种量均为107CFU/g肉)→灌肠→发酵(37 ℃,相对湿度85%,72 h)→干燥后熟(15 ℃,相对湿度75%,8 d)→成品。
1.3 测定项目与方法
分别选择刚买来的添加辅料后的新鲜肉(0 h),发酵后24、48、72 h,以及干燥后熟第2、4、6、8天共8个时间点各随机抽取3根发酵香肠进行各项指标测定。
1.3.1 细菌菌落总数 参照GB4789.2-2016食品微生物菌落总数的测定方法,在无菌条件下取切碎的样品10 g置于均质袋内,加入90 mL无菌生理盐水,用拍击式均质器8 000 r/min均质2 min,进行梯度稀释,采用平板计数琼脂培养基在(36±1) ℃生化培养箱中培养(48±2) h后进行菌落计数。
1.3.2 乳酸菌总数 参照GB4789.35-2016食品微生物学检验-乳酸菌检验方法,取样及梯度稀释步骤同细菌菌落总数的测定,采用MRS琼脂培养基在(36±1) ℃生化培养箱中培养(72±2) h后进行菌落计数。
1.3.3 pH 参照GB 5009.237-2016食品pH的测定方法,称取绞碎的样品10 g与适量蒸馏水均质混匀,定容至100 mL,室温下浸提1 h,滤纸过滤,取滤液用pH计测定。
1.3.4 肌原纤维蛋白的提取 参照文献[7-8]的方法,取10 g发酵香肠,加入10倍体积的低盐缓冲液(20 mmol/L磷酸钾缓冲液, pH 6.8,100 mmol/L KCl,2 mmol/L MgCl2,2 mmol/L EGTA),用均质机在11 000 r/min速度下匀浆10 s,重复3次,每次匀浆中间间隔5 s,将匀浆液在4 ℃的冷冻离心机中离心10 min,转速为 1 000 g,收集沉淀,此过程重复3次,最后一次时将匀浆液用4层纱布过滤,再离心收集沉淀作为肌原纤维蛋白。所得肌原纤维蛋白用0.6 mol/L NaCl (pH=7.0)溶解,采取双缩脲方法测定所得蛋白浓度。
1.3.5 羰基质量摩尔浓度 参照文献[9]的方法,将肌原纤维蛋白质量浓度调整至2 mg/mL,取 1 mL 肌原纤维蛋白溶液与 1 mL 10 mmol/L 2,4-二硝基苯肼(DNPH)(溶剂为2 mol/L盐酸)混合均匀,室温下暗室反应1 h(每 15 min 旋涡振荡一次)后,添加 1 mL质量分数为 20%的三氯乙酸后离心(10 000 r/min,5 min)取沉淀,用 1 mLV(乙酸乙酯)∶V(乙醇)=1∶1清洗沉淀 3 次除去未反应的试剂直至黄色消失,加 3 mL 6 mol/L 盐酸胍(溶剂为2 mol/L盐酸)溶液后置于 37 ℃条件下水浴保温 15 min 溶解沉淀,在 370 nm 处测吸光值。使用分子吸光系数 22 000 L/(mol·cm)计算羰基质量摩尔浓度,单位用每毫克蛋白中所含羰基的纳摩尔数表示;空白处理是将DNPH溶液换成2 mol/L盐酸。
1.3.6 巯基质量摩尔浓度 参照文献[10]的方法,将 0.5 mL 4 mg/mL 的肌原纤维蛋白溶液与 4.5 mL 的缓冲液 A(0.2 mol/L Tris-HC1,pH 8.0,8 mol/L 尿素,3 mmol/L EDTA,l % SDS 和0.2 mol/L Tris-HC1 (pH 8.0))充分混匀,取 4 mL混合液,加入 0.5 mL 缓冲液 B (0.2 mol/L Tris-HC1,pH 8.0,10 mmol/L DTNB),置于 40 ℃ 水浴锅中保温 25 min,412 nm下测定其吸光度。空白组用 0.6 mol/L NaCl 代替样品。重复3次。巯基质量摩尔浓度用吸光度计算,单位用每克蛋白中所含巯基的摩尔数表示。巯基质量摩尔浓度计算公式:
-SH=a*d/(c*b)
其中 a 表示吸光值,b 表示待测液蛋白质量浓度 mg/mL,c 表示分子吸光系数,为 13 600 mol/(cm·L),d 为稀释倍数11.25。
1.3.7 硫代巴比妥酸(TBARS)值 参照文献[11]的方法,将10 g切碎的发酵香肠浸于50 mL质量分数为7.5%的三氯乙酸溶液(含质量分数为0.1%的 EDTA)中,震荡30 min使之浸提充分,之后用双层滤纸过滤2次,取滤液5 mL,与 5 mL 0.02 mol/L TBA溶液混匀并置于90 ℃水浴锅内保温40 min,取出冷却1 h,采用低温冷冻离心机2 000 r/min离心5 min,取全部上清液加入5 mL氯仿,摇匀,静置,分层,吸出上清液分别在532 nm和600 nm波长处(同时做空白)记录吸光值。
TBARS值(mg/kg)=(A532-A600)/155× 5×72.06
其中A532和A600分别代表上清液在532 nm和600 nm波长处的吸光值。
1.3.8 感官评价 参照文献[12]的方法,由10人组成的感官评定小组参照表1分别从颜色、气味、组织形态和滋味四个方面对样品进行感官评价,总分40分,得分取平均值。当总分在20分以下时代表样品已经不能被消费者所接受。
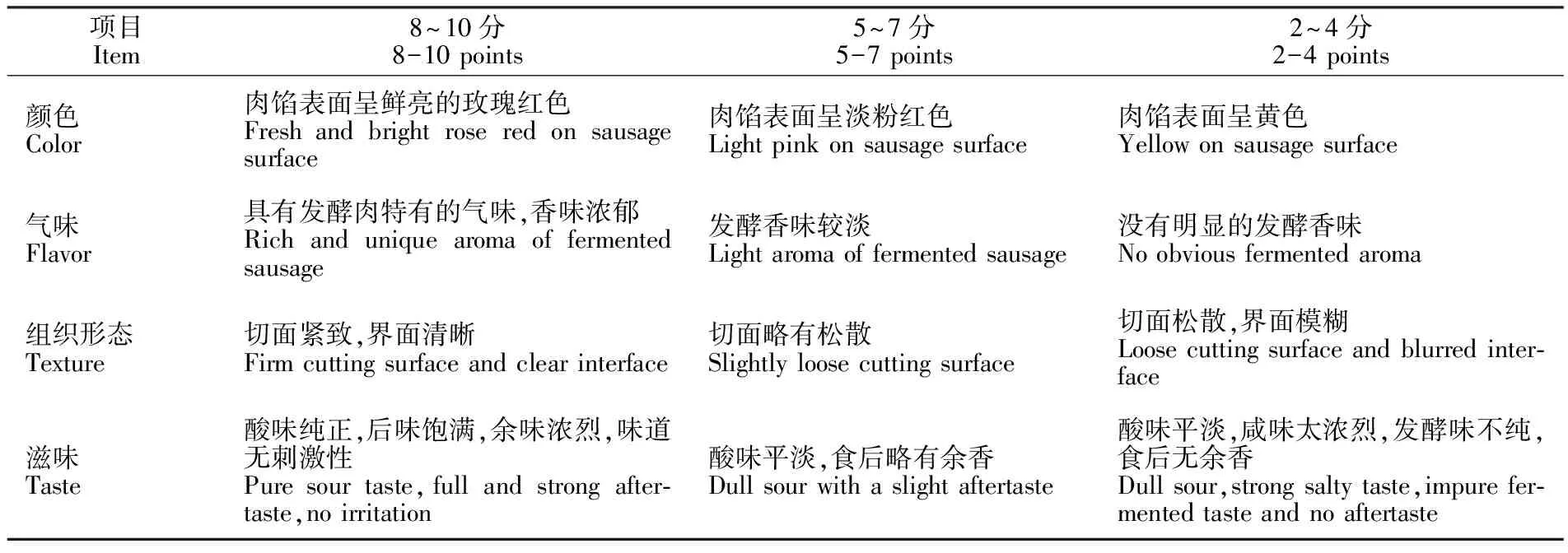
表1 发酵香肠感官评价表Table 1 Sensory scores of fermented sausage
1.4 统计分析
采用Excel 2010和SPSS 20.0软件处理数据,以“平均值±标准差”的形式表示。不同处理下样品的均值采用ANOVA中的 LSD法进行比较,取95%置信度(P<0.05)。
2 结果与分析
2.1 自然发酵及接种发酵香肠的菌落总数随时间的变化
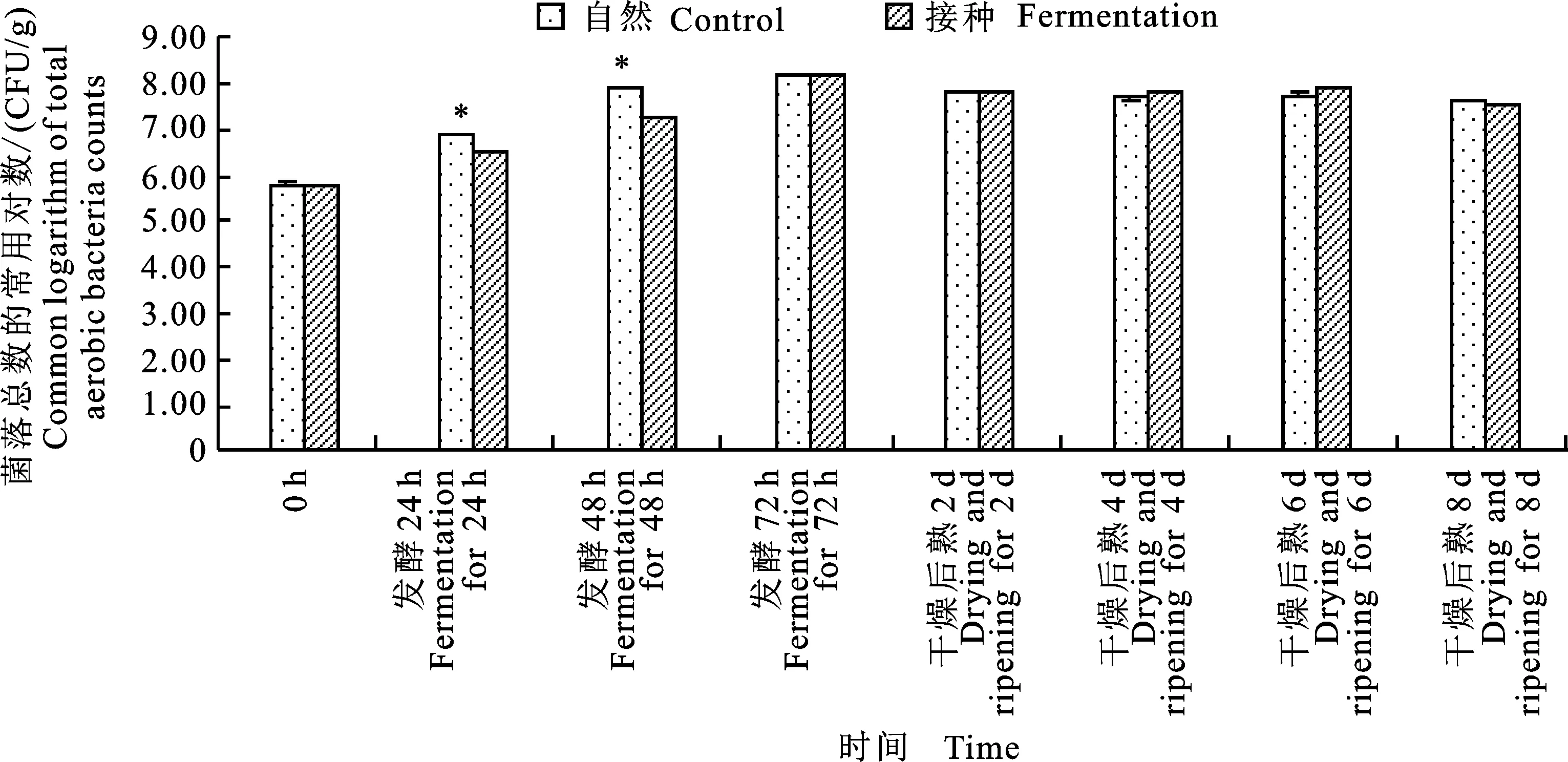
如图1所示,自然发酵及接种发酵组在发酵期间(0~72 h)的菌落总数几乎呈现直线上升趋势,72 h时达到174×106CFU/g,可能是由于37 ℃为细菌的生长繁殖提供了适宜的条件。且发现在发酵期间,接种发酵组的菌落总数要显著小于自然发酵组(P<0.05),这说明接种了植物乳杆菌及模仿葡萄球菌能够一定程度上抑制其他细菌的生长。在后熟过程中两组的菌落总数均有所下降,可能是由于葡萄糖的消耗和温度的下降抑制了细菌的生长。发酵后熟结束后,两组的菌落总数均在40×106CFU/g左右,显著高于原始菌落数。类似地,张凤宽等[13]发现接种了干酪乳杆菌和戊糖片球菌的香肠在发酵成熟过程中菌落总数显著增加。
2.2 自然发酵及接种发酵香肠的乳酸菌总数随时间的变化
如图2所示,两组乳酸菌的变化趋势相似,在发酵0~72 h,乳酸菌数逐渐增加,自然发酵组及接种发酵组分别达到100×106CFU/g和158×106CFU/g。结合图1 可以看出,乳酸菌数与菌落总数的变化趋势相同,说明乳酸菌可以成功启动发酵并支配整个发酵过程,自然发酵组在发酵第72 h乳酸菌数也达到了较高水平,成为发酵香肠中的优势菌,这点与陈曦等[14]的结果类似。在后熟期间乳酸菌数缓慢下降,这可能是由于乳酸菌发酵产生大量的乳酸和少量的有机酸,这些产物的积累对乳酸菌的繁殖也会产生抑制作用;同时,由37 ℃下降至低温也不利于乳酸菌的生长[15]。在后熟第8天可明显看到自然发酵组的乳酸菌数显著小于接种发酵组的乳酸菌数(P<0.05),可能是由于自然发酵组中的腐败菌在后熟第8天逐渐占据了优势。
2.3 自然发酵及接种发酵香肠的pH随时间的变化
如图3所示,在发酵0~72 h,接种发酵组的pH迅速下降,自然发酵组pH下降缓慢(P< 0.05),说明接种的乳酸菌产酸能力远强于自然发酵组中的野生乳酸菌,可产生更多的乳酸或有机酸使香肠的酸度升高,在短期内使样品的pH迅速下降。在后熟期间自然发酵的pH均有所回升,可能是由于微生物分解蛋白质产生胺、氨等碱性物质[16]。在整个发酵后熟过程中,接种发酵组的pH均低于自然发酵组。
“*”代表自然发酵组和接种发酵组之间具有显著性差异(P<0.05),下同 “*” Significant difference between control and fermented groups(P<0.05),the same below
图1 自然发酵及接种发酵香肠的菌落总数随时间的变化
Fig.1 The changes of total aerobic bacteria counts of control and fermented sausage with storage time
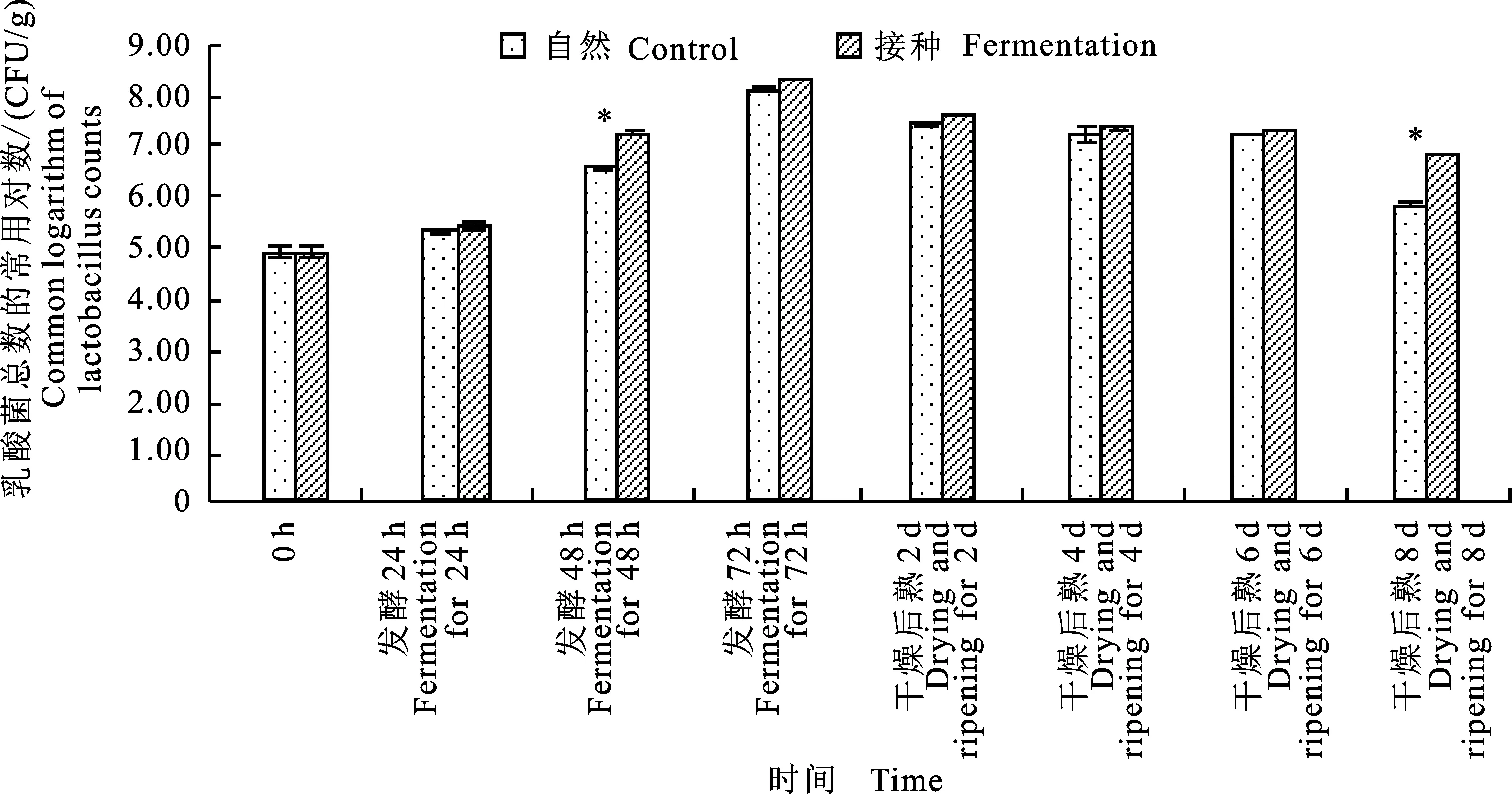
图2 自然发酵及接种发酵香肠的乳酸菌随时间的变化Fig.2 The changes of lactobacillus counts of control and fermented sausage with storage time
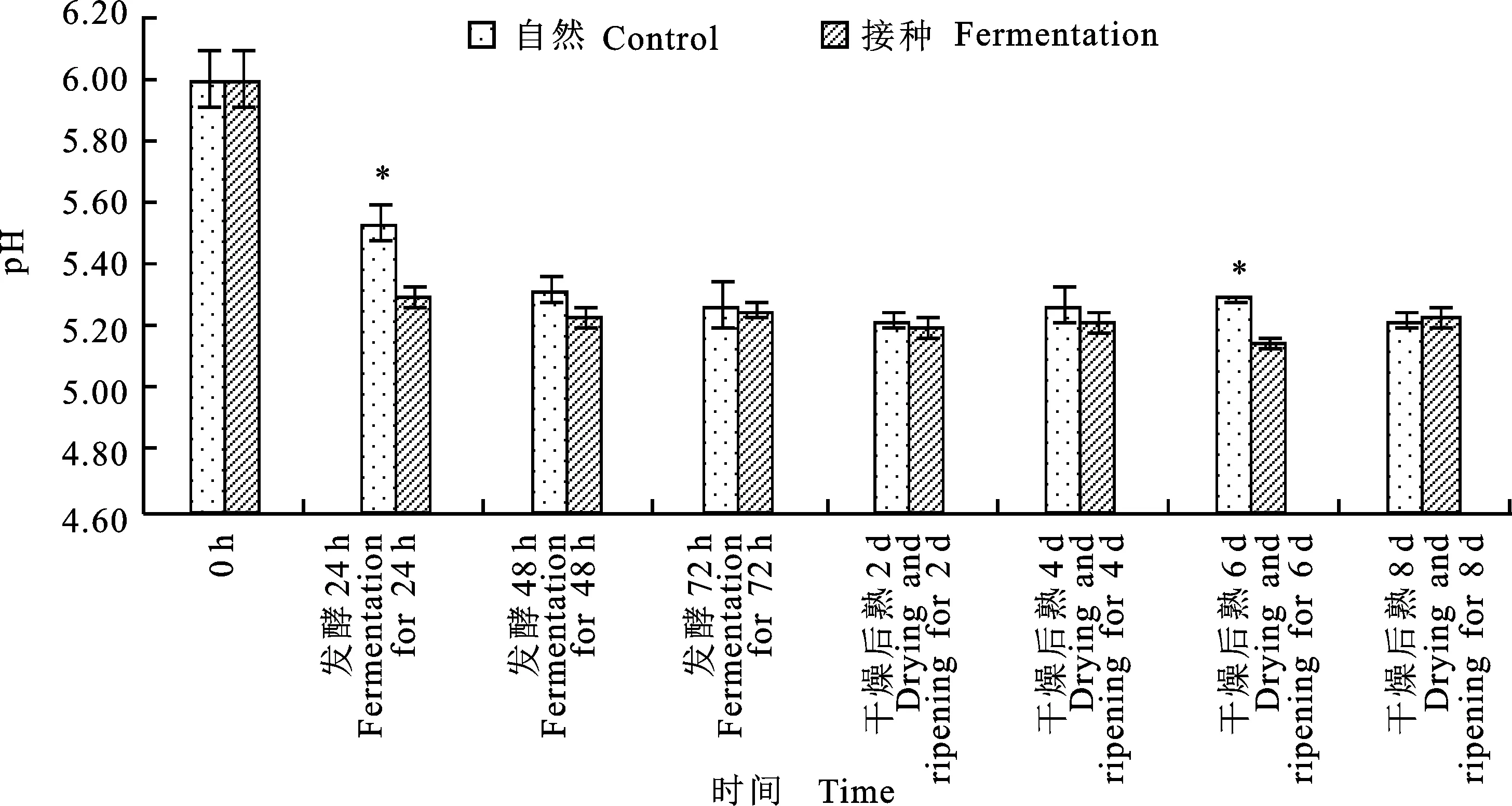
图3 自然发酵及接种发酵香肠的pH随时间的变化Fig.3 The changes of pH of control and fermented sausage with storage time
2.4 自然发酵及接种发酵香肠的巯基质量摩尔浓度随时间的变化
如图4所示,两组发酵香肠的肌原纤维蛋白的总巯基质量摩尔浓度随时间的延长而显著下降 (P< 0.05)。这是由于巯基被氧化成了二硫键,而巯基质量摩尔浓度下降的越多,说明蛋白被氧化地越严重。新鲜猪肉的总巯基质量摩尔浓度为3.55×10-5mol/g,自然发酵组和接种发酵组在发酵第72 h分别下降至 0.90×10-5mol/g及 1.19×10-5mol/g,具有显著性差异(P<0.05),同样在后熟后熟第8天,接种发酵组的总巯基质量摩尔浓度显著高于自然发酵组(P<0.05),这说明自然发酵组比接种发酵组中蛋白质的氧化 严重。
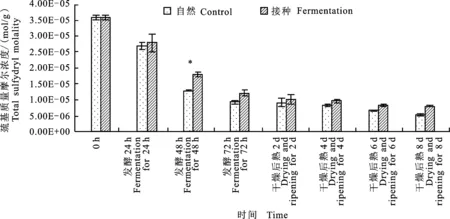
图4 自然发酵及接种发酵香肠肌原纤维蛋白的巯基质量摩尔浓度随时间的变化Fig.4 The changes of total sulfydryl molality of control and fermented sausage with storage time
2.5 自然发酵及接种发酵香肠的羰基质量摩尔浓度随时间的变化
如图5所示,在发酵及后熟4 d时间内两组发酵香肠肌原纤维蛋白的羰基质量摩尔浓度在1.56~ 2.48 nmol/mg左右变化,在后熟第6~8天时上升至6~8 nmol/mg(P<0.05)。随着时间的延长,猪肉肌原纤维蛋白的某些氨基酸残基受到自由基的攻击,形成了羰基化合物[17],因此羰基质量摩尔浓度会随着时间的延长而上升。并且在后熟第6~8天自然发酵组猪肉肌原纤维蛋白的羰基质量摩尔浓度显著高于接种发酵组 (P<0.05),这说明自然发酵组的氧化比接种发酵组严重,这与上文巯基质量摩尔浓度的结果是一致的。
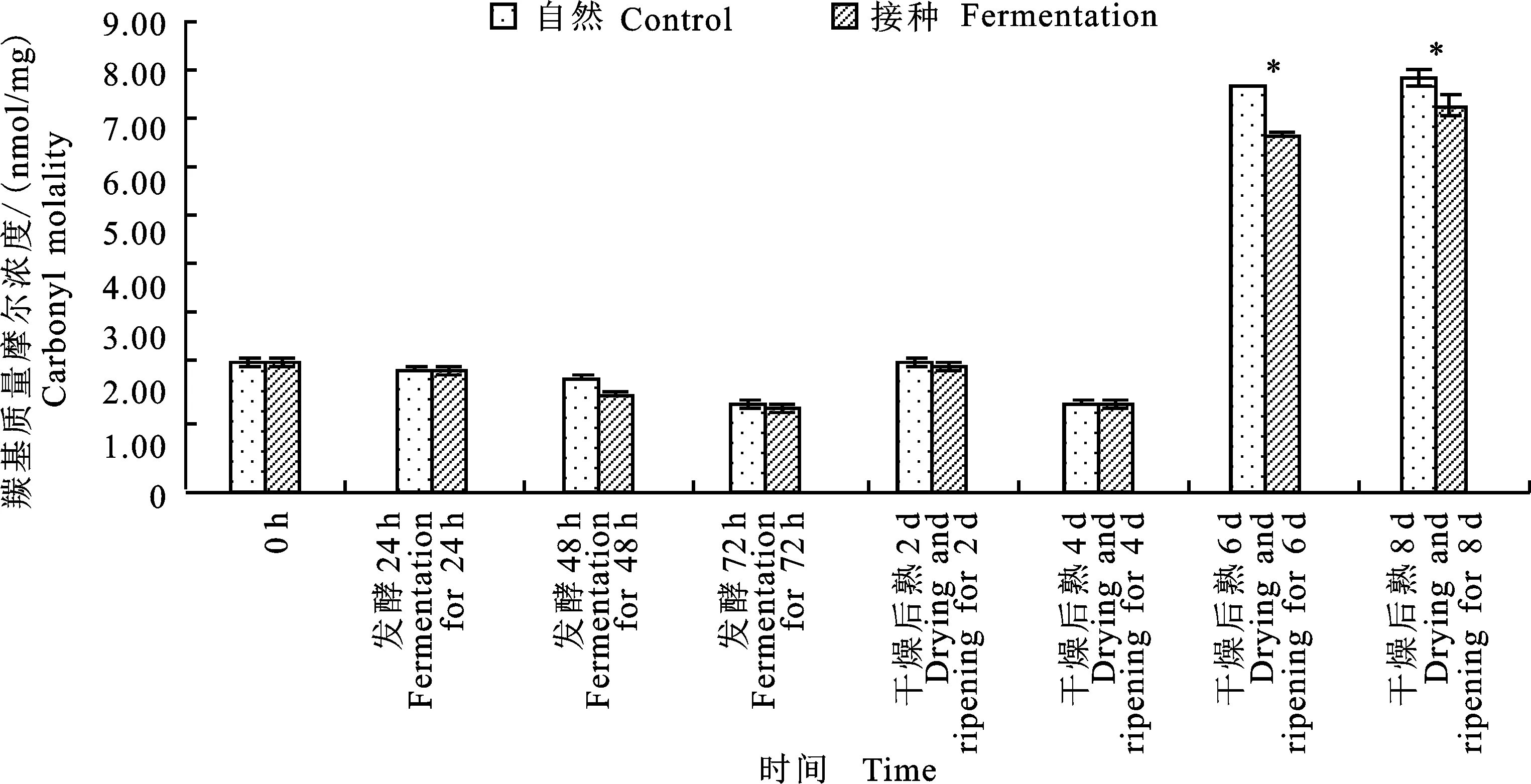
图5 自然发酵及接种发酵香肠肌原纤维蛋白的羰基质量摩尔浓度随时间的变化Fig.5 The changes of carbonyl molality of control and fermented sausage with storage time
2.6 自然发酵及接种发酵香肠的TBARS值随时间的变化
TBARS 值是是评价肉类脂肪酸败程度的一个重要指标。其值越大,脂肪氧化程度越深[18]。如图6所示,两组发酵香肠的TBARS值均随着时间延长而升高,这说明无论是自然发酵还是接种发酵,发酵香肠的脂肪氧化都在不断加深。这与Ahmad等[19]的报道类似。研究还发现:在发酵第72 h及后熟2~8 d,自然发酵组的TBARS值显著大于接种发酵组(P<0.05),这与Bozkurt等[20]及Baka等[21]的结果类似。这说明植物乳杆菌及模仿葡萄球菌的添加降低了脂肪氧化酸败的程度。这可能是由于植物乳杆菌和模仿葡萄球菌在肉类发酵和成熟过程中能够产生超氧化物歧化酶及过氧化氢酶[6],分解猪肉香肠发酵成熟过程中产生的过氧化物,从而抑制了脂肪氧化。
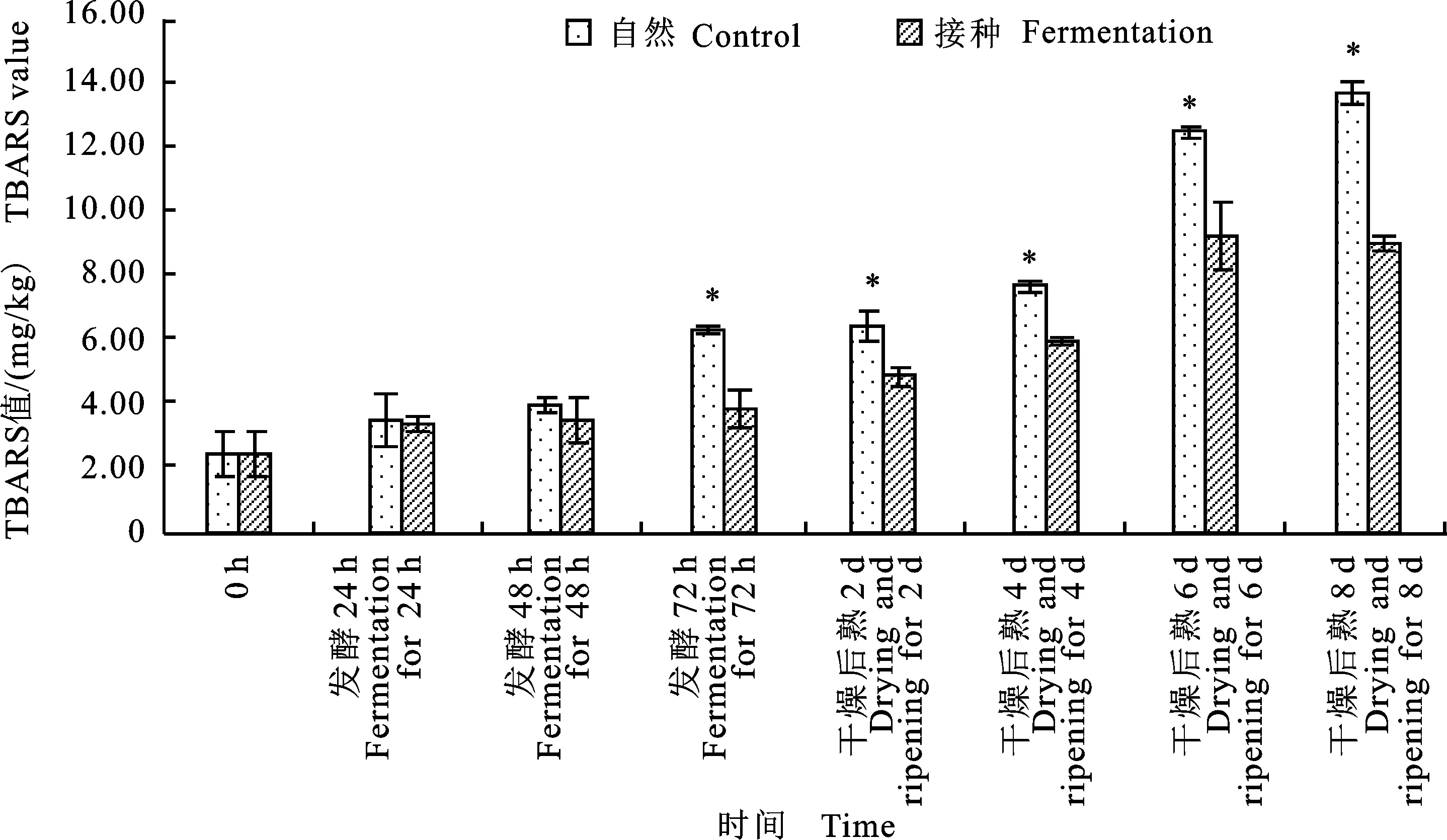
图6 自然发酵及接种发酵香肠的TBARS值随时间的变化Fig.6 The changes of TBARS value of control and fermented sausage with storage time
2.7 自然发酵及接种发酵香肠的感官评价随时间的变化
从图7中可以看出,在整个发酵及后熟过程中,接种发酵组猪肉香肠的感官评价整体优于自然发酵组,尤其在发酵72 h及后熟第8天,接种发酵组的感官评分显著高于自然发酵组(P< 0.05)。同时由图8分析后熟第8天猪肉香肠的颜色、滋味、组织形态及气味评价结果发现,接种发酵组的气味及滋味显著好于自然发酵组(P< 0.05),说明植物乳杆菌和模仿葡萄球菌发酵对猪肉香肠的感官有重要的改善作用,尤其在气味和滋味上。
3 讨论与结论
3.1 混合发酵剂提高发酵猪肉香肠的感官品质
本研究中接种发酵组的感官评分显著高于自然发酵组,尤其是滋味和气味方面。这与陈曦等[14]的研究结果类似,他们也发现与空白组相比,添加发酵剂(两种乳酸菌)的香肠气味、滋味和总体可接受性评分更高。究其原因,发酵肉的滋味物质来源于蛋白质降解生成的肽和游离氨基酸,且发酵肉的滋味与气味与发酵过程中产生的有机酸质量摩尔浓度显著正相关[22],在肉制品发酵过程中,乳酸菌代谢产酸可促进蛋白质的降解[23],葡萄球菌发酵剂有助于氨基酸代谢源风味物质的形成[24]。这与本试验中发酵组香肠较低的pH及较高的乳酸菌数相呼应。
3.2 混合发酵剂提高发酵猪肉香肠的氧化稳 定性
本研究中,接种发酵组猪肉香肠的肌原纤维蛋白的巯基质量摩尔浓度显著高于自然发酵组,接种发酵组猪肉香肠的肌原纤维蛋白的羰基质量摩尔浓度及TBARS值显著低于自然发酵组,这说明与自然发酵组相比,接种发酵组的蛋白质氧化及脂肪酸败程度大大下降。类似地,刘浩等[25]也发现未添加植物乳杆菌发酵的羊肉香肠的TBARS值最大,且上升速度快,添加植物乳杆菌的羊肉香肠的TBARS值上升速度相比则较为缓慢;周慧敏等[23]发现添加葡萄球菌混合发酵剂的腊肉的过氧化值和TBARS值低于空白组。Chen等[26]也得到相似的结果。这可能与植物乳杆菌和模仿葡萄球菌在肉类发酵和成熟过程中能够产生超氧化物歧化酶及过氧化氢酶有关[6],这两种酶能够分解猪肉香肠发酵成熟过程中产生的过氧化物,而过氧化物是脂肪酸败的重要中间产物,从而抑制了后续醛类和酮类等氧化产物的生成。目前未见报道研究发酵肉中的蛋白氧化情况,但是蛋白质氧化与脂肪酸败之间联系紧密。据相关报道[12,27],脂肪氧化产生的中间产物,即过氧化物可能与蛋白质发生交互作用,诱导蛋白发生氧化,促进肌原纤维蛋白羰基类物质的产生及巯基的流失。本研究发现随着猪肉香肠的TBARS值上升,猪肉香肠肌原纤维蛋白的巯基质量摩尔浓度呈现下降趋势,羰基质量摩尔浓度呈现上升趋势,也印证了这一结论。
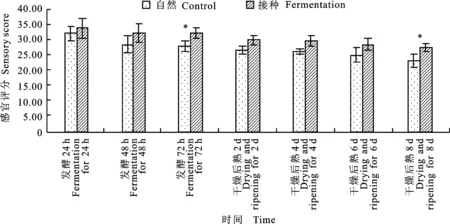
图7 自然发酵及接种发酵香肠的感官评价随时间的变化Fig.7 The changes of sensory score of control and fermented sausage with storage time
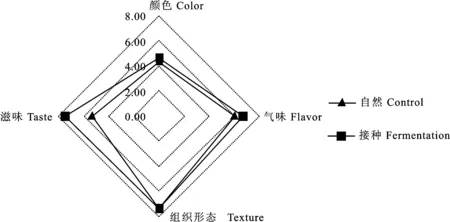
图8 自然发酵及接种发酵香肠后熟第8天的各感官指标(颜色、滋味、组织形态及气味)对比Fig.8 Comparison of sensory attributes (color,taste,texture,and flavor) of control and fermented sausage at 8 d
综上所述,猪肉香肠经过植物乳杆菌和模仿葡萄球菌发酵后,其菌落总数、pH、肌原纤维蛋白的羰基质量摩尔浓度、TBARS值显著低于自然发酵组,其乳酸菌总数、肌原纤维蛋白的巯基质量摩尔浓度、感官评分显著高于自然发酵组,提高了产品的感官品质,抑制了产品的蛋白质氧化及脂肪氧化。这说明植物乳杆菌及模仿葡萄球菌混合能够作为发酵肉的定向接种发酵剂,有利于发酵猪肉香肠品质质量的提高。
