双氯芬酸钠残留检测的质谱条件选择
2019-10-29杨亚军刘希望李世宏焦增华李剑勇
杨亚军,刘希望,秦 哲,李世宏,焦增华,李剑勇
(中国农业科学院 兰州畜牧与兽药研究所,农业部兽用药物创制重点实验室,甘肃省新兽药工程重点实验室,兰州 730050)
双氯芬酸钠(diclofenac sodium,CAS15307-79-6)作为苯乙酸类衍生物(结构式见图1),系非甾体解热镇痛抗炎药。双氯芬酸钠在欧盟已被批准应用于猪和牛,推荐剂量为2.5mg/kg,肌内注射,推荐的治疗周期为1~3d[1]。欧盟规定,在牛和猪可食性组织及牛奶中双氯芬酸钠的残留标识物为双氯芬酸(DCF);在牛、猪的肌肉、肝脏、肾脏、脂肪和牛奶中的最大残留限量(MRLs)分别为5、5、10、1和0.1μg/kg。欧盟制定的双氯芬酸每日允许摄入量(acceptable daily intake, ADI)为0.5μg/kg或每人30μg[1]。在国内,双氯芬酸钠也已被批准用于猪,辅助用于外伤手术、炎症等引起的疼痛和发热[2],同时也有应用于奶牛临床型乳房炎辅助治疗的试验报道[3];其MRLs与欧盟规定相同[2]。
目前,多采用LC-MS/MS对动物性食品[4-6]、血浆[7]和环境样品[8]中的DCF进行定量检测。由于DCF的结构中含有羧基和氨基,因此可以采用电喷雾离子源负离子模式(ESI-)检测[4-5,8],也可以使用正离子模式(ESI+)检测[6-7]。本研究比较两种模式下的母离子和子离子的扫描图谱,以及标准溶液和空白肝脏加标样品的定量检测结果,以期为DCF的残留检测方法优化提供借鉴。
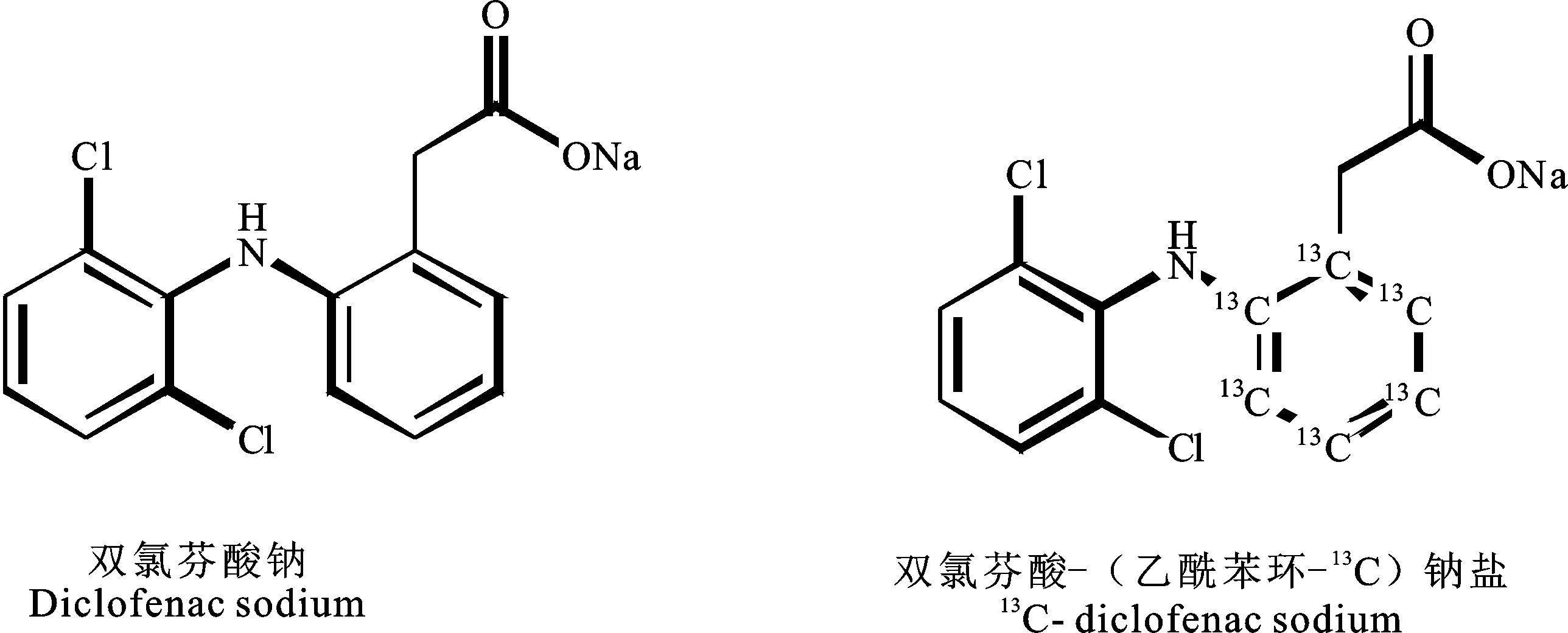
图1 相关化合物结构式Fig.1 Chemical structures of the analytes
1 材料与方法
1.1 试 剂
双氯芬酸钠,中国食品药品检定研究院,批号100334-201803,含量按C14H10Cl2NNaO2计 100.0%。双氯芬酸-(乙酰苯环-13C)钠盐(同位素标记物,结构式见图1),CAS:1261393-73-0,分子式13C6C8H10Cl2NO2Na·4.5H2O,相对分子质量为405.16,Sigma-Aldrich公司,批号 BCBT5244, 纯度为100.0%。
乙腈,质谱纯,美国Fisher公司;甲酸,质谱级,日本TCI公司;18 MΩ去离子水,由Direct-Q○R3纯水系统(Millipore,USA)制备。
1.2 仪 器
液相色谱-串联三重四级杆质谱仪(Agilent 1200-6410A),电喷雾离子源,数据采集与处理软件为MassHunter B.01.04 (Agilent Technologies,USA)。QUINTIX65-1CN60G型分析天平,感量0.000 01 g,sartorius;CPA224S电子分析天平,感量0.000 1 g,sartorius;Mixer-400型组织匀浆机,瑞士步琦公司;Vortex Genie 2涡旋混合器,Scientific Industries,美国;Multifuge X3R大容量低温离心机,Thermo Scientific,美国;固相萃取装置;RapidVap型样品快速蒸发系统,美国Labconco公司;可调微量移液器,Eppendorf 公司。
1.3 试验方法
1.3.1 色谱和质谱条件 色谱柱为Agilent Eclipse plus C18(3.0 mm× 50 mm,1.8 μm),乙腈-水-甲酸(60∶40∶0.1)为流动相,等度洗脱,流速0.4 mL/min,柱温35 ℃。
电喷雾离子源(ESI),负离子模式或正离子模式,毛细管电压为-3 500 V或+4 000 V;喷雾器压力为241 kPa;干燥气温度为300 ℃(ESI-)或350 ℃(ESI+);干燥气流量(氮气)为10 L/min;电子倍增器电压增加值(ΔEMV)为 -300 V(ESI-)或+300 V(ESI+)。
1.3.2 试样制备与保存 取适量新鲜空白牛肝脏,均质,于-20 ℃以下贮存,备用。
1.3.3 质谱条件优化 在ESI-或ESI+条件下,对质量浓度为100 μg/mL的DCF标准溶液,200 μg/mL的13C-DCF标准溶液进行全扫描,确定母离子;再行确定特征离子以及多离子反应监测(MRM)的参数。
1.4 数据分析
在ESI-或ESI+条件下,分别对DCF质量浓度为2 ng/mL,13C-DCF质量浓度为20 ng/mL的混合标准溶液,以及DCF添加量为LOQ(0.5 ng/g),13C-DCF添加量为5 ng/g(与MRL一致)的肝脏样品,进行MRM检测,进样量为10 μL,梯度洗脱,比较定量离子的峰面积、信噪比(SNR,峰高对峰高),并考察方法回收率和精密度等。
2 结果与分析
2.1 质谱条件的确定
2.1.1 ESI-模式 在ESI-模式下,质量浓度为100 μg/mL的DCF标准溶液,其进样量为2 μL,质量浓度为200 μg/mL的13C-DCF的标准储备溶液的进样量为1 μL。扫描范围为m/z100~500,碎裂电压(fragmentor)逐步优化为20 V,母离子扫描图见图2。
ESI-条件下,DCF[M-H]-为294.1,13C-DCF[M-H]-为300.1。由于DCF和13C-DCF的结构中含有2个氯原子,自然界中存在35Cl和37Cl,大致比例为3∶1,因此在各自的母离子附近存在丰度比相对复杂的同位素峰。
另外,标准溶液在ESI-条件下进行全扫描时,除母离子之外,均出现m/z相差44且丰度较高的未知离子。在对毛细管电压、碎裂电压和干燥气温度等进行优化后,其丰度仍然很高。
选取[M-H]-294.1和[M-H]-300.1分别作为DCF和13C-DCF的母离子,进行子离子扫描,结果见图3。
在DCF和13C-DCF的子离子扫描图谱中,同样出现了与母离子m/z相差44的子离子 294.1→250.1和300.1→256.1。
含有羧基的化合物可以在源内发生裂解,成为原化合物的离子[9]。DCF和13C-DCF的结构中均含有羧基(图1)。因此认为,在母离子扫描时出现的m/z相差44且丰度较高的未知离子,是DCF和13C-DCF的源内裂解产物。
进而确定了DCF和13C-DCF的特征离子,并优化了多反应离子监测(MRM)的参数(表1)。
2.1.2 ESI+模式 ESI+模式下,DCF和13C-DCF的母离子扫描图见图4,子离子扫描图见图5。
ESI+条件下,DCF [M+H]+为296.1,13C-DCF [M+H]+为302.1。在碎裂电压为 75 V、干燥气温度为350 ℃的质谱条件下,没有出现ESI-条件下的m/z相差44的离子。进而确定DCF和13C-DCF的特征离子,并优化多反应离子监测(MRM)的参数,结果见表2。另外,不同极性条件下DCF及13C-DCF的定量离子也有所区别(图3和图5)。
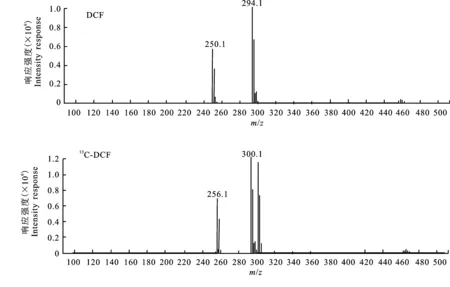
图2 ESI-条件下DCF和13C-DCF的母离子扫描图Fig.2 MS spectra of the analytes’ precursor ion under ESI-
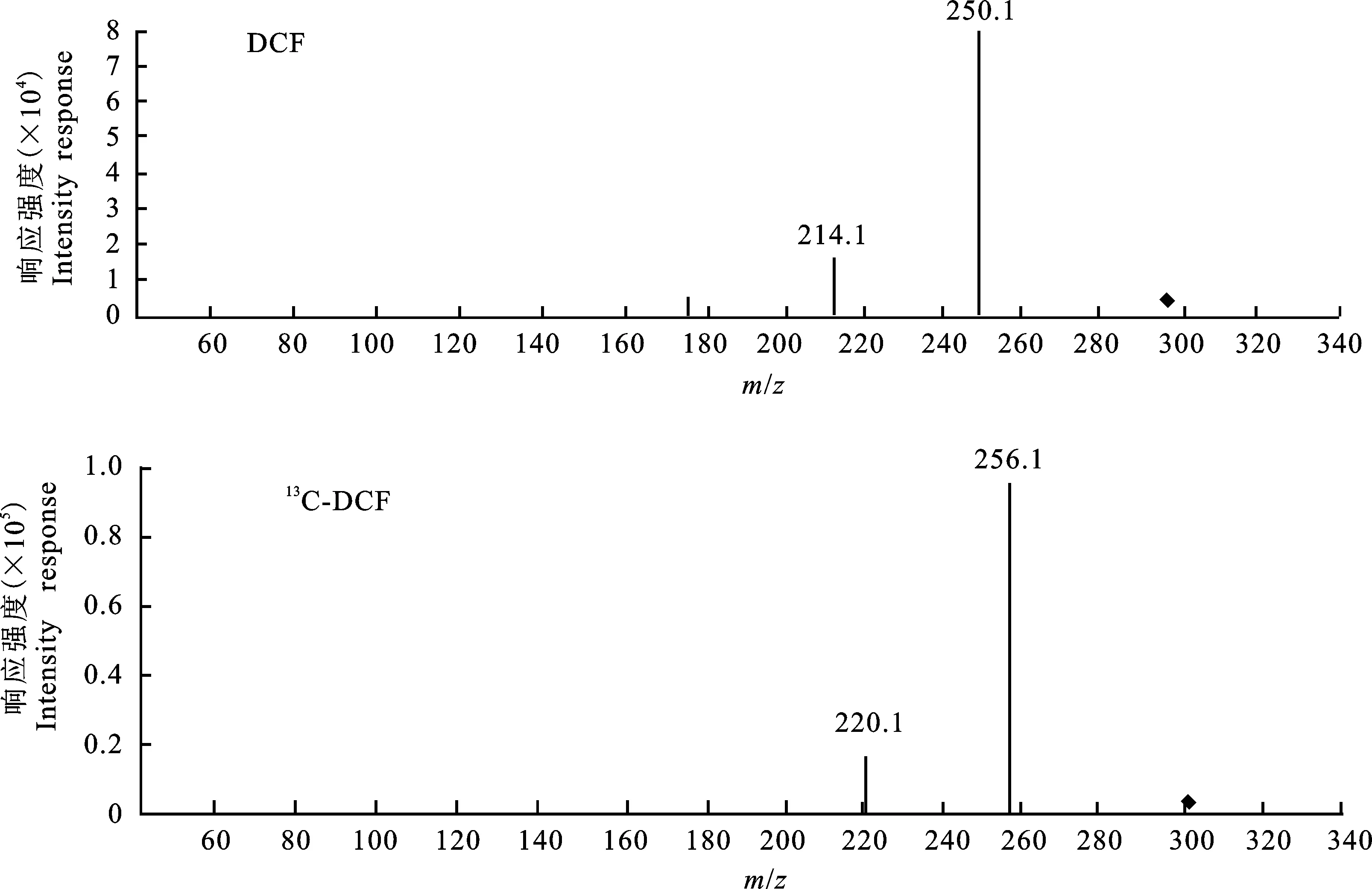
图3 ESI-条件下DCF和13C-DCF的子离子扫描图Fig.3 MS/MS spectra of the analytes’ product ions under ESI-
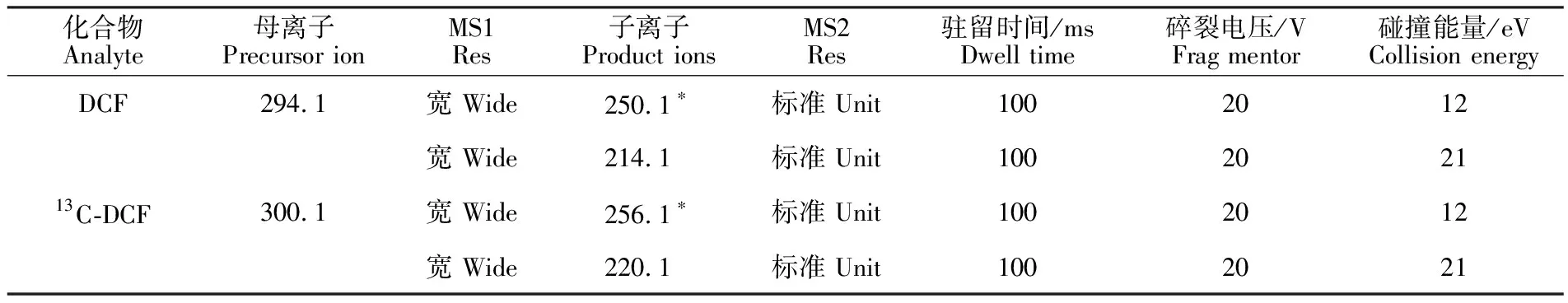
表1 ESI-条件下MRM的检测参数Table 1 MRM parameters under ESI-
注:*为定量离子,下同。
Note:* quantitative ion,the same below.
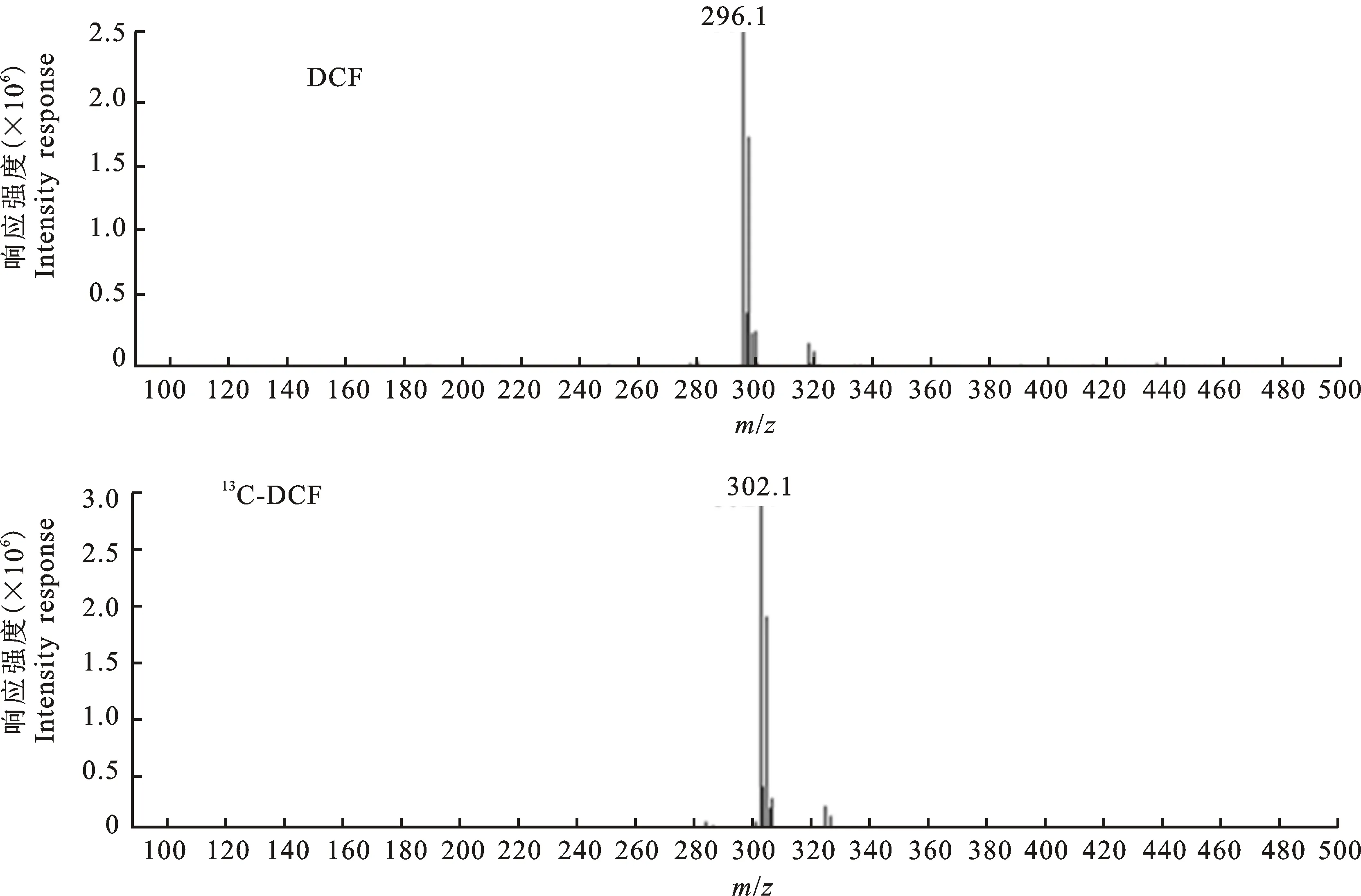
图4 ESI+条件下DCF和13C-DCF的母离子扫描图Fig.4 MS spectra of the analytes’ precursor ion under ESI+
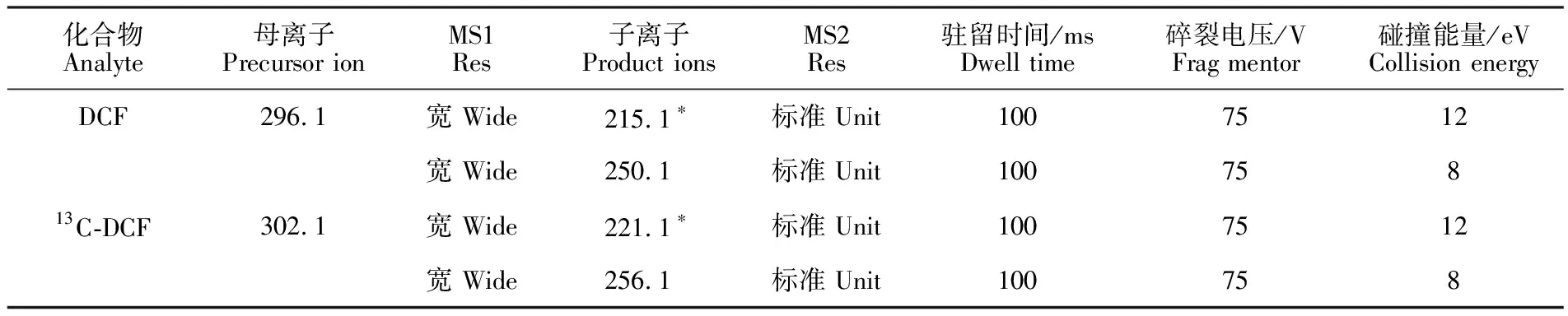
化合物Analyte母离子Precursor ionMS1Res子离子Product ionsMS2Res驻留时间/msDwell time碎裂电压/VFrag mentor碰撞能量/eVCollision energyDCF296.1宽 Wide215.1∗标准 Unit1007512宽 Wide250.1标准 Unit10075813C-DCF302.1宽 Wide221.1∗标准 Unit1007512宽 Wide256.1标准 Unit100758
2.2 MRM检测结果的比较
2.2.1 标准溶液 结果显示,DCF质量浓度为2 ng/mL的同一混合标准溶液(图略),在ESI-条件下,定量离子294.1→250.1的峰面积为498;在ESI+条件下,定量离子294.1→215.1的峰面积为1 525,两者差异较大。
2.2.2 空白加标样品 空白肝脏中DCF的添加量为LOQ(0.5 ng/g),13C-DCF的添加量为5 ng/g(与肝脏MRL相同)时,ESI-和ESI+条件下,待测物及内标的定量离子MRM提取色谱图分别见图6和图7。
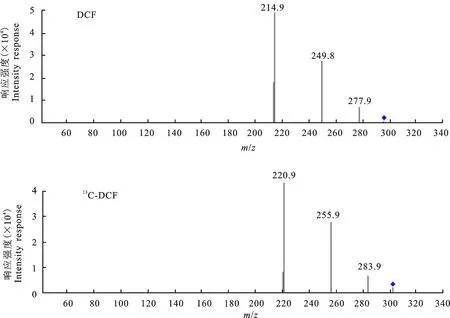
图5 ESI+条件下DCF和13C-DCF的子离子扫描图Fig.5 MS/MS spectra of the analytes’ product ions under ESI+
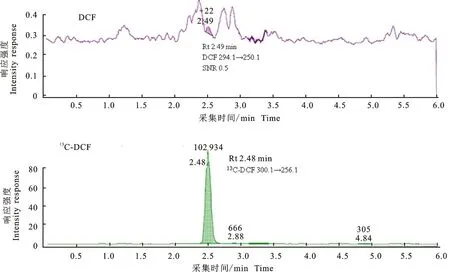
图6 ESI-条件下肝脏样品中定量离子的提取色谱图Fig.6 Quantitative ions extract chromatograms of liver sample under ESI-
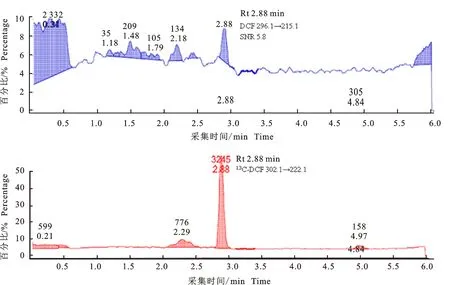
图7 ESI+条件下肝脏样品中定量离子的提取色谱图Fig.7 Quantitative ions extract chromatograms of liver sample under ESI+
如图6和图7所示,添加量为0.5 ng/g(LOQ)的肝脏样品,在经过有机溶剂提取(乙腈)、固相萃取柱净化(Waters MAX),以及浓缩、复溶(2 g样品经提取、净化、浓缩后复溶于0.5 mL流动相中)和过滤后,进样量为10 μL,梯度洗脱。同一样品分别在优化后的MRM条件下,进行ESI-(图6)和ESI+(图7)检测,DCF定量离子的响应及信噪比的差异较大。ESI-时定量离子294.1→250.1几乎没有检测到(图6);而ESI+时定量离子 296.1→215.1的SNR为5.8,可以满足检测。
进一步的研究结果显示,ESI+条件下,DCF添加量为0.5 ng/g(LOQ)的肝脏样品,13C-DCF内标法定量,其回收率在97%~117%,日内精密度(n=6)和日间精密度(n=18)均小于15%,满足兽药残留检测的方法学要求[10]。
3 讨 论
DCF的结构中含有羧基和氨基(图1),理论上采用ESI-和ESI+两种模式都可以进行检测,文献报道中也有采用ESI-和ESI+两种模式进行DCF定量检测的报道。王莉等[4]、王雅琴[5]分别在负离子模式下,以萘普生为内标建立了猪肌肉、肝脏和肾脏中DCF的检测方法。顾继红等[7]在正离子模式下,以吲哚美辛为内标建立人血浆中DCF的检测方法。Jedziniak等[6]建立了牛奶中多种非甾体抗炎药物残留的LC-MS/MS检测方法,其中以DCF-d4为内标,采用正离子模式检测DCF的残留量。
但是本研究发现,在ESI-模式下DCF存在明显的源内裂解现象,导致MRM检测时响应降低,影响动物性食品中DCF残留检测的灵敏度。鉴于DCF在ESI-条件下可以发生源内裂解,建议在检测动物源性食品中DCF的残留量时,采用ESI+模式。
