苏太猪源TTP基因的克隆及其遗传进化分析
2019-10-23张喜懿温贵兰晏旭红付尚林
陈 荣,张喜懿,田 浪,温贵兰*,祝 景,晏旭红,付尚林
(1.贵州大学动物疫病研究所,贵州 贵阳 550025;2.贵州省动物生物制品工程技术研究中心,贵州 贵阳 550016)
锌指蛋白是1类重要的转录因子,广泛存在于真核转录基因组中,在生命过程中发挥着重要作用,如细胞分化、胚胎发育等,主要与RNA和DNA相互作用[1]。Berg[2]等依据锌指蛋白在功能和序列上的不同将其分为9类,CCCH型(C和H分别代表半胱氨酸和组氨酸)是其中1类,而CCCH型中研究最多的是Tristetraproin(TTP)。TTP开放阅读框为981 bp,共编码326个氨基酸,最早发现于纤维原细胞中,是对血清和胰岛素响应的早期基因蛋白产物,通常存在于核静止细胞,蛋白表达水平较低,但在血管生成过程中的极早期表达水平比较高,促进血管的生成[3]。TTP是1种ARE(AU-rich element)结合蛋白,功能明确,可与一些炎性因子mRNA上的ARE结合,降低mRNA的半衰期,在炎症和病毒感染中有重要的负调控作用[4]。近年来的研究表明,TTP可以调节免疫应答,具有抑癌基因功能,对脑水肿起保护作用,TTP可作为HIV-1(Human immunodeficienvy virus 1)复制和AHRR(Aryl hydrocarbon receptor repressor)的调控因子;TTP水平降低在糖尿病性肾病中可作为早期肾损害标记之一等[5~9]。苏太猪是我国培育的国家级瘦肉型新品种,具有性成熟早、性情温顺、耐粗饲、肉味香等优点,近年来关于苏太猪肉质和繁殖能力研究的内容较多,而对其基因研究较少[10]。本试验通过RT-PCR技术成功扩增出苏太猪源TTP基因CDS区,并进行克隆及序列测定、遗传进化分析,以期为深入研究苏太猪源TTP基因的功能奠定理论基础。
1 材料与方法
1.1 主要材料大肠杆菌DH5α感受态细胞,购自碧云天生物技术公司;RNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒,均购自生工生物工程(上海)股份有限公司;反转录试剂盒,购自北京康为世纪生物科技有限公司;pMD-19T载体、2×ESTaqMaster Mix、连接酶SolutionⅠ,购自宝生物工程(大连)有限公司;苏太仔猪血,采自贵州省黔东南州某养殖公司。
1.2 方法
1.2.1引物设计及合成:根据GenBank公布的野猪源TTP基因 (登录号:HM480487.1),采用Primer Premier 5.0软件设计了1对特异性引物。引物序列为:TTP-EcoRV-5’flag-F:CGGATATCTATGGATCT CACCGCCATCTACG;TTP-NotI-5’flag-R:GCGCG GCCGCTTACTCAGAAACAGAAATACG。下划线部分为酶切位点,引物由生工生物工程(上海)股份有限公司合成。
1.2.2苏太猪血液总RNA的提取与反转录:根据RNA 提取试剂盒说明书提取苏太猪血液总RNA;根据反转录试剂盒说明书将提取的总RNA反转录成cDNA,-20 ℃保存。
1.2.3PCR扩增:以所得cDNA为模板进行TTP基因PCR扩增,反应体系20 μL:上、下游引物(3.3 nmol/L)各1 μL,cDNA 2 μL,2×ESTaqMaster Mix 10 μL,ddH2O 6 μL。反应程序:95 ℃预变性 4 min,95 ℃变性40 s,55 ℃退火15 s,72 ℃延伸1 min,共30个循环;72 ℃再延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳进行检测,预扩增片段大小981 bp。
1.2.4克隆与测序:将PCR产物根据胶回收试剂盒进行胶回收纯化,纯化后的PCR产物与pMD-19T载体连接。连接体系12 μL:连接酶Solution Ⅰ 6 μL,纯化的PCR产物5 μL,pMD-19T载体1 μL。连接条件:16 ℃过夜。将全部连接产物转化至大肠杆菌DH5α感受态细胞中,并加入LB液体培养基750 μL,于37 ℃ 150 r/min摇床中培养1.5 h,取出至4 ℃离心机上以5 000 r/min离心5 min,弃去上清,留菌液200 μL,将菌液与沉淀混合后均匀涂布于含氨苄的 LB 固体培养基中,37 ℃培养12 h,以单个菌落纯培养后的菌液为模板进行PCR检测并提取菌液质粒进行双酶切鉴定。双酶切体系 20 μL:NotI 1 μL,EcoRV 1 μL,BSA 2 μL,10xH 2 μL,重组质粒cDNA 10 μL,ddH2O 4 μL。双酶切条件:37 ℃ 4~8 h。经菌液PCR和双酶切技术鉴定为阳性的重组质粒送北京六合华大基因科技有限公司测序。
1.2.5遗传进化分析:采用NCBI网站的 BLAST与DNAStar软件包中的MegAlign比对测序所得TTP基因与GenBank中公布的野猪、羊驼、单峰骆驼等不同种源TTP基因的核苷酸序列和氨基酸序列,并构建系统进化树。参考序列见表1。

表1 参考序列信息
2 结果与分析
2.1PCR扩增结果对反转录合成的苏太猪血液cDNA进行TTP基因PCR扩增,经1.0%琼脂糖凝胶电泳检测,结果显示在约981 bp处出现特异性条带(见图1),与预期扩增片段大小相符合。

图1 苏太猪源TTP基因PCR扩增结果M:2 000 DNA Marker;1~3:TTP扩增片段;4:阴性对照
2.2 克隆结果将PCR产物胶回收后,与pMD-19T载体连接,转化至大肠杆菌DH5α感受态细胞,以单个菌落纯化后的菌液为模板进行PCR扩增,并对重组质粒进行双酶切鉴定,结果分别见图2、图3。由图2可见,菌液PCR获得大小约981 bp的特异性条带,与预期扩增条带大小相符。由图3可见,重组质粒酶切获得约2 692 bp的载体条带和981 bp的目的条带,可初步判断目的基因成功克隆至pMD-19T载体。
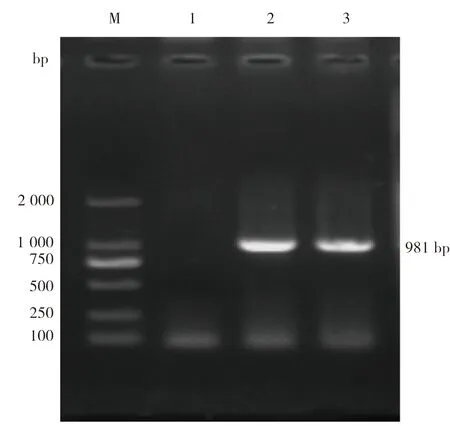
图2 苏太猪源TTP基因菌液PCR扩增结果M:2 000 DNA Marker;1:阴性菌液;2、3:阳性菌

图3 苏太猪源TTP基因双酶切鉴定结果M:2 000 DNA Marker;1、2:重组质粒
2.3TTP基因测序结果将阳性重组质粒送北京六合华大基因科技有限公司测序,结果可见:苏太猪源TTP基因CDS区长为981 bp,其碱基组成见表2,其中C碱基的含量最高为40.37%,A碱基的含量最低为15.49%。

表2 TTP基因核苷酸序列分析
2.4 遗传进化分析
2.4.1苏太猪源TTP基因的同源性分析:将克隆后的苏太猪源TTP基因核苷酸序列与GenBank中预测公布的13株不同种源的TTP基因利用DNAStar软件包中MegAlign进行同源性比对。由图4可见,苏太猪源TTP基因核苷酸序列与野猪源TTP基因的同源性最高(99.8%),仅有0.2%的变异度;其次是与羊驼TTP基因的核苷酸序列具有较高的一致性(92.8%);与非洲巨颊囊鼠的核苷酸同源性最低(84.8%)。由图5可见,苏太猪源TTP基因氨基酸序列与参考序列野猪源氨基酸同源性完全一致,与小家鼠的氨基酸同源性最低(88.7%)。
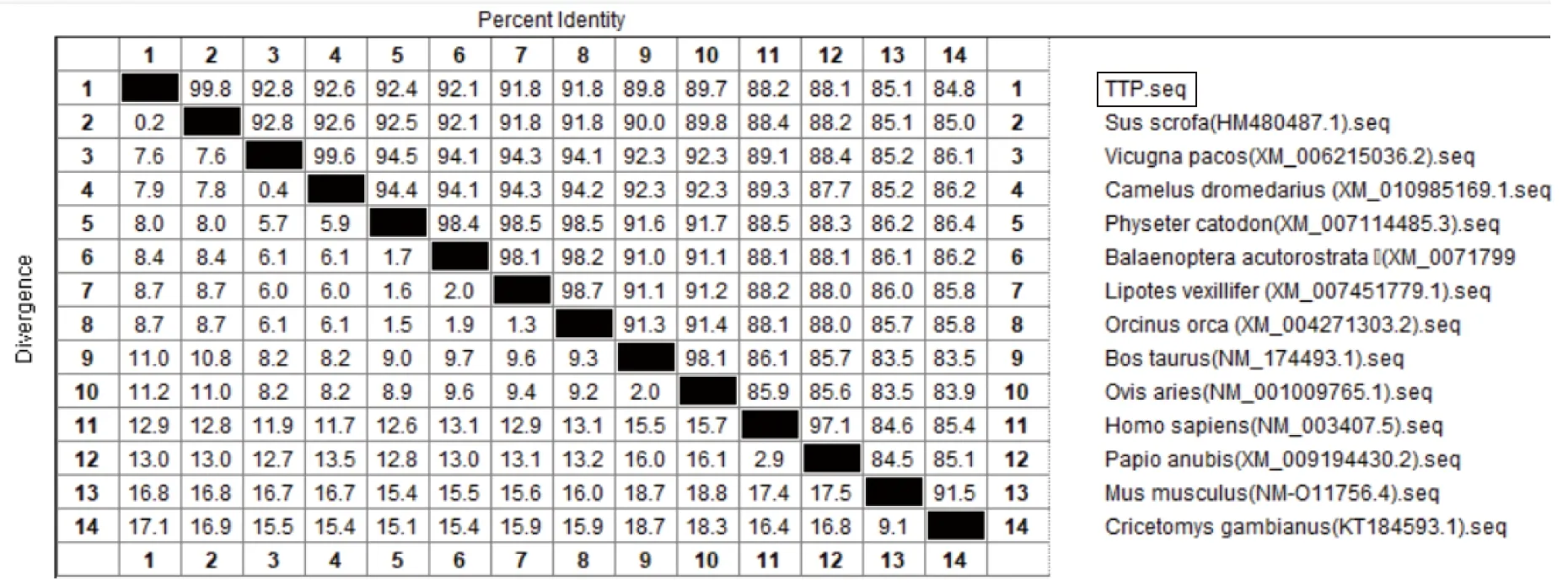
图4 不同种源TTP基因核苷酸序列的同源性比对

图5 不同种源TTP基因氨基酸序列的同源性比对
2.4.2系统进化树分析:利用DNAStar程序包中MegAlign软件构建不同种源TTP基因核苷酸序列和氨基酸序列的系统进化树。由图6、图7可见,苏太猪源TTP基因与参考序列野猪源(HM480487.1)TTP基因在遗传进化树上处于同一小分支,亲缘关系最近;与牛、绵羊的亲缘关系次之;与白鱀豚、虎鲸的亲缘关系最远。

图6 苏太猪源TTP基因核苷酸系统进化树分析

图7 苏太猪源TTP基因氨基酸系统进化树分析
3 结论
本试验研究表明,苏太猪源TTP基因CDS全长981 bp,共编码 326个氨基酸,C碱基含量最高(40.37%),A碱基含量最低(15.49%)。同源性比较发现,苏太猪源TTP基因核苷酸序列和氨基酸序列与野猪源(HM480487.1)TTP基因具有非常高的一致性。系统进化树显示,本次扩增的苏太猪源TTP基因与野猪源(HM480487.1)TTP基因在遗传进化树上处于同一小分支,亲缘关系最近,与白鱀豚、虎鲸的亲缘化关系最远。同源性分析结果与系统进化树分析结果一致,表明TTP基因在同种属之间具有高度保守性。本试验首次对苏太猪源TTP基因的CDS区进行了克隆,并对该基因进行了遗传进化分析,为进一步了解苏太猪源TTP基因的生物学特性和功能奠定了理论基础。
