尼拉帕利维持治疗在铂敏感复发性卵巢癌中的疗效和安全性研究
——ENGOT-OV16/NOVA研究解读
2019-10-22莫淼,李俊,朱笕青
多聚(ADP-核糖)聚合酶[poly(ADP-ribose)polymerase,PARP]抑制剂作为第一个靶向DNA损伤修复反应的抗肿瘤药物,具有划时代的意义。PARP抑制剂主要干扰肿瘤细胞的DNA单链修复。对于肿瘤细胞存在同源重组缺陷(homologous recombination deficiency,HRD)的患者,即肿瘤细胞存在DNA双链断裂修复缺陷的患者,使用PARP抑制剂治疗时,则会导致肿瘤细胞DNA单链断裂和双链断裂均无法修复,即“合成致死”效应,从而杀伤肿瘤细胞。
目前,获得美国食品药品管理局(Food and Drug Administration,FDA)批准用于铂敏感复发性(platinum-sensitive relapsed,PSR)卵巢癌维持治疗的PARP抑制剂包括尼拉帕利、奥拉帕利和卢卡帕利。其中,奥拉帕利的Ⅱ期临床试验Study19通过分析发现奥拉帕利用于在乳腺癌易感基因(breast cancer susceptibility gene,BRCA)突变患者中获益更大,随后其Ⅲ期临床试验SOLO2研究只纳入了胚系BRCA(germlineBRCA,gBRCA)突变患者。根据大样本的流行病学研究结果,gBRCA突变在西方国家高级别浆液性卵巢癌患者人群中仅约占15%[1],而在中国人群中,卵巢癌患者gBRCA突变率为16.7%~28.5%[2-3]。剩余超过70%的患者能否从PARP抑制剂中获益?这是临床上十分关心的问题。
尼拉帕利(niraparib)作为另外一种PARP抑制剂,其Ⅲ期临床试验NOVA研究采用“稳中求进”的策略,在不限定患者BRCA突变状态的情况下进行了精心设计。研究根据BRCA的突变状态及HRD状态设置了3个队列,分别是gBRCA突变人群、HRD阳性[非gBRCA(non-gBRCA)]人群、以及non-gBRCA突变总人群(包含HRD阳性人群)的队列。研究结果显示,gBRCA突变、HRD阳性(non-gBRCA)、non-gBRCA突变总人群患者,均可从尼拉帕利治疗中获益,这些结果均为1类证据。同时,探索性分析表明,HRD阴性患者同样能从尼拉帕利维持治疗中获益。从风险比(HR)的数据可以看出,获益的大小依次为gBRCA突变人群>HRD阳性(non-gBRCA突变)人群>non-gBRCA突变总人群>HRD阴性人群。
最终,尼拉帕利凭借NOVA研究成为了第一个获美国FDA批准用于所有PSR卵巢癌患者维持治疗的PARP抑制剂,无需考虑BRCA突变状态。
本期分享的是2016年10月发表在《新英格兰医学杂志》(New England Journal of Medicine,NEJM)的ENGOT-OV16/NOVA研究[4]。该研究是由欧洲妇科肿瘤临床试验协作组和来自美国、加拿大、匈牙利的研究者共同完成的一项随机、双盲、安慰剂对照的Ⅲ期临床试验,旨在评估尼拉帕利(niraparib)维持治疗在铂敏感复发性(platinum-sensitive relapsed,PSR)卵巢癌患者中的疗效和安全性。
1 研究背景
在细胞的生命周期中,各种内源、外源性因素都可能导致细胞DNA损伤,尤其是肿瘤细胞在异常增殖分裂的过程中需要进行大量的DNA复制,更容易发生DNA损伤。理论上,DNA损伤可以通过DNA单链修复途径或DNA双链修复途径进行修复。多聚(ADP-核糖)聚合酶[poly(ADP-ribose)polymerase,PARP]是一类主要参与DNA单链修复的关键蛋白质,其中PARP-1蛋白还参与DNA双链修复以及复制叉修复。DNA双链修复更多的是依赖于非同源末端连接和同源重组修复两种方式。其中非同源末端连接能够迅速地修复双链断裂,但容易出错。同源重组修复是一种高保真、精确的修复方式,参与这条修复通路的基因非常多,如乳腺癌易感基因(breast cancer susceptibility gene,BRCA)1、BRCA2、RAD51、ATM等。同源重组修复通路上的部分基因发生胚系突变或者体细胞突变,则有可能导致同源重组缺陷(homologous recombination deficiency,HRD),同时也是多种肿瘤发病的遗传性危险因素。例如,携带有家族遗传性BRCA1或BRCA2突变的人发生恶性肿瘤的风险增高,尤其是乳腺癌和卵巢癌。
卵巢癌是致死性最高的妇科肿瘤。虽然晚期卵巢癌患者对铂类药物和紫杉醇联合化疗的初始反应率很高,但随着时间的推移,治疗的有效性会降低,70%的患者在3年内会复发[1]。尽管铂敏感复发患者可以继续用以铂类药物为基础的化疗方案治疗,但是铂类药物治疗的有效性逐渐下降,而毒性却逐渐升高。再次复发的间隔逐渐缩短,最终耐药而导致死亡。
2017年,在学校领导下成立了几十个社团,其中DIY创新科技社团是最受学生和老师关注的社团之一。其实在社团成立之前,学校就高度重视校园科技的发展了。在2016年和2017年连续两年里,学校都选派徐军副校长和王佐老师参加了全县的科技创新和辅导员培训。
PARP抑制剂的出现使得卵巢癌的药物治疗发生了革命性的变化,为患者带来了新的希望。尽管美国食品药品管理局(Food and Drug Administration,FDA)相继批准了尼拉帕利、奥拉帕利和卢卡帕利用于PSR卵巢癌患者的维持治疗,但是奥拉帕利的Ⅲ期临床试验仅证实了对于胚系BRCA(germlineBRCA,gBRCA)突变患者的获益。临床上BRCA突变患者仅占少数,大部分的non-gBRCA突变患者能否获益还需要开展大型的Ⅲ期临床试验进一步证实。所憾卢卡帕利的Ⅲ期临床试验入组的HRD阳性人群仅包含HRDLOH阳性的人群,而未纳入HRD-NtAI/HRDLST/HRD-LOH综合评分为HRD阳性的患者。
ENGOT-OV16/NOVA研究是新型PARP抑制剂尼拉帕利的首个Ⅲ期临床试验,该研究在一项临床试验中同时设计了3个确证性试验,分别回答尼拉帕利在gBRCA突变人群、HRD阳性[非gBRCA(non-gBRCA)]人群以及non-gBRCA总体人群的临床获益情况。早期临床研究[5]证实了尼拉帕利对卵巢癌患者具有疗效,phase 1爬坡试验提示300 mg/d是具有较好疗效和较低毒性的安全剂量。因此,NOVA研究采用该剂量作为试验组维持治疗的标准。
2 研究方法
2.1 设计概况
研究拟入组既往经过至少两轮含铂类药物标准化疗且在最后一轮化疗后获得完全缓解(complete response,CR)或部分缓解(partial response,PR)的卵巢癌患者,根据是否携带有BRCA基因胚系突变,先将患者分为2个队列,即gBRCA队列和non-gBRCA队列。符合条件的患者分别按照2∶1的比例随机分配接受尼拉帕利或安慰剂维持治疗,试验组患者接受300 mg/d的尼拉帕利治疗,对照组患者接受等量安慰剂。每个队列内分别根据倒数第二轮铂类药物化疗后至进展时长(6~12个月vs≥12个月)、倒数第二或最后一轮铂类药物化疗是否同时使用贝伐单抗(是vs否)、最后一轮铂类药物化疗的最佳疗效(CRvsPR)三个因素进行分层随机。研究的主要终点为无进展生存期(progression-free survival,PFS)。
2.2 研究方案重大修正
研究方案先后经历6次修正,在2014年底的第4次修正时,研究者考虑到如果尼拉帕利在non-gBRCA队列总体为阴性结果,是否可以在其中找到一种能反映DNA修复状态的生物标志物用于尼拉帕利的疗效预测(图1)。于是研究者决定增加测定患者的HRD状态,并在nongBRCA队列中设置hierarchical检验策略预设检验顺序,以确保在不调整α的情况下有足够的检验效能同时研究HRD阳性亚组和队列总体两个人群:先在HRD阳性亚组(包括源于体细胞的BRCA突变与HRD阳性/BRCA野生型患者)中检验试验组相比对照组的效果;如果该亚组结果差异有统计学意义,则进一步对non-gBRCA队列总体进行同样的统计学分析;否则无法对non-gBRCA队列总体进行统计学分析。
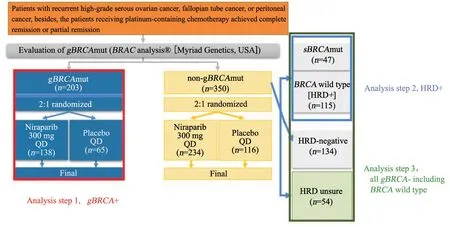
图1 研究主要目标与患者队列Fig.1 Primary objective of the study and patient cohorts
2.3 样本量估计
研究预设2个独立的队列相当于2项独立随机对照研究(randomized controlled trial,RCT),无需拆分α;其中第2个独立队列中又包含了2个子队列,因此样本量需要分别进行计算。
在gBRCA队列中,研究者预计尼拉帕利维持治疗可使患者中位PFS从4.8个月提升至9.6个月,即风险比(HR)为0.50。按照单侧α=0.025的检验水准、2∶1随机比例、24个月入组等条件,初始预计需要140个PFS事件数、180例患者以保证研究把握度达到95%以上。后经方案调整,预计需98个PFS事件数以保证研究把握度达到90%以上即可。
在non-gBRCA队列中,考虑到HRD阳性亚组与队列总体的hierarchical设计,需同时保证HRD阳性亚组和队列总体都有足够的样本量,预计符合该特征的患者占队列总体的40%。non-gBRCA队列总体按照gBRCA队列同样假设,需要140个PFS事件数、180例患者以保证研究把握度达到95%以上。在HRD阳性亚组中,同样假设也需要98个PFS事件数以保证亚组内统计检验把握度达到90%以上,有鉴于此,non-gBRCA队列拟在180例基础上增加130例,合计310例患者以保证研究期内HRD阳性亚组有足够的事件数发生,预计相应入组时间约20个月。
2.4 统计分析计划
根据调整后的设计,本研究实际上有3个研究队列:①gBRCA队列;② HRD阳性(nongBRCA)队列;③non-gBRCA总人群队列。每个队列分别针对主要研究终点PFS和次要研究终点总生存率(overall survival,OS)进行分层Kaplan-Meier分析和分层等比例风险回归(COX)分析;其中队列②与③必须按照预设的先后顺序进行统计学分析,只有当队列②主要结果为阳性时,才能针对队列③进行相应统计学分析。此外研究还预设了根据多个基线因素进行探索性亚组分析的计划。
3 结果
自2013年8月开始,研究最终入组553例卵巢癌患者,包括gBRCA队列203例和non-gBRCA队列350例(图2)。患者基线特征在两个治疗组间分布基本均衡(表1),大部分患者诊断时即为Ⅲ~Ⅳ期,gBRCA队列约一半的患者与non-gBRCA队列约1/3的患者已接受过三线及以上的化疗。疗效分析在gBRCA队列发生103例、HRD(non-gBRCA)阳性队列发生101例PFS事件时进行,此时non-gBRCA总人群列队共发生213例事件。
研究发现,在化疗间歇期使用尼拉帕利维持治疗与安慰剂相比,3个主要研究队列中均呈现出非常好的疗效(P<0.001,图3):在gBRCA突变患者中效果最好,疾病进展风险降低了73%,中位PFS延长了近4倍(21.0个月vs5.5 个月);在HRD阳性(non-gBRCA)患者中效果也较好,疾病进展风险降低62%,中位PFS延长了3倍多(12.9个月vs3.8个月);在non-gBRCA总人群患者中,疾病进展风险降低55%,中位PFS延长了2倍多(9.3个月vs3.9个月)。
探索性亚组分析结果显示(图4),三个队列中均不存在明显的亚组效应。除个别人数较少的亚组外,其余所有亚组都呈现出相似的结果:尼拉帕利疗效显著优于安慰剂对照。
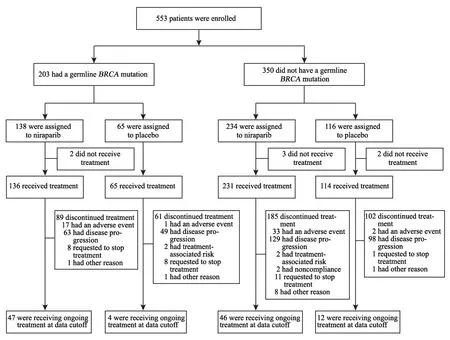
图2 患者入组和锁库时治疗情况Fig.2 Enrollment and outcomes
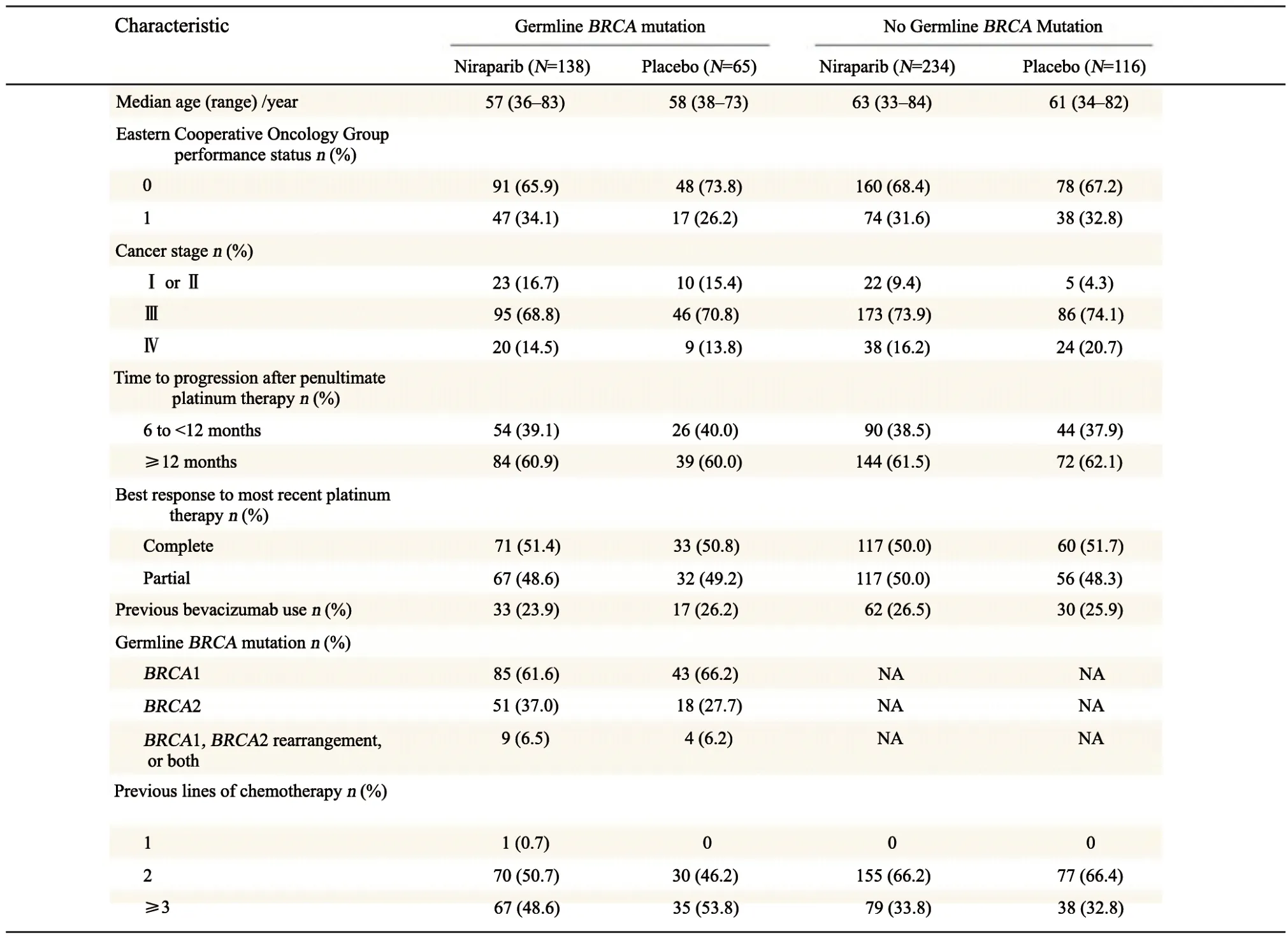
表1 患者基线特征Tab.1 Characteristics of the patients at baseline
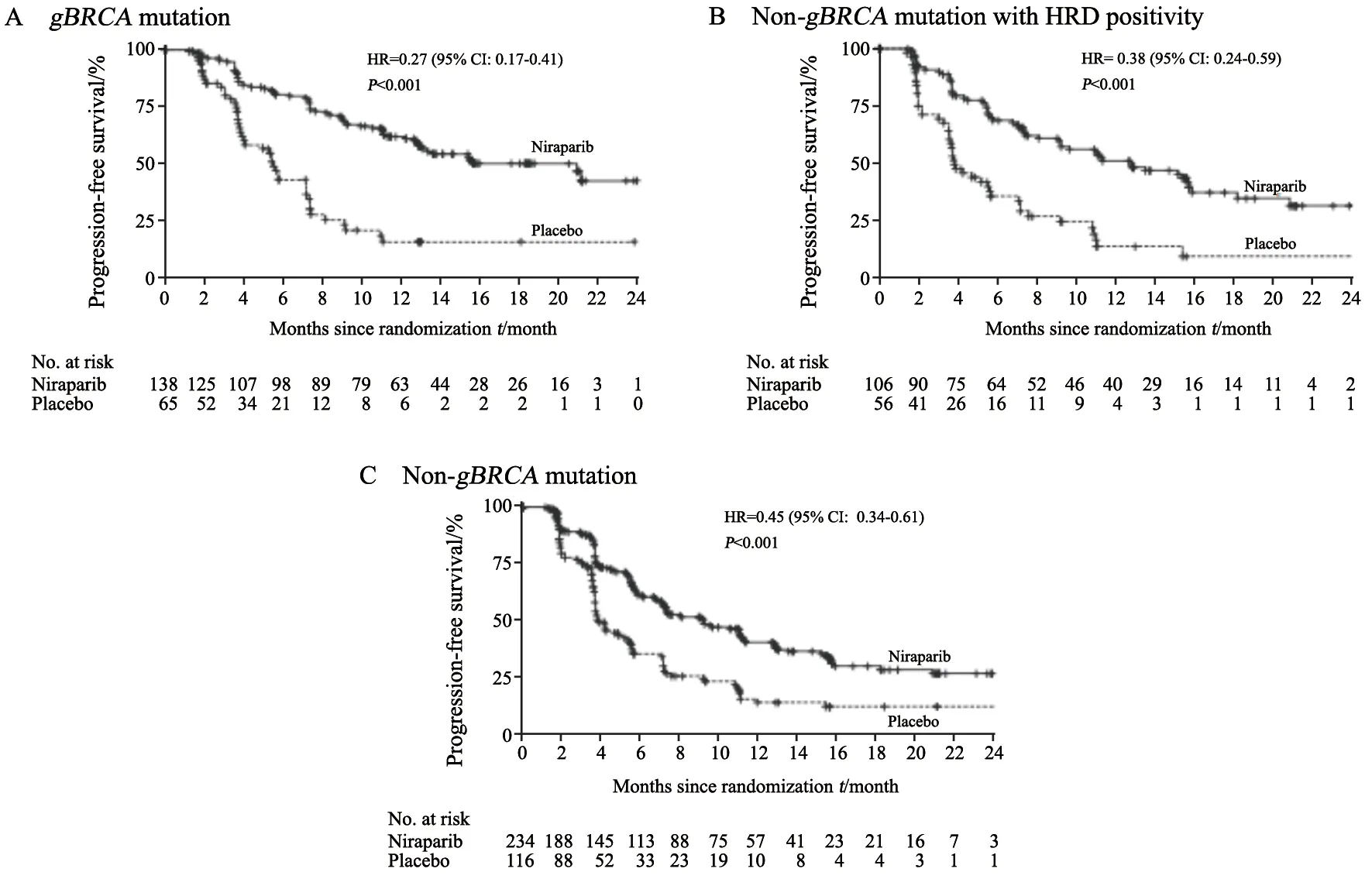
图3 三个研究人群中的主要研究终点PFS生存曲线Fig.3 Kaplan-Meier estimate of progression-free survival among three patient cohorts
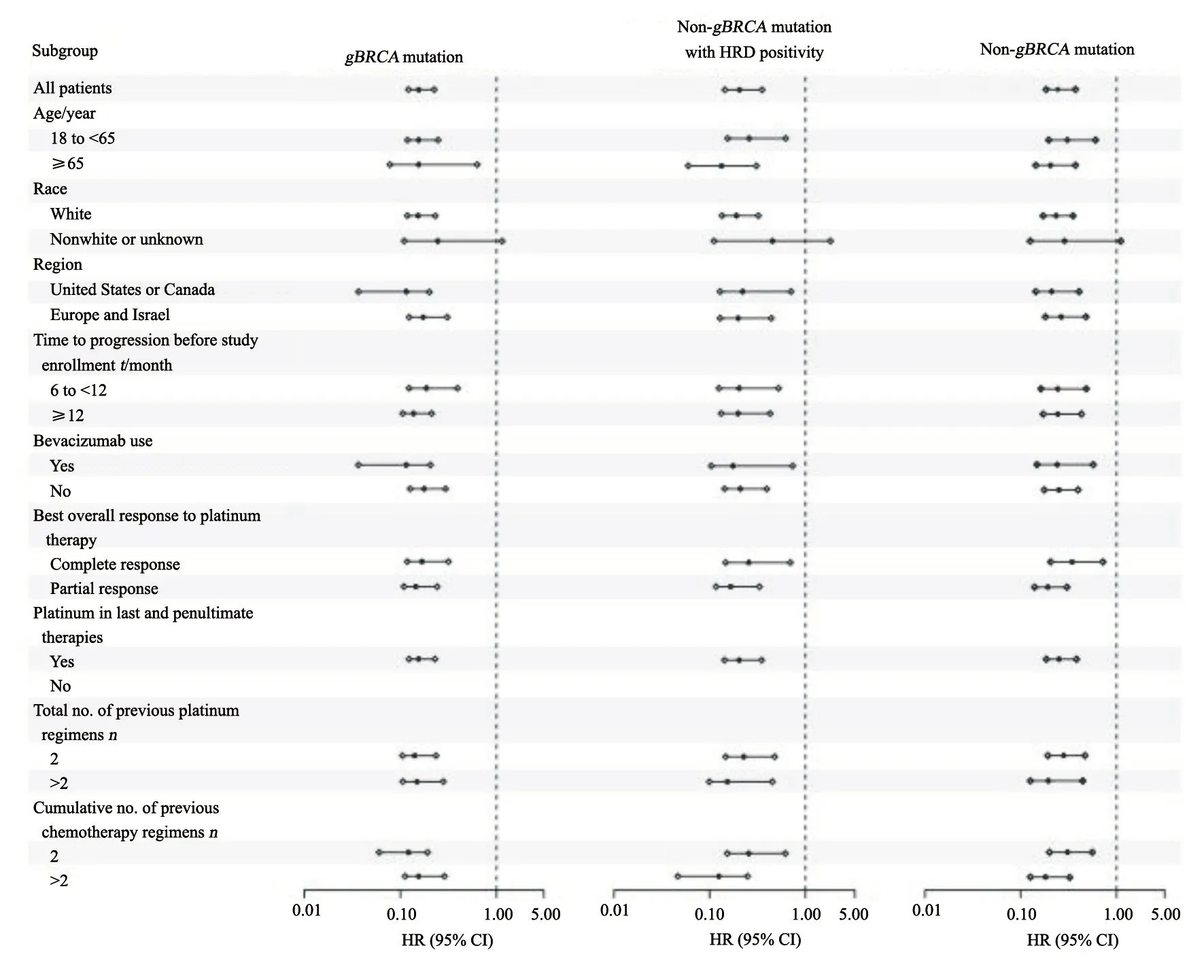
图4 三个研究人群中主要研究终点PFS探索性亚组分析结果Fig.4 Subgroup analysis of progression-free survival among three patient cohorts
所有队列中接受尼拉帕利治疗的患者共367例,最常见的3~4级不良反应是血小板减少(33.8%)、贫血(25.3%)、中性粒细胞减少(19.6%),这些不良反应通过调整用药剂量可得到缓解,且没有发现新的不良反应。
4 讨论与思考
4.1 研究结果充分回答尼拉帕利的获益人群
基于NOVA研究结果,尼拉帕利在2017年3月成为全球首个被FDA批准用于治疗PSR卵巢癌患者维持治疗的PARP抑制剂。2017年8月,FDA根据奥拉帕利的Ⅱ临床试验study19和Ⅲ期临床试验SOLO2批准其用于PSR患者的维持治疗。此后,卢卡帕利在2018年4月获得FDA批准用于PSR患者的维持治疗。
与奥拉帕利、卢卡帕利不同的是,尼拉帕利的Ⅲ期临床试验确证性证明了尼拉帕利不仅针对gBRCA突变患者,对于non-gBRCA突变的患者同样有效。此外,HRD阳性(non-gBRCA)人群的获益(HR=0.38,95% CI:0.24~0.59)接近于gBRCA突变人群的获益(HR=0.27,95% CI:0.17~0.41)。因此,FDA批准时不要求患者必须具有gBRCA突变,只要对铂类药物敏感即可。铂类药物也是作用于DNA结构,铂类敏感性一定程度上反映肿瘤细胞对DNA破坏类药物(如PARP抑制剂)的潜在敏感性。基于该研究结果,尼拉帕利维持治疗作为PSR卵巢癌的治疗策略很快被更新进美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南中。
4.2 NOVA研究设计的巧妙之处
该研究的突破性成果除药物本身的作用以外,还有一个很重要的原因是得益于多个共同主要研究人群的巧妙设计,使得在一项研究中能够同时回答三个研究假设,相比假如按三个独立研究分别开展,既省时省力,又大大节约了患者样本资源。在肿瘤精准诊疗年代,越来越多的临床研究,尤其是申办方发起的研究,希望在一项研究中同时解决多个问题,一方面节约资源,另一方面提高效率。在这类研究中,多重比较的来源一般包括多个主要研究终点指标(比如PFS、OS)、多个试验方案、多个主要研究人群[例如肿瘤标志物选择性亚组、意向性分析集(intention-to-treat,ITT)]以及多种比较类型(优效、非劣效)等。为了避免多重比较带来的假阳性率增加的问题,必须事先设计合适的策略保证整体研究α控制在0.05以内,通常包括α拆分、回收或本研究采用的hierarchical固定次序检验策略。因此,这类研究结果的解读需要注意结合其本身的设计特定来看,不能单纯以0.05作为判断阴性或阳性的标准。
Hierarchical固定次序检验是临床试验较为常用的一种控制一类错误α的策略。这种方法是通过事先将可能获益的人群或研究终点进行排序,然后按照排好的顺序逐一用α进行显著性检验,当前一个人群或研究终点无统计学意义时,则立即终止对后续人群或研究终点的统计学分析。这种方法的优点是相比于α拆分每一步可使用的α值大小不变,降低了由于拆分得到的α’较小造成假阴性的风险,同时有利于节约样本量。但是,采用这种方法需要对获益人群或研究终点的排序有较好的预判。
4.3 尼拉帕利用于卵巢癌一线维持治疗的研究进展
NOVA研究成功后,人们又开始关注尼拉帕利是否可以用在卵巢癌患者一线维持治疗中。SOLO1研究提示,PARP抑制剂奥拉帕利相比于安慰剂在具有BRCA突变(包括胚系突变和体细胞突变)的卵巢癌患者一线维持治疗中PFS有显著获益[6-8]。那么尼拉帕利是否也能用于初治卵巢癌患者一线维持治疗?一项ENGOT-OV26/PRIMA研究(NCT02655016)即是评估尼拉帕利在初治的、经过含铂药物化疗后取得CR或PR的国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)Ⅲ~Ⅳ期高级别浆液性或内膜样卵巢癌、原发性腹膜癌中的疗效和安全性。ENGOT-OV26/PRIMA研究的入组人群不局限于BRCA突变患者,故其入组人群较SOLO1的入组人群更广(SOLO1研究限于BRCA突变患者)。根据英国葛兰素史克公司最新公布的消息,PRIMA研究已取得阳性结果,无论肿瘤标志物状态如何,PFS均有获益(具体数据将在ESMO 2019大会公布)。
此外,如何进一步提高PARP抑制剂的疗效也成为了研究的热点。目前,国内外有多项临床试验正在探索PARP抑制剂联合抗血管生成抑制剂、PD-1抗体等用于卵巢癌的治疗和维持治疗,期待更好的研究成果能为卵巢癌患者带来更多福音。
