CAR-T治疗B细胞淋巴瘤不良反应的Meta分析
2019-10-22张锡友李丹丹董倩倩宋清坤钟晓松李文斌
康 勋 ,张锡友,陈 峰,李丹丹,董倩倩,宋清坤,钟晓松,李文斌
1.首都医科大学附属北京天坛医院神经肿瘤综合治疗病区,北京 100050;2.首都医科大学附属北京世纪坛医院脑胶质瘤科,北京 100038
淋巴瘤是一组起源于淋巴结和淋巴组织的恶性肿瘤,按组织病理学改变,淋巴瘤分为霍奇金淋巴瘤(Hodgkin lymphoma,HL)和非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)两大类。绝大多数NHL是B细胞淋巴瘤,其中以弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)最为常见。B细胞淋巴瘤的治疗已取得很大进步,逐步形成以化疗、放疗、自体干细胞移植(autologous stem cell transplantation,ASCT)等多种治疗为核心的综合治疗模式。但是,对于多次复发、难治性B细胞淋巴瘤患者,常规治疗方案难以奏效,研究新的治疗技术改善预后迫在眉睫。近年来,嵌合抗原受体T细胞(chimeric antigen receptor T-cell,CAR-T)技术在B细胞淋巴瘤中的突破,为复发、难治性B细胞淋巴瘤患者带来了新的希望。在已有报道的治疗B细胞淋巴瘤的临床试验中,CAR-T取得了非常显著的疗效。但是,如同其他肿瘤治疗措施,CAR-T治疗过程中的不良反应是不可忽视的,其中以细胞因子释放综合征(cytokine release syndrome,CRS)和神经毒性尤为突出。CRS是指输注CAR-T后,大量细胞因子释放,诱导组织损伤,表现为一种包括发热、心动过速、低血压等急性症状的综合征[1],亦称细胞因子风暴(cytokine storm)。在CAR-T治疗B细胞淋巴瘤的研究中,部分患者出现神经毒性,包括意识模糊、震颤、共济失调、失语、昏睡和癫痫发作等[2]。本研究通过Meta分析的方法,探讨CAR-T治疗B细胞淋巴瘤的过程中,CRS和神经毒性等不良反应的发生率,旨在为更加合理、安全地应用CAR-T提供理论依据。
1 资料和方法
1.1 文献检索
全面检索PubMed数据库和Cochrane Library数据库的英文文献,检索日期从建库至2018年1月止,采用主题词和自由词结合的检索方法,使用的检索字符串包括:①lymphoma、lymphomas、lymphoma、malignant、lymphomas、malignant、malignant lymphoma、malignant lymphomas;② CAR、CAR-T、CAR-T cell、CAR-T cells、chimeric antigen receptor、chimeric antigen receptor T-cell、chimeric antigen receptor T-cells、chimeric antigen receptor-modified T-cell、chimeric antigen receptor-modified T-cells、chimeric antigen receptor-transduced T-cell、chimeric antigen receptor-transduced T-cells。并且对检索出的文献的参考文献进行二次检索,保证全面获取数据。
1.2 文献纳入标准
文献纳入标准:①国内外公开发表的关于CAR-T治疗B细胞淋巴瘤的研究;② 研究对象为B细胞淋巴瘤患者;③提供患者总数、CRS发生例数或神经毒性发生例数等Meta分析必要的信息;④ 文献语言限定为英文。
1.3 文献排除标准
文献排除标准:①所有不符合纳入标准的文献;② 原始数据不完整,或前后不一致;③重复发表的研究;④ 完全没有提供诸如患者总数、CRS发生例数、神经毒性发生例数等Meta分析必要信息的文献;⑤ 综述、个案报道和动物实验;⑥ 低质量文献或严重偏倚的文献。
1.4 数据提取
由两名研究员根据文献的纳入标准和排除标准筛选所需的文献,对符合要求的文献进行质量评价并从中提取数据,包含文献作者、出版时间、患者总数、病理类型、目标抗原、不良反应发生例数等信息,整理数据并汇总。
1.5 结局指标
发生率(incidence rate)为发生例数占患者总数的百分比。
1.6 统计学处理
所有的数据处理均使用Stata 12.0软件完成。按照不同的不良反应(CRS和神经毒性),采用Meta分析汇总反应率[3]。异质性分析使用I2检验和Q检验两种方法,当I2<50%,且Q检验P>0.1时,可认为不存在异质性,采用固定效应模型进行分析,反之则存在异质性,选用随机效应模型进行合并分析。分别采取随机效应模型和固定效应模型对各因素进行合并,进行敏感性分析,若两项结果间未见明显差异,提示结果稳定。分别应用Begg法和Egger法检测文献的发表偏倚,Begg法P>0.05,Egger法P>0.05,提示无发表偏倚。
2 结果
2.1 文献的基本特征
初步检索出文献248篇,根据纳入标准和排除标准,最终纳入10篇文献,均为高质量研究,文献筛选流程图见图1。所有入选文献情况见表1。
2.2 Meta分析结果
2.2.1 CRS的总发生率
10项研究[4-13]记录了CAR-T治疗B细胞淋巴瘤过程中CRS的发生率,文献之间存在异质性(I2=99.1%,P=0.000),采用随机效应模型分析,结果显示,总发生率为57%(95% CI:0.25~0.90),提示CAR-T治疗过程中出现CRS的可能性较大(图2)。
2.2.2 神经毒性的总发生率
6项研究[5,8,10-13]记录了CAR-T治疗B细胞淋巴瘤过程中神经毒性的发生率,文献之间存在异质性(I2=81.8%,P=0.000),采用随机效应模型分析,结果显示,总发生率为48%(95% CI:0.30~0.66),提示CAR-T治疗过程中出现神经毒性的可能性亦较大(图3)。
图1 文献筛选流程图Fig.1 Process of literature screening
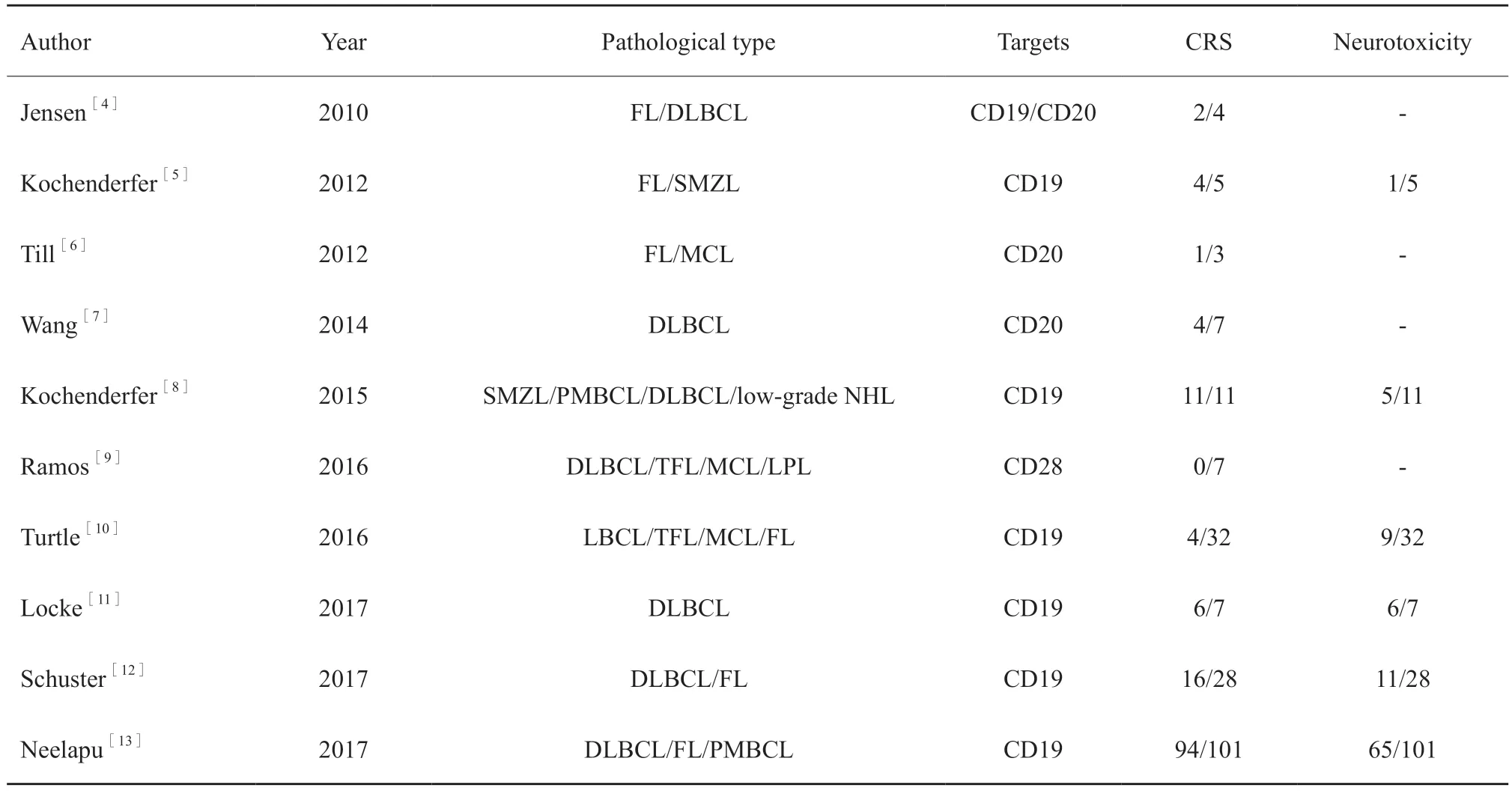
表1 所有入选文献情况Tab.1 Basic characteristics of the literature
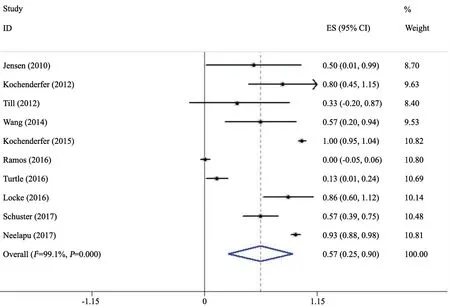
图2 CRS总发生率的Meta分析结果Fig.2 Meta-analysis of the total incidence rate of CRS
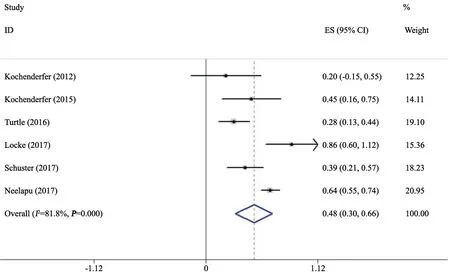
图3 神经毒性总发生率的Meta分析结果Fig.3 Meta-analysis of the total incidence rate of neurological toxicity
现将上述2组Meta分析结果汇总如下(表2)。
2.3 敏感性分析
采取随机效应模型和固定效应模型对发生率分别进行合并,具体结果见表3。其中CRS组的两项结果间存在较大差异,神经毒性组的两项结果间未见明显差异,提示CRS组的合并结果不稳定,神经毒性组的合并结果基本稳定。
2.4 发表偏倚
分别应用Begg法和Egger法检测文献的发表偏倚(表2),结果显示Begg法和Egger法P值均大于0.05,提示两组Meta分析无发表偏倚存在。
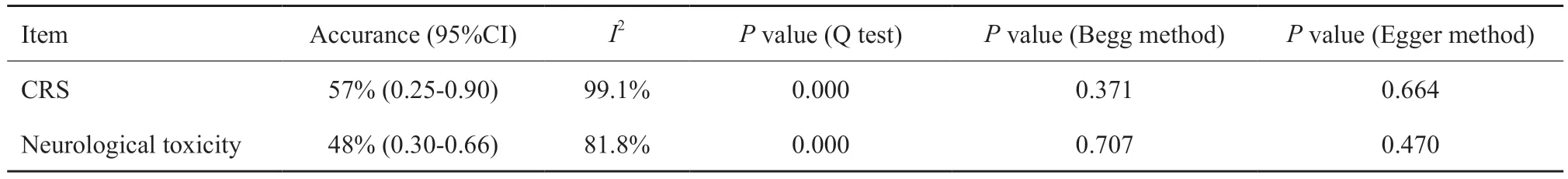
表2 Meta分析结果汇总Tab.2 Summary of Meta-analysis

表3 敏感性分析Tab.3 Analysis of the sensitivity
3 讨 论
淋巴瘤临床表现具有多样性,可发生在身体的任何部位,发病率有逐年增多的趋势。据报道在2016年美国DLBCL新增27 650例,约占成熟B细胞淋巴瘤的26%,其次较为常见的依次为滤泡性淋巴瘤(follicular lymphoma,FL)、边缘区淋巴瘤(marginal zone lymphoma,MZL)和套细胞淋巴瘤(mantle cell lymphoma,MCL),约占成熟B细胞淋巴瘤的13%、7%和3%[14]。在以化疗、放疗、ASCT等多种治疗为核心的综合治疗模式下,某些B细胞淋巴瘤亚型已有治愈的可能。以DLBCL为例,DLBCL的一线治疗方案是以蒽环类药物为基础的化疗方案,如经典的R-CHOP方案(利妥昔单抗、环磷酰胺、多柔比星、长春新碱、泼尼松),疗效是显著的。但是,对于某些DLBCL患者,常规治疗方案难以奏效,对R-CHOP方案无应答,称为原发难治性DLBCL。此外,对一线治疗敏感的DLBCL患者中,约40%在5年内会复发[15]。对于这两类DLBCL患者,标准的二线治疗方案是补救性化疗+ASCT[16-17],但是据报道二线治疗仅对23%~29%的原发难治性DLBCL起作用[18],其中位无进展生存期仅3个月[19]。经二线治疗再次复发的患者,其中位总生存期仅10个月[20-21]。因此,对于复发、难治性B细胞淋巴瘤患者,研究新的治疗技术和改善预后迫在眉睫。
嵌合抗原受体(chimeric antigen receptor,CAR)是一种人工融合蛋白,由3个部分组成,包括细胞内的信号转导区域、跨膜区域和细胞外的抗原结合区域,表面嵌合CAR蛋白的T细胞即为CAR-T[22]。CAR的分子机制,与其特殊的分子结构密切相关。CAR的抗原结合区域本质上是抗体单链可变区(single chain fragment variable,scFv),可以特异性地识别肿瘤相关抗原(tumor associated antigen,TAA)。当CAR的细胞外抗体结构特异性地识别TAA后,CAR将活化T细胞的信号通过跨膜区域传递至细胞内,通过一系列信号转导,引起T细胞的活化和增殖。CAR-T通过两种途径杀死肿瘤细胞,一是释放穿孔素/颗粒酶等细胞毒素介导靶细胞凋亡,二是表达介导细胞凋亡的细胞因子FasL,同时分泌TNF-α等效应分子,进一步诱导靶细胞凋亡[23]。CD19的表达几乎贯穿于整个B细胞发育的过程,因此CD19成为CAR-T治疗B细胞淋巴瘤的理想靶点,靶向CD19的CAR-T是临床上应用最广、研究最全面的过继性细胞免疫治疗方法[24]。除CD19外,CD20[4]、CD22[25]、κ轻链[9]、ROR1[26]也是具有一定潜力的靶点。
近年来,多家临床中心进行了CAR-T的临床试验,在治疗B细胞淋巴瘤中取得了令人印象深刻的成效。CAR-T技术虽然已经在B细胞淋巴瘤中显示出巨大的潜力,其不良反应仍是一个不可忽视的问题,严重的不良反应是限制CAR-T疗效的最大障碍。CAR-T治疗过程中常见的问题包括CRS、神经毒性、肿瘤溶解综合征及脱靶效应等。
①CRS:输注CAR-T后T细胞、B细胞、NK细胞及单核-巨噬细胞释放大量细胞因子,诱导组织损伤,出现包括发热、心动过速、低血压等症状的综合征,即CRS,是CAR-T治疗过程中最常见的急性不良反应。除上述症状外,CRS还包括乏力、恶心、头痛、胸闷、呼吸困难、腹泻、皮疹、谵妄等症状,实验室检查可发现肝酶升高、肌酐升高、急性肾衰竭,超声心动图还可发现心脏射血分数降低[27]。CRS的严重程度与CAR-T输注量、血中CAR-T数量峰值、血清细胞因子水平(包括IFN-γ、TNF-α、IL-6等)及C反应蛋白水平有关[5,8,10]。Turtle等[10]报道的一项抗CD19的CAR-T治疗淋巴瘤的试验中,12.5%的患者存在严重的CRS,需要进入重症监护病房并服用免疫抑制类药物。Kochenderfer等[2]报道的另一项抗CD19的CAR-T治疗淋巴瘤的试验中,部分患者亦存在严重的CRS,13.6%的患者需要应用升压类药物,9%的患者需要机械通气辅助呼吸。② 神经毒性:严重CRS患者可出现可逆性神经系统综合征,包括意识模糊、震颤、共济失调、失语、昏睡和癫痫发作等症状。神经毒性的发病机制不明,神经毒性可以与CRS同时存在,亦可以单独存在,提示两者的病理生理学机制并不完全相同[11],此外,中枢神经系统组织并不表达CD19等TAA,无法单纯用脱靶效应解释其原因[8,28]。Kochenderfer等[29]认为严重的神经毒性可能与CAR-T治疗前未进行预处理有关,Turtle等[30]认为严重的神经毒性可能与IL-6浓度有关。与CRS相似,神经毒性的严重程度与CAR-T输注量、血液中CAR-T数量峰值、血清细胞因子水平(包括IL-2、IL-6、IL-10、IL-15、IL-18、IFN-γ等)以及C反应蛋白、铁蛋白、TIM-3和颗粒酶B水平有关[2,10]。③肿瘤溶解综合征(tumor lysis syndrome,TLS):TLS指肿瘤细胞大量溶解破坏,细胞内物质快速释放,超过了肝脏代谢和肾脏排泄的能力,使代谢产物蓄积而引起高尿酸血症、高钾血症、高磷血症等代谢紊乱,进而导致严重的心律失常或急性肾功能衰竭。输注CAR-T后的几周内应给予相应措施预防TLS。④ 脱靶效应:CAR-T与正常组织表达的TAA结合后对正常组织产生的毒性即为脱靶效应,例如B细胞发育不全便是抗CD19的CAR-T治疗的一种脱靶毒性,B细胞发育不全可引起长期的低γ球蛋白血症,增加机会性感染的概率[31-32]。
CRS和神经毒性是CAR-T治疗常见的两种不良反应,多数文献均报道了上述两种不良反应的发生例数,因此本文选择CRS和神经毒性的发生率进行Meta分析。本Meta分析结果显示,CAR-T治疗B细胞淋巴瘤的过程中CRS的发生率为57%,神经毒性的发生率为48%,提示CAR-T治疗B细胞淋巴瘤的过程中CRS和神经毒性均有较高的发生率,应该予以重视。但是,本研究存在一定的局限性:①由于CAR-T是一种新兴的治疗手段,开展时间较短,缺乏大规模研究的数据,进行Meta分析的样本量过少。② 可能存在未公开发表的阴性结果文章。③目前未见关于CAR-T疗效的随机对照试验(randomized controlled trial,RCT),多数文献为病例数较少的临床前研究,研究中分组的随机性较小,无法保证变量的控制。④ 临床多关注3级以上的不良反应,鉴于部分文献没有对不良反应进行分级,本文未进行分级的研究。
研究表明,绝大多数CAR-T治疗相关的不良反应可在输注CAR-T的两周内消除,但是这些短期的不良反应可能相当严重,甚至是致命的,因此针对这些不良反应的治疗尤其重要。根据CRS的最新管理指南,CRS分为5个级别。1级一般以发热为主,无生命危险,对症处理即可。2级及以上级别均需不同的干预及支持治疗,例如抗IL-6受体抗体托珠单抗以及类固醇激素。Turtle等[10]报道应用托珠单抗已成功减轻了B细胞淋巴瘤患者中CRS的毒性,是治疗CRS首选药物,但是Kochenderfer等[8]报道已经出现部分对托珠单抗耐药的病例。类固醇激素可能导致CAR-T功能减弱、诱导凋亡,目前作为CRS的二线用药[33]。出现神经毒性的患者脑脊液中IL-6水平升高,托珠单抗无法通过血脑屏障,无法降低脑脊液中IL-6水平,而且阻断外周IL-6受体有令脑脊液中IL-6水平进一步升高的风险,因此托珠单抗并非神经毒性的一线用药[34]。Brudno等[33]发现类固醇激素可以通过血脑屏障,选择其作为治疗神经毒性的一线用药。此外,尚有研究发现可以将一种“自杀基因”导入CAR-T中,当出现CRS时可以启动“自杀基因”,降低CRS发生[35]。
针对B细胞淋巴瘤多种靶点的CAR-T,不少国家和地区的医疗机构已进行了大量的临床试验,在已有报道的治疗B细胞淋巴瘤的临床试验中CAR-T表现出卓著的疗效。相信在不久之后,CAR-T治疗必将在人类征服B细胞淋巴瘤的战斗中再建奇功。
