Cu-有机骨架对水中染料的吸附和光降解
2019-10-21管斌斌樊增禄
王 雅,李 庆,管斌斌,樊增禄
(1.西安工程大学 环境与化学工程学院,陕西 西安 710048;2.西安工程大学 纺织科学与工程学院,陕西 西安 710048)
0 引 言
作为我国的优势和重要民生产业,纺织工业在国民经济发展中居于重要地位[1]。但是,国务院下发的《第一次全国污染源普查方案》中,纺织工业已被列为重点污染行业。含染料的有色废水排入水体后会产生高色度,遮蔽太阳光并摧毁水生生态系统,而且染料结构复杂,稳定性高,无法自然降解[2-4]。作为全球第一纺织大国,研究如何解决染料废水导致的重大水污染问题意义重大。
目前,物理(如凝聚/絮凝、离子交换、膜分离、吸附/混凝等)、化学(如化学氧化、光催化等)和生物(如微生物/酶降解等)方法已被用于去除水中的染料(包括活性染料),但仍存在耗时、耗能、处理不彻底、工艺复杂及产生二次污染等问题[5-7]。光催化降解方法,因具有环境友好、操作简便、经济性高以及有效利用太阳光能的潜力,已成为水处理领域的研究热点之一[1,8]。金属氧化物、金属硫化物等作为常用的半导体光催化剂,普遍存在难以有效利用可见光,光电流量子产率低,易被光腐蚀产生二次污染,表面能高且易团聚等技术瓶颈,亟须突破[9-10]。金属-有机框架(Metal-Organic Frameworks,MOFs)材料是由金属离子/金属簇与有机配体通过配位自组装形成的新型固态多孔材料[11-13]。MOFs的多孔特征、高内部比表面积,催化活性位点(金属中心)的均匀分布性,光吸收能力(有机配体)的可调谐性,使其成为物理吸附和光催化降解有机污染物的不二之选[14-15]。更难得的是,其多样化的金属中心,众多可利用的有机配体以及组成的可调节性,MOFs对于可见光吸收的有效性远超无机半导体[14-15]。近年来,广大学者包括本课题组在MOFs捕获和光催化降解染料的领域已开展了大量研究工作,取得了积极有效的研究进展[1-3]。目前,该领域的研究热点集中在利用牢固金属节点的半导体特性及有机配体的光吸收和疏水特性,设计水稳定型的高可见光响应性MOFs基光催化剂[16]。其中,考虑到CuO是典型的p型半导体,基于Cu-O配位节点的Cu基MOFs在该领域的应用一直备受关注[16]。
本研究合成了一种基于Cu(II)金属中心和—NH2、—OCF3功能基团修饰的H2L有机配体的Cu-MOF,在单一及混合染料溶液中对染料分子进行了物理吸附和光催化降解,并探索了Cu-MOF对不同染料的吸附和光催化降解效能。
1 实 验
1.1 材料与仪器
(1) 试剂 硝酸铜(Cu(NO3)2·3H2O,分析纯,天津市福晨化学试剂厂);65%浓硝酸(HNO3)和N,N-二甲基甲酰胺(DMF)(均为分析纯,国药集团化学试剂有限公司);2,6-二(4-羧基苯)-4-(三氟甲氧基)苯胺(H2L,分析纯,济南恒化科技有限公司)。罗丹明B(C.I. Basic Violet 10,RhB,λmax=554 nm)、亚甲基蓝(C.I. Basic Blue 9,MB,λmax=664 nm)、阳离子艳红5GN(C.I. Basic Red 14,BR14,λmax=515 nm)、阳离子嫩黄7GL(C.I. Basic Yellow 24,BY24,λmax=420 nm)、甲基橙(MO,λmax=465 nm)、活性艳红K-2BP (C.I. Reactive Red 24,RR24,λmax=535 nm)、活性嫩黄K-6G(C.I. Reactive Yellow 2,RY2,λmax=430 nm),均为化学纯,上海万得化工有限公司提供。
(2) 仪器 BL-GHX-V型光催化反应器(西安比郎生物科技有限公司);UV-2450型紫外可见分光光度计(日本岛津公司);U3310型紫外可见分光光度计(日本日立公司)。
1.2 工艺流程
1.2.1 Cu-MOF的合成工艺 参照文献[2]的合成方法,将9.66 mg的Cu(NO3)2·3H2O和16.68 mg的H2L加入到25 mL的闪烁瓶中,加入按体积比5∶3混合的DMF(5 mL)和H2O(3 mL)溶液,待固体溶解后加入20 μL的65%的浓硝酸,混合均匀并封紧瓶盖,放置于鼓风干燥箱中,升温至75 ℃并保温72 h,之后逐渐降温至室温。在闪烁瓶底部有蓝绿色的长方体型结晶固体出现,收集产物并用DMF和蒸馏水反复洗涤,自然晾干后备用。
1.2.2 Cu-MOF对染料的吸附 将阳离子染料MB、BR14、BY24和阴离子染料MO固体粉末分别溶解于蒸馏水中,得到一系列单一的染料溶液;将MB+MO、MB+RhB、MB+RR24和MB+RY2混合染料的固体粉末分别溶解于蒸馏水中,得到一系列的混合染料溶液。将10 mg的Cu-MOF分别加入到一定体积和浓度的上述单一或混合染料溶液中,并借助紫外-可见(UV-Vis)分光光度计,监控待吸附染料在各自最大吸收波长处的吸光度值随时间的变化,借助浓度-吸光度标准曲线计算染料浓度的变化。Cu-MOF对各只染料的吸附速率常数通过Pseudo二阶吸附动力学模型进行评价。
1.2.3 Cu-MOF对染料的光化学降解 称取一定质量的MB、MO、MB+MO以及MB+RhB,并将它们分别溶解于一定体积的蒸馏水中,获得不同浓度单一/混合染料水溶液,备用。Cu-MOF对染料的光催化降解工艺流程为:取40 mL的MB、MO、MB+MO以及MB+RhB染料溶液,分别放置于石英玻璃管中,并加入10 mg的Cu-MOF,在磁力搅拌之下静置过夜,使待降解的染料与Cu-MOF之间达到吸附-解吸平衡。向各石英管底部泵入空气,并开启300 W氙灯对染料溶液持续进行照射。在一定光照时间间隔之后,取出一定体积的染料溶液,监测其最大吸收波长处的吸光度值随时间的变化。
1.2.4 染料溶液标准曲线的绘制 配置不同浓度的MB、BR14、BY24、MO、RhB、RR24和RY2染料水溶液,在UV-Vis分光光度计上分别测定每种染料在不同浓度下、最大吸收波长处的吸光度值。依据朗伯-比尔定律(Lambert-Beer Law),以染料吸光度值为纵坐标,对应的浓度为横坐标,绘制各只染料的浓度-吸光度标准曲线,并对标准曲线进行线性拟合得到线性方程。在染料吸附和光催化降解实验中,不同时间节点处各染料浓度的变化可通过测定的吸光度值和其标准曲线确定。
1.3 测试与表征
1.3.1 吸附动力学 文献[17]给出的吸附动力学方程为

(1)

(2)
式中:qt为吸附量随时间的变化;t为时间;qe为吸附平衡时的吸附量;k2为二阶吸附动力学常数。为了研究Cu-MOF吸附染料的二阶吸附动力学常数,应用式(1),(2),并利用Pseudo二阶吸附动力学模型处理Cu-MOF对染料的吸附量随时间变化的数据。当以时间t为横坐标,t/qt为纵坐标绘制曲线时,二阶吸附动力学常数k2=斜率2/截距。
1.3.2 染料降解效率的计算 将用来溶解待降解染料的蒸馏水作为参比溶液,分别测试光催化降解反应前后染料溶液,在最大吸收波长处的吸光度值,根据标准曲线确定出相应的染料浓度值,按式(3)计算水溶液中染料分子的降解效率ED[18]:

(3)
式中:ED为光照一定时间后染料的降解效率;C0为光降解反应前染料溶液的浓度;C为光降解反应后染料溶液的浓度。
1.3.3 光催化降解动力学测试 采用Apparent一级速率动力学评价Cu-MOF对MB、MO、MB+MO以及MB+RhB溶液中染料的光催化降解效率[3],如式(4)所示。
(4)
式中:C0和C分别是指各染料在t=0和t时刻的浓度;A0和A是各染料在t=0和t时刻的吸光度值;k是Apparent速率常数。
2 结果与讨论
2.1 Cu-MOF对单一染料的吸附
为了研究Cu-MOF对染料的吸附行为,将原始合成的Cu-MOF直接用来对小分子染料MB、BR14和BY24进行物理吸附。室温条件下,在6 mL,10.26 mg·L-1的MB、16.99 mg·L-1的BR14和13.31 mg·L-1的BY24水溶液中分别加入10 mg的Cu-MOF,吸附结果如图1,2所示。从图1不难发现,随着吸附时间的延长,染料溶液中MB、BR14和BR14在吸收波长664 nm,515 nm和420 nm处的吸光度值快速下降。同时,观察到染料水溶液的颜色相应地从深蓝色、红色和黄色逐渐变为几乎无色澄清。3种染料溶液经吸附40,180和60 min后,浓度分别降低为0.27,1.55和3.05 mg·L-1,对应的Cu-MOF对3种染料的吸附效率分别确定为97.37%,90.88%和77.85%。相应的吸附量随时间的变化趋势如图2所示。此外,考虑到对一种有效的吸附剂来说吸附速率是一个非常重要的评价参数,通过Pseudo二阶动力学模型对吸附数据的拟合,研究了Cu-MOF吸附MB、BR14和BY24的吸附动力学,结果如图3所示。MB、BR14和BY24被Cu-MOF吸附的二阶动力学常数k2分别被确定为8.06×10-3(R2=0.983),4.44×10-3(R2=0.989)和4.96×10-3g·mg-1min-1(R2=0.993)。由此可见,Cu-MOF可以对水溶液中的单一的染料分子进行有效的物理吸附去除。

(a) MB (b) BR14 (c) BY24图 1 吸光度随时间的变化Fig.1 Absorbance changes with time

(a) MB (b) BR14 (c) BY24图 2 吸附量随时间的变化Fig.2 Absorption amount changes with time
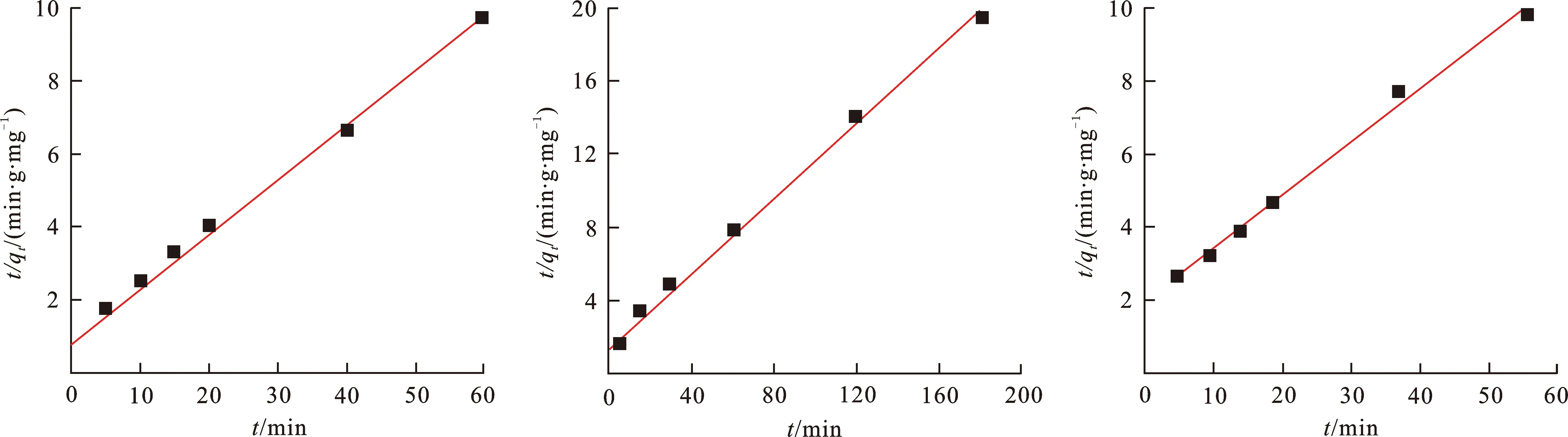
(a) MB (b) BR14 (c) BY24图 3 吸附动力学曲线Fig.3 Adsorption kinetic curve
2.2 Cu-MOF对混合染料的吸附
上述研究已经证实,在单染料体系下Cu-MOF可以有效去除水溶液中3种不同颜色的染料分子MB、BR14和BY24。从实际应用的角度出发,往往更加关注的是吸附剂能否在混合染料体系下达到同步或者选择性吸附目标染料分子的功能。因此,将MB与另外4种染料进行了混合,得到了MB+MO、MB+RhB、MB+RR24和MB+RY2双染料混合水溶液。分别采用10 mg的Cu-MOF对混合染料进行物理吸附,结果如图4所示。如图4(a),Cu-MOF可以在混合染料体系下同步吸附阳离子的MB(5.60 mg·L-1)和阴离子的MO(10.11 mg·L-1),但是对MB的吸附速率要明显快于MO,120 min之后对MO和MB的吸附去除效率分别为39.07%和92.5%。一方面可能是由于MO的分子尺寸略大于MB,导致Cu-MOF对MO的吸附能力弱于MB;另一方面,Cu-MOF骨架中有机单元部分强电负性基团—OCF3,很可能对阴离子性的MO进入Cu-MOF内部孔道起到了一定的阻碍作用。 由图2(b)可知,对于同为阳离子染料的MB(6.54 mg·L-1)和RhB(6.68 mg·L-1),180 min之后Cu-MOF的吸附使得2种染料在664 nm和554 nm处的吸光度值同步下降,吸附去除效率分别达到了99.66%和92.19%。由图4(c)可知,当将MB(3.10 mg·L-1)和RR24(14.42 mg·L-1)混合之后,Cu-MOF仍旧可以对二者进行有效的同步吸附,180 min之后的吸附效率分别达到了95.58%和66.57%。但是,当将MB与分子尺寸更大的RY2混合之后,Cu-MOF只能选择性的将线性的小分子MB进行有效去除,而RY2在430 nm处的吸光度值始终变化不大(如图4(d)),表明RY2染料分子由于Cu-MOF空腔/孔道的尺寸限制效应,无法被有效吸附去除。
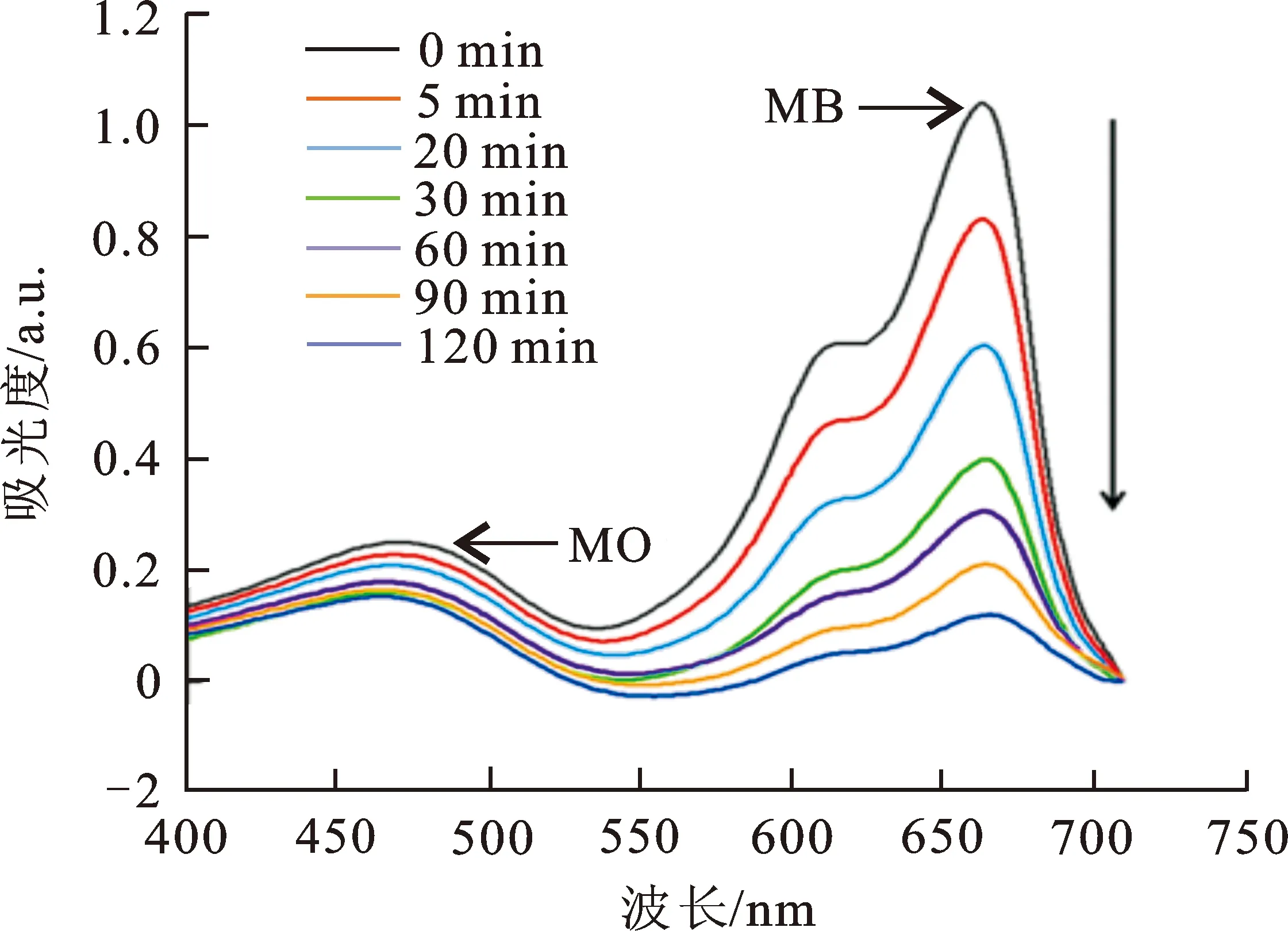
(a) MB+MO

(b) MB+RhB

(c) MB+RR24
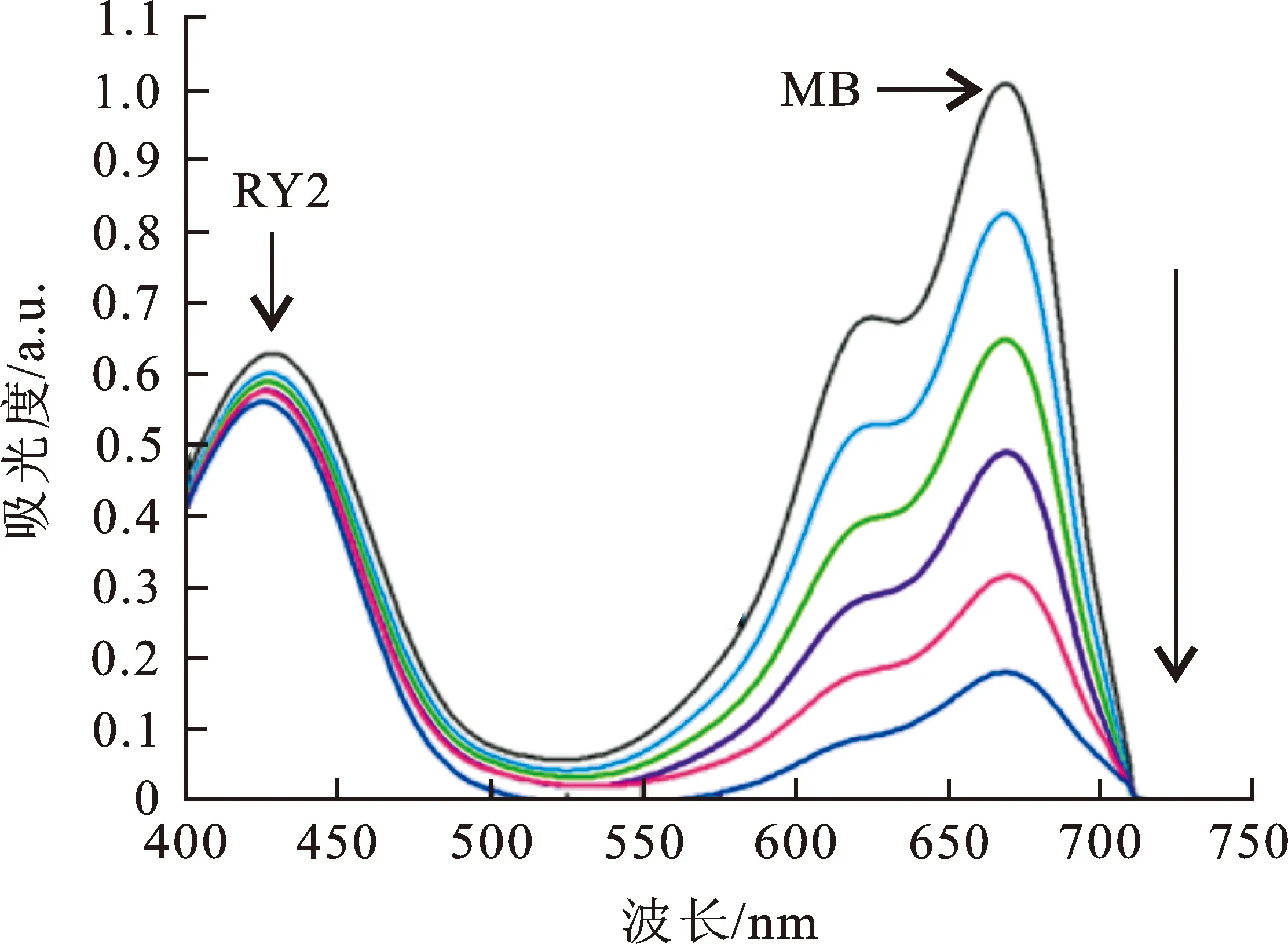
(c) MB+RY2图 4 混合染料吸附过程中各染料的吸光度随时间的变化
综上所述,Cu-MOF可以在180 min之内将单一或混合溶液中的染料分子进行快速吸附去除,这一吸附速率优于很多已经被报道的Cu金属基MOF对MB、MO、RhB等染料的吸附速率[18-19]。这种快速吸附能力很可能得益于Cu-MOF骨架上修饰的—NH2和—OCF3极性基团,易于与染料分子上丰富的极性基团之间形成分子间强氢键作用,增强了Cu-MOF对客体染料分子的捕获能力[1]。
2.3 Cu-MOF对染料的光催化降解
为了证实Cu-MOF对有机染料的光催化降解功能,采用300 W的氙灯模拟可见光照射染料溶液和光催化剂,验证Cu-MOF对单一和混合染料水溶液的光催化降解作用,结果如图5~7所示。为了确保Cu-MOF在被光照之前已经达到了对目标染料的吸附平衡,进行光催化实验之前,将Cu-MOF浸泡在40 mL染料的水溶液中进行搅拌过夜处理。如图5(a)所示,随着光照时间的延长,MB在664 nm处的吸光度值快速下降,180 min之后几乎彻底消失,浓度从10.5 mg·L-1降低到0.29 mg·L-1,相应的Cu-MOF对MB的光催化降解效率达到了97.2%。当光照时间延长至360 min之后,MB的浓度进一步下降到0.09 mg·L-1,此时的降解效率为99.2%(图6(a))。依据图7(a)的数据并经过计算,在整个光催化降解过程中,Cu-MOF对MB的光降解速率常数被确定为3.3×10-2min-1(R2=0.96),表明其作为可见光降解催化剂,对水溶液中的单一MB染料分子具有高效的光催化降解能力,实现了对水环境的修复。

(a) MB (b) MB+MO (c) MB+RhB图 6 光催化降解效率随时间的变化Fig.6 Photocatalytic degradation efficiency changes with time
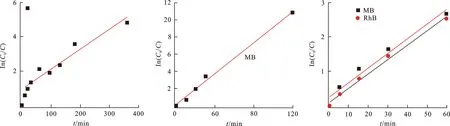
(a) MB (b) MB+MO (c) MB+RhB图 7 采用first order model动力学模型拟合的光催化降解动力学Fig.7 The photocatalytic degradation kinetic fiued by first order model kinetic model
然而,在现实情况下,受污染水体中往往含有多种染料,需要光催化剂能够同步清除水中的混合染料。为此,在接下来的研究中,将MB+MO和MB+RhB的双染料混合体系作为目标物,研究Cu-MOF的光催化降解清除效能。如图5(b),6(b),7(b)所示,随着光照时间的延长,MB和MO在664 nm和465 nm处的吸光度值均明显下降;相应的,120 min之后染料浓度分别从4.53和6.40 mg·L-1下降到了0.07和3.81 mg·L-1,对应的光催化降解效率分别为98.45%和40.47%。Cu-MOF对混合染料中MB的光催化降解速率达到了9.03×10-2min-1(R2=0.99),而对于MB的降解效率优于MO,很可能是由于MO染料分子的稳定性要高于MB。当将MB和RhB混合之后,从图5(c)的结果不难发现,随着光照时间逐渐延长至120 min,MB和RhB在664 nm和554 nm处的吸光度值同步下降,对应的染料浓度从6.54,6.68 mg·L-1分别降低到了0.45,0.53 mg·L-1;420 min之后染料浓度更是降低到了0.11,0.19 mg·L-1,相应的降解效率分别为98.32%和97.16%(图6(c))。同时,混合染料的颜色也从紫色变为了近乎无色。此时,Cu-MOF对MB+RhB混合染料中MB和RhB的降解速率分别达到了2.0×10-2min-1(R2=0.98)和2.1×10-2min-1(R2=0.99) (图7(c))。
综上所述,Cu-MOF不仅可以有效光降解清除水中的单一染料分子,而且可以同步光催化降解清除混合溶液中的染料分子。Cu-MOF的高效降解性能应归功于其骨架结构中高度共轭的有机配体H2L和均匀分布的Cu(II)金属中心,有利于在低能量的可见光照射下实现配体向金属中心的电荷转移(LMCT),提升光催化效能。此外,H2L配体上修饰的供电子—NH2基团和吸电子—OCF3基团更利于使MOF骨架在光照下实现电荷转移的激发态,将染料溶液中的H2O氧化,产生高氧化性的羟基自由基(·OH),进而分解染料分子[20]。
3 结 论
(1) Cu-MOF利用其多孔空腔,可以高效吸附去除单一染料溶液中的MB、BR14和BY24和双染料混合溶液中的MB+MO、MB+RhB、MB+RR24染料分子;在大分子活性染料RY2与小分子染料MB的混合体系中,Cu-MOF可以选择性捕获MB染料分子。
(2) 在由单一MB和MB+MO和MB+RhB组成的混合染料体系中,Cu-MOF对MB的光催化降解效率分别达到了99.2%,98.45%和98.32%,对MO和RhB的降解效率分别为40.47%和97.16%。原因是Cu-MOF骨架中H2L向Cu(II)金属中心的电荷转移(LMCT),以及—NH2和—OCF3对电荷转移的促进作用。
