槲皮素对大鼠全脑缺血/再灌注损伤的保护作用
2019-10-17雷晓鸣孟丽华蒋文军张珍妮
雷晓鸣,孟丽华,蒋文军,李 雪,张珍妮
(西安交通大学第二附属医院麻醉科,西安 710004;*通讯作者,E-mail:Jennyzzn@sohu.com)
I/R损伤发生在许多临床情况下,机制非常复杂,涉及氧化应激、炎症等许多因素,导致细胞的坏死或者凋亡[1]。氧化应激是I/R损伤的始动因素[2],有学者认为抗氧化剂需要同时具备多个作用靶点和容易穿过血脑屏障的特点,在I/R损伤的治疗中才有更好的临床前景[3]。槲皮素可以从蔬菜、水果中提取,抗氧化能力是其保护神经功能的基础,近年来研究发现其具有减轻局灶性脑I/R损伤的作用[4]。低血压、休克、心跳骤停等导致的全脑I/R损伤是导致患者进行性认知功能障碍、残疾甚至死亡的重要原因[5],槲皮素对全脑I/R损伤是否具有保护作用尚未见报道。本研究利用全脑性I/R损伤模型,观察槲皮素对全脑I/R损伤大鼠的作用,为槲皮素的临床应用提供实验依据。
1 材料与方法
1.1 实验动物及主要试剂
健康成年雄性SPF级SD大鼠216只,8-10周龄,体质量(300±20)g,由西安交通大学医学部动物实验中心提供(动物许可证号:SCXK(陕)2015-003)。槲皮素(美国Sigma公司,dH2O/0.1% Tween-80配成所需浓度),伊文氏蓝(河北博海生物工程开发有限公司),水合氯醛(西安交通大学第二附属医院),4%多聚甲醛(天津市博迪化学有限公司),DAB显色试剂盒(北京中山金桥公司),DCFH-DA(美国Sigma公司),引物合成(大连宝生物公司),TRIzol(美国Invitrogen公司),PrimeScript RT-PCR Kit(大连宝生物公司),Premix Ex TaqTMVersion 2.0(大连宝生物公司),大鼠IL-1β、IL-6、IFN-γ、TNF-α检测ELISA试剂盒(武汉伊莱瑞特生物科技有限公司)。
1.2 模型制备及实验分组
采用4-VO法建立SD大鼠全脑I/R损伤模型。10%水合氯醛350 mg/kg腹腔注射麻醉,枕骨下第一颈椎水平正中切口,暴露第一颈椎横突,通过翼小孔,烧灼双侧椎动脉并使其闭塞。24 h后,仰卧位取颈部正中切口,暴露并游离双侧颈总动脉,无创动脉夹夹闭15 min,然后开放动脉夹恢复血流灌注。
216只雄性SD大鼠随机分为假手术+vehicle组(sham组)、I/R+vehicle组(I/R组)、I/R+槲皮素5 mg/(kg·d)组(低剂量组)及I/R+槲皮素10 mg/(kg·d)组(高剂量组)。采用4-VO法建立全脑I/R模型,sham组暴露双侧椎动脉以及颈总动脉后予以缝合。四组大鼠均在造模前3 d开始灌胃,sham组和I/R组均以0.1%的Tween80(1 ml/100 g)灌胃,低剂量组和高剂量组分别以0.05%[5 mg/(kg·d)]、0.1%[10 mg/(kg·d)]的槲皮素溶液(1 ml/100 g)灌胃,1次/d,持续至观察结束当天。
1.3 HE染色观察海马CA1区病理形态学变化
每组6只大鼠。再灌注24 h,将灌注针头插入左心室,4%多聚甲醛的PBS液灌注。开颅取脑,分离海马组织,在4%多聚甲醛溶液中固定24 h,常规石蜡包埋,HE染色。
1.4 NDS评估神经功能
每组6只大鼠。分别在再灌注12,24,48 h时,根据Cao等[6]的方法,进行NDS评分。
1.5 干湿重法检测脑含水量
每组6只大鼠。分别在再灌注12,24,48 h时,麻醉后处死大鼠,开颅取脑,留取左侧大脑半球,测湿脑组织质量(wet weight,WW),烘烤24 h至恒重,称取干脑组织质量(dry weight,DW)。脑组织含水量=(WW-DW)/WW×100%。
1.6 EB法检测血脑屏障(BBB)通透性
每组6只大鼠。分别在再灌注12,24,48 h时,麻醉后经股静脉注射2% EB(3 ml/kg),注射后1 h灌注生理盐水处死。开颅取脑,制作2 mm厚冠状切片,置于二甲基甲酰胺溶液,37 ℃恒温振荡水浴箱放置48 h,制作匀浆,10 000g离心20 min,用乙醇按1 ∶3的比例稀释上清液。用分光光度计在波长632 nm处测定各标本的OD值。根据标准曲线计算出EB含量。
1.7 DCFH-DA法检测海马细胞活性氧(ROS)含量
每组6只大鼠。分别在再灌注2,12,24 h时,麻醉后处死大鼠,分离海马组织,滴加4 ℃ PBS溶液,研磨1 min,过滤,取上清液,2 000g离心5 min,清洗,PBS重新悬浮细胞,制备1×106/ml的细胞悬液,加入DCFH-DA探针,5% CO2细胞培养箱避光孵育,采用488 nm为激发波长,525 nm为发射波长,检测细胞中荧光强度。根据DCF的标准曲线计算ROS的水平。
1.8 real-time PCR检测海马组织IL-1β、TNF-α、IL-6、IFN-γ mRNA水平

1.9 ELISA法检测海马组织和血清IL-1β、TNF-α、IL-6、IFN-γ的表达
每组6只大鼠。分别在再灌注2,12,24,48 h时,麻醉后处死大鼠,取脑,分离海马组织,制备组织匀浆;麻醉后从心脏抽取静脉血约5 ml,加入EDTA抗凝管中静置10 min,2 000 r/min离心20 min,将血清标本收集于1.5 ml EP管中。加入50 μl待测样品,混匀,温育60 min,加50 μl酶标抗体工作液,37 ℃反应90 min,加100 μl底物工作液,暗处反应10 min,最后加入终止液50 μl,在492 nm处测吸光值。根据吸光值在标准曲线上查出其含量。
表1 各个基因引物序列
Table 1 Primer sequences of genes for real-time PCR
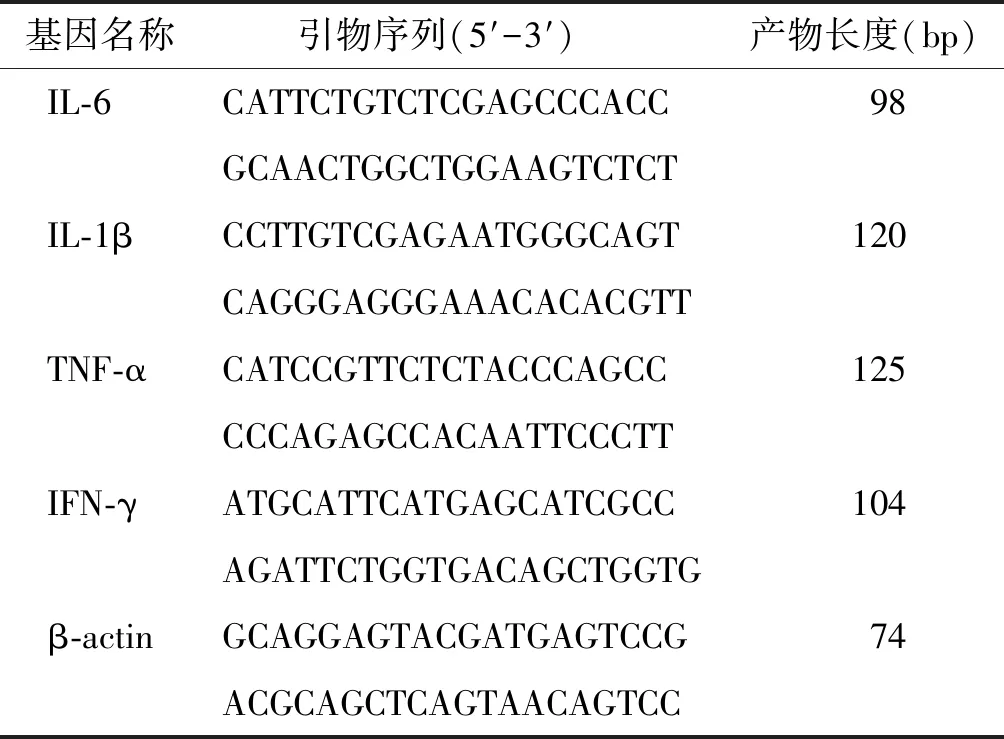
基因名称 引物序列(5′-3′)产物长度(bp) IL-6CATTCTGTCTCGAGCCCACC98 GCAACTGGCTGGAAGTCTCT IL-1βCCTTGTCGAGAATGGGCAGT120 CAGGGAGGGAAACACACGTT TNF-αCATCCGTTCTCTACCCAGCC125 CCCAGAGCCACAATTCCCTT IFN-γATGCATTCATGAGCATCGCC104 AGATTCTGGTGACAGCTGGTG β-actinGCAGGAGTACGATGAGTCCG74 ACGCAGCTCAGTAACAGTCC
1.10 统计学分析
2 结果
2.1 海马CA1区病理学结果
sham组海马CA1区结构清晰,细胞排列整齐、致密,形态正常。IR组海马CA1区细胞数量减少,排列紊乱、稀疏,胞体缩小。与I/R组相比,低剂量组和高剂量组海马CA1区损伤明显减轻,结构较为清晰,细胞数量及形态较为正常(见图1)。
2.2 NDS评分结果
I/R组12,24,48 h的NDS评分较sham组显著下降(P<0.05),而低剂量组及高剂量组NDS评分均显著高于I/R组(P<0.05,见图2)。
2.3 脑组织EB含量检测结果
与sham组相比,I/R组12,24,48 h EB含量显著升高(P<0.05)。再灌注24 h和48 h,低剂量组和高剂量组EB含量较I/R组显著降低(P<0.05,见图3)。
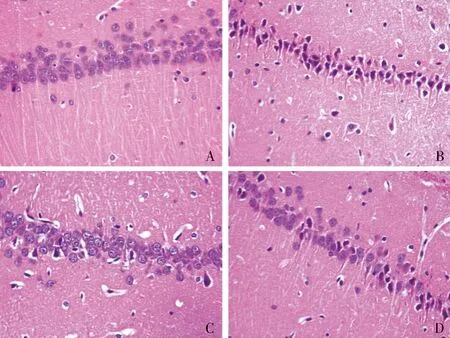
A.sham组;B.I/R组;C.低剂量组;D.高剂量组图1 再灌注24 h海马CA1区HE染色结果 (×400)Figure 1 HE staining of hippocampal CA1 at 24 h after reperfusion in different groups (×400)
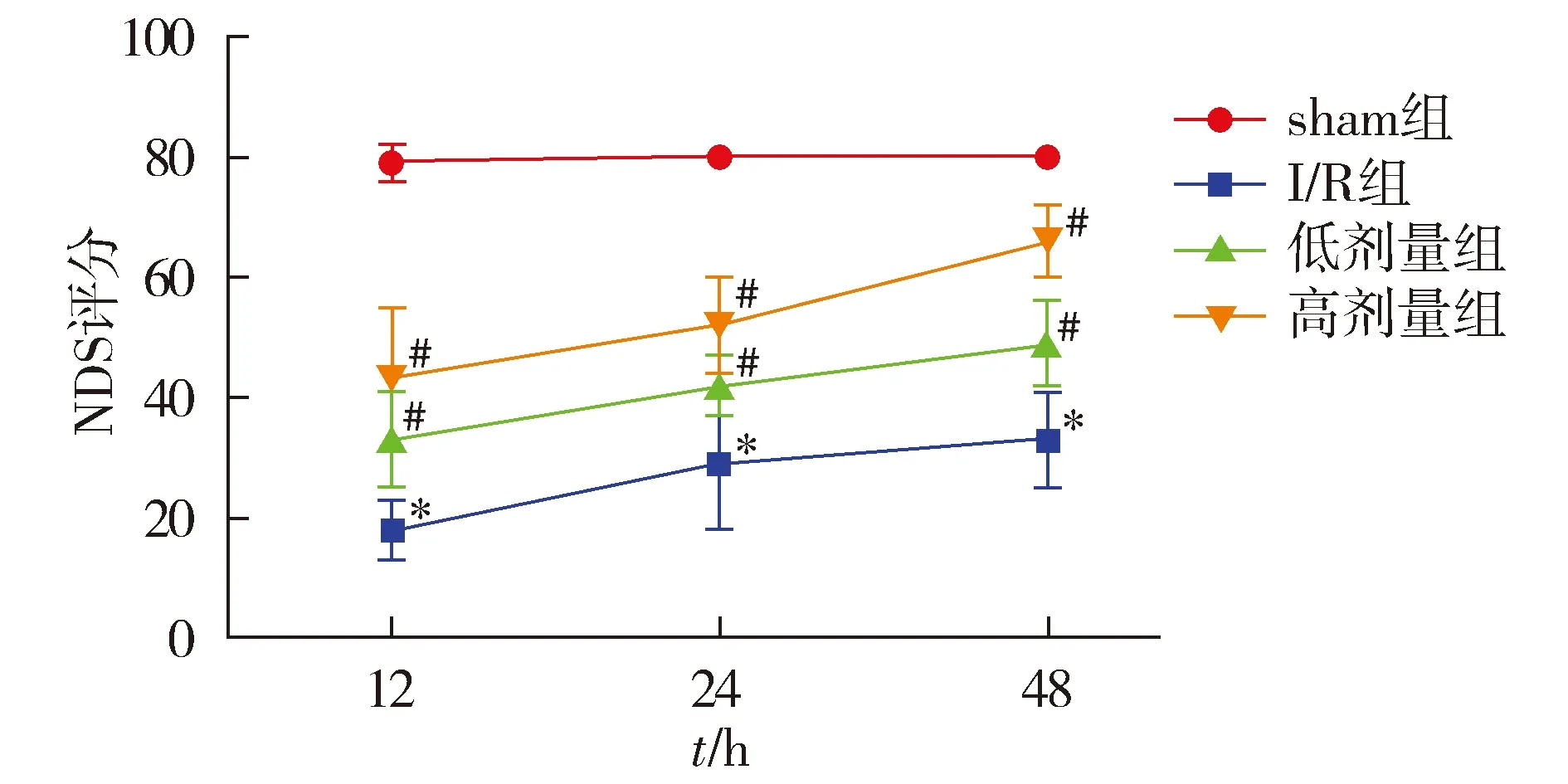
与sham组相比,*P<0.05;与I/R组相比,#P<0.05图2 各组再灌注12,24,48 h NDS评分的比较Figure 2 Comparison of NDS scores at 12, 24 h and 48 h after reperfusion among different groups
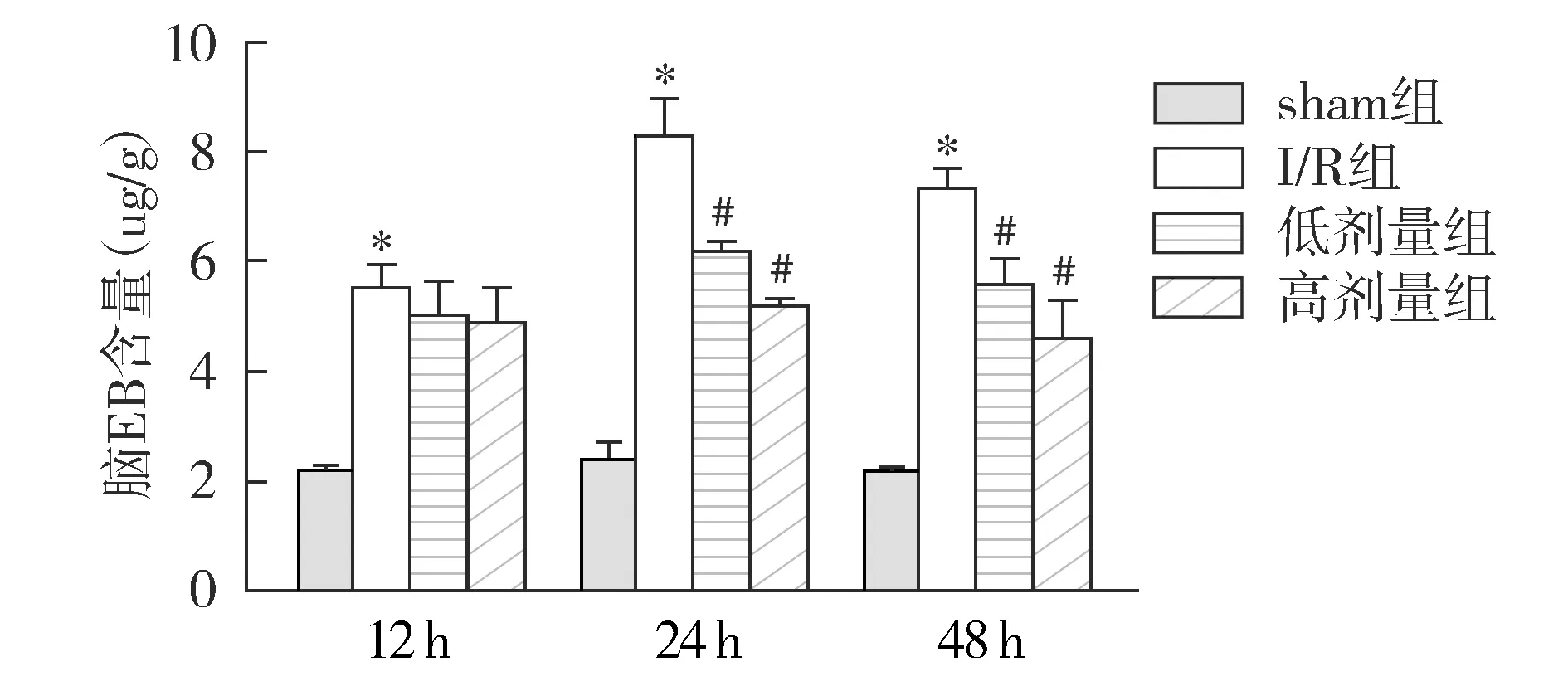
与sham组相比,*P<0.05;与I/R组相比,#P<0.05图3 各组再灌注12,24,48 h EB含量的比较Figure 3 Comparison of EB content at 12, 24 h and 48 h after reperfusion among different groups
2.4 脑含水量检测结果
再灌注12,24,48 h时I/R组脑组织含水量均显著高于sham组(P<0.05)。而在24 h和48 h,低剂量组和高剂量组的脑含水量较I/R组显著降低(P<0.05,见图4)。
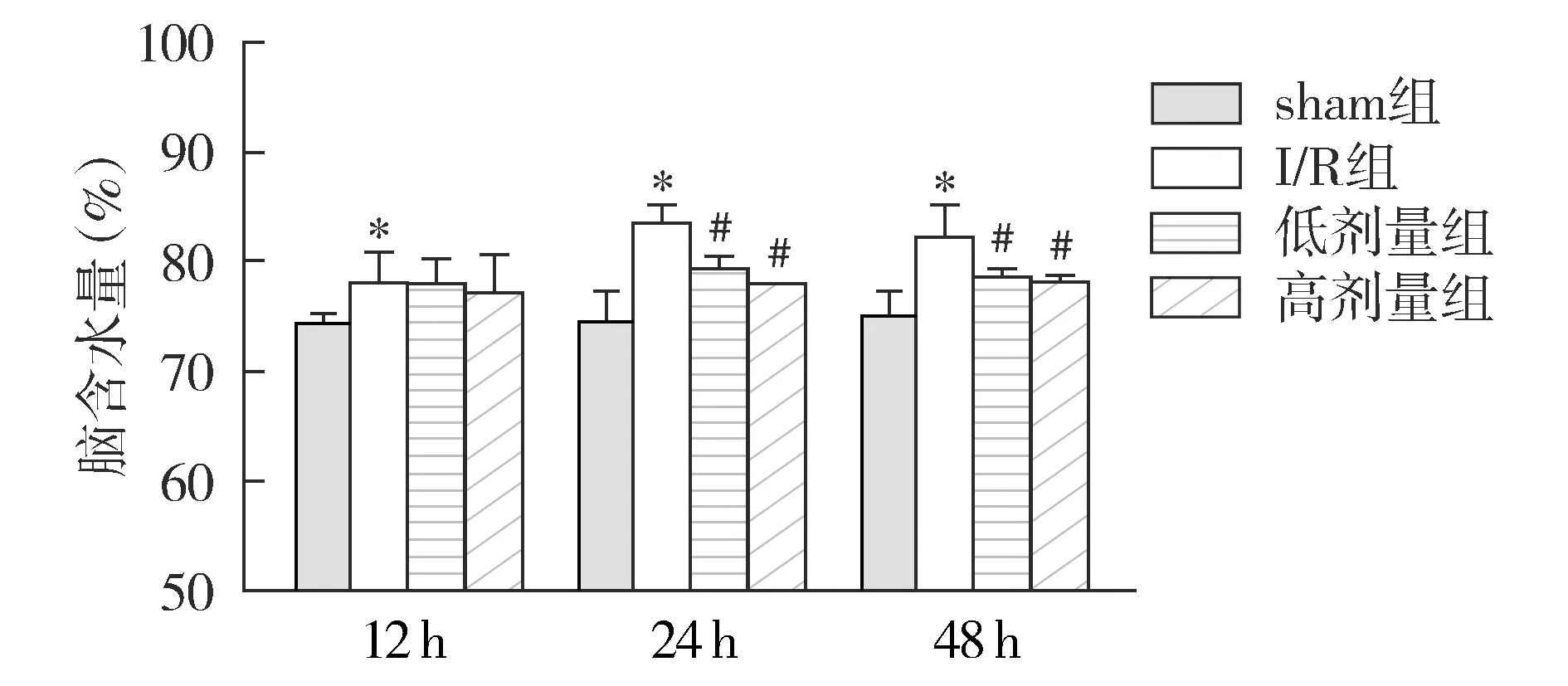
与sham组相比,*P<0.05;与I/R组相比,#P<0.05图4 各组再灌注12,24,48 h脑含水量的比较Figure 4 Comparison of brain water content at 12, 24 h and 48 h after reperfusion among different groups
2.5 ROS含量检测结果
I/R组再灌注2,12,24 h ROS含量显著高于sham组(P<0.05);再灌注2 h和12 h,低剂量组和高剂量组ROS含量均显著低于I/R组(P<0.05),而在24 h,高剂量组则显著低于I/R组(P<0.05,见图5)。
2.6 real-time PCR法检测海马组织IL-1β、TNF-α、IL-6、IFN-γ mRNA结果
与sham组相比,I/R组IL-1β mRNA、TNF-α mRNA以及IL-6 mRNA在再灌注2,12,24,48 h均显著升高(P<0.05),高剂量组在各时点均较I/R组显著降低(P<0.05);再灌注24 h和48 h,I/R组IFN-γ mRNA较sham组显著升高(P<0.05),而低剂量组和高剂量组较I/R组显著降低(P<0.05,见图6)。
2.7 ELISA法检测海马组织和血清IL-1β、TNF-α、IL-6、IFN-γ的表达的结果
与sham组相比,I/R组IL-1β、TNF-α以及IL-6在再灌注2,12,24,48 h均显著升高(P<0.05);与I/R组相比,低剂量组和高剂量组IL-1β、TNF-α、IL-6在再灌注后各时间点表达显著降低(P<0.05)。再灌注24 h和48 h,I/R组IFN-γ表达较sham组显著升高(P<0.05),而低剂量组和高剂量组较I/R组显著降低(P<0.05,见图7,8)。
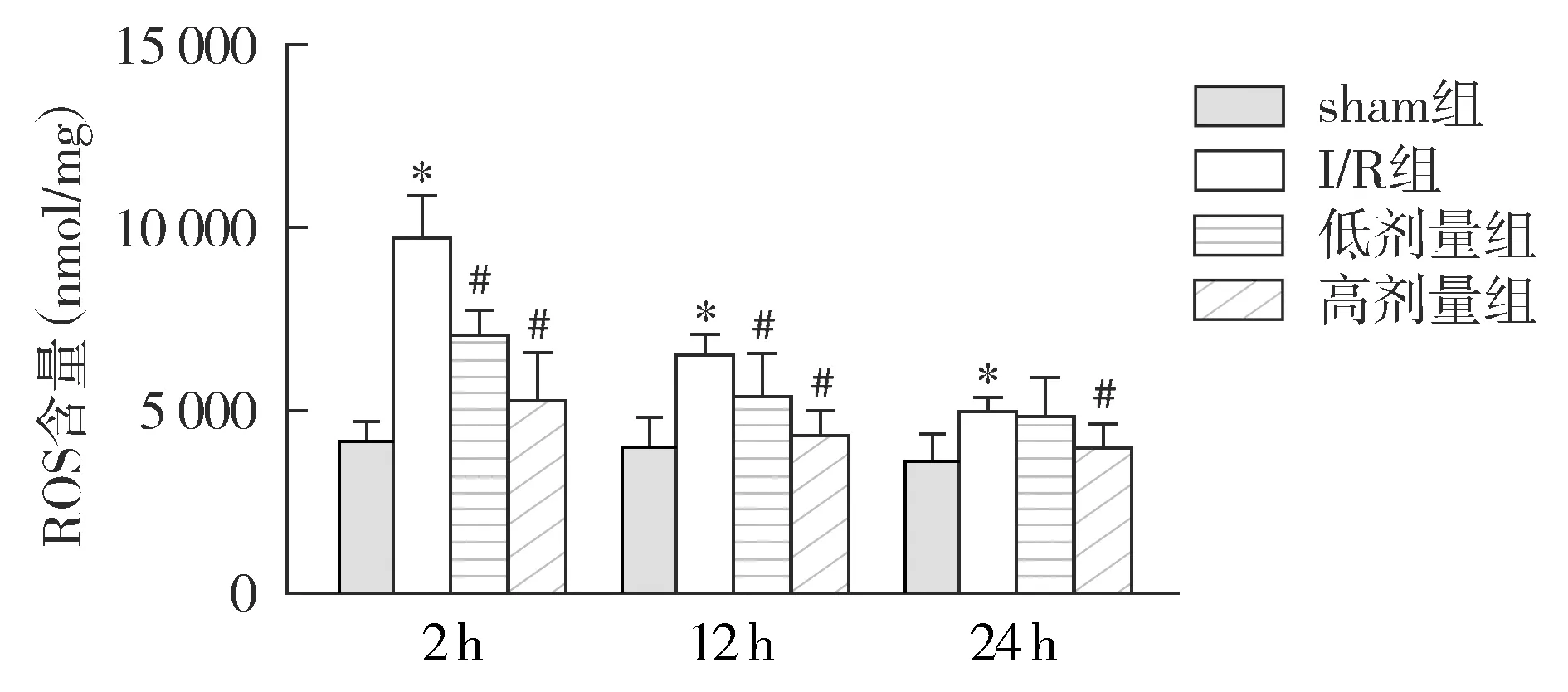
与sham组相比,*P<0.05;与I/R相比,#P<0.05图5 各组再灌注2,12,24 h海马细胞ROS含量的比较Figure 5 Comparison of ROS content in hippocampus cells at 2,12 h and 24 h after reperfusion among different groups

与sham组相比,*P<0.05;与I/R相比,#P<0.05图6 各组再灌注2,12,24,48 h海马组织IL-1β、TNF-α、IL-6、IFN-γ mRNA水平的比较Figure 6 Comparison of mRNA levels of IL-1β, TNF-α, IL-6 and IFN-γ in hippocampus tissue at 2,12, 24 h and 48 h after reperfusion among different groups
3 讨论
I/R损伤涉及氧化损伤、炎症反应等一系列病理机制,是全脑性缺血后功能障碍甚至死亡的重要原因[6]。槲皮素具有抗氧化能力,近年来发现其具有减轻脑I/R损伤的作用,受到研究者的关注。
已经证实,海马、大脑皮层椎体细胞、纹状体和小脑浦肯野细胞是脑组织内对缺血缺氧最为敏感的区域或细胞,尤其是海马CA1区[7]。本研究HE染色结果显示,I/R组海马CA1区组织损伤较重,细胞排列紊乱,数量减少,核皱缩,核仁消失,低剂量组和高剂量组细胞层数及数量增多,形态较为正常,与I/R组相比,CA1区破坏程度显著减轻。提示槲皮素能够减轻全脑I/R导致的组织损伤。
国际中风治疗临床前研究指南指出,在脑缺血性损伤的药物研究中应选择多重指标,评价应包括组织和行为学结果。脑I/R损伤后,可出现一系列神经行为学的异常,通常与运动、感觉和认知功能障碍等相关,通过量化统计动物神经行为学差异可间接反映其大脑损伤程度,在脑缺血的研究中非常重要,NDS评分则属于神经功能缺损评分。本研究采用NDS来评价大鼠全脑I/R损伤后的神经功能。结果显示,I/R组大鼠NDS评分显著低于sham组,提示全脑I/R后大鼠的神经功能受到损伤,而操良斌等[8]学者的研究结果亦显示全脑I/R后大鼠NDS明显降低,和本实验研究结果一致。而低剂量组和高剂量组在再灌注后12 h、24 h和48 h的NDS评分均显著高于I/R组,提示槲皮素可以改善全脑I/R导致的大鼠神经功能损伤。
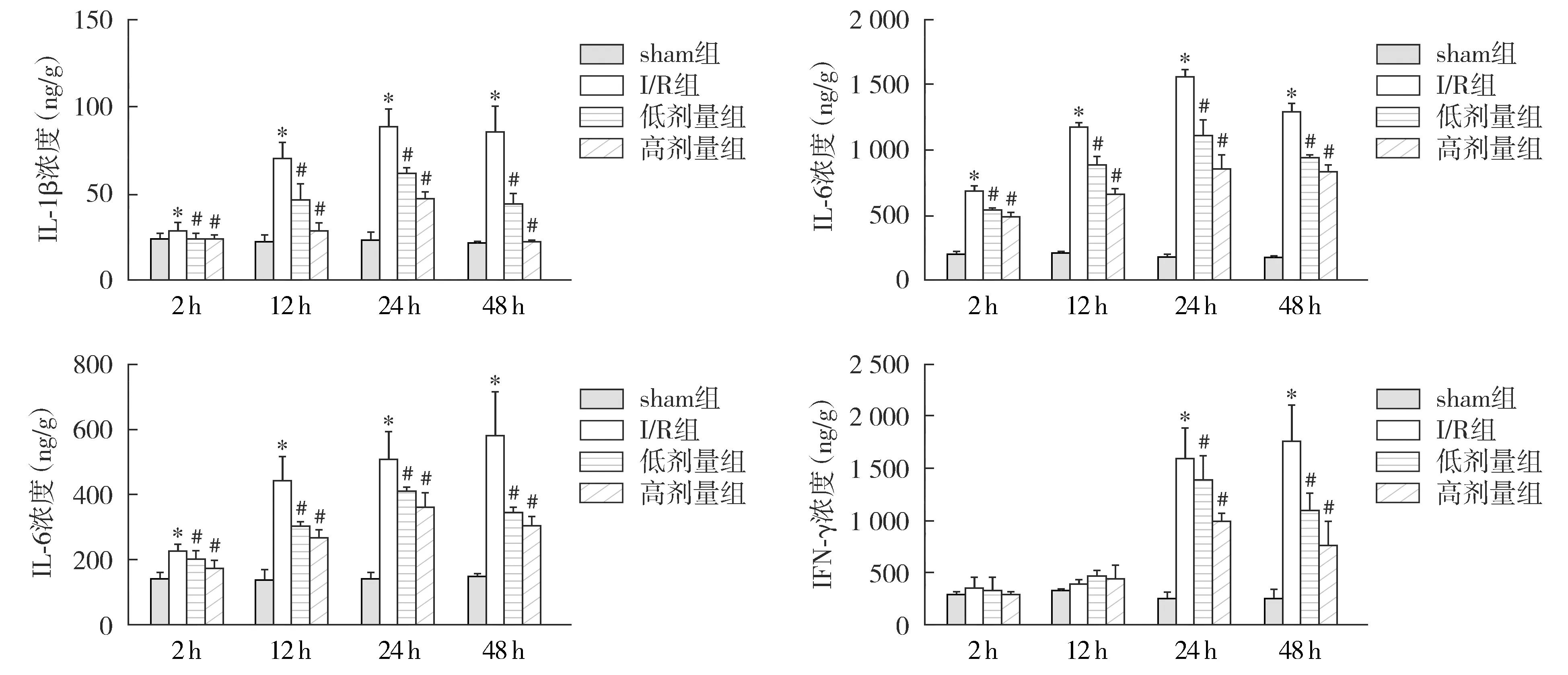
与sham组相比,*P<0.05;与I/R相比,#P<0.05图7 各组再灌注2,12,24 h和48 h海马组织IL-1β、TNF-α、IL-6、IFN-γ表达的比较Figure 7 Comparison of expression of IL-1β, TNF-α, IL-6 and IFN-γ in hippocampus tissue at 2,12, 24 h and 48 h after reperfusion among different groups

与sham组相比,*P<0.05;与I/R相比,#P<0.05图8 各组再灌注2,12,24 h和48 h血清IL-1β、TNF-α、IL-6、IFN-γ水平Figure 8 Comparison of level of IL-1β, TNF-α, IL-6 and IFN-γ in serum at 2,12,24 h and 48 h after reperfusion among different groups
脑缺血性损伤等均可以引起BBB通透性的改变,既是继发性损伤,也是损伤的重要机制[9]。MMPs的活化尤其是MMP-9表达增加是I/R后导致BBB损伤的重要机制[10]。在使用MCAO法制备的大鼠局灶性脑缺血模型的研究中,Lee等[11]发现,槲皮素能够通过抑制MMP-9的表达改善大鼠局灶性脑缺血损伤的预后。脑I/R后BBB遭到破坏,导致血液成分渗入脑组织,形成血管源性脑水肿,与细胞毒性脑水肿一起加重继发性损伤。本实验使用4-VO制备全脑I/R模型,结果显示,再灌注12,24,48 h,I/R组大鼠脑组织EB含量和脑含水量显著增高,表明全脑I/R损伤后BBB通透性增高,与以往研究结果一致[12]。而低剂量组和高剂量组在24 h和48 h,EB含量和脑含水量显著低于I/R组,说明槲皮素可有效降低BBB的通透性。
黄酮类的羟基结构决定了其具有清除ROS、鳌合金属离子等药理活性。Dai等[14]的研究建立体内和体外脑I/R损伤模型,显示异槲皮素通过Nrf2-介导,抑制NOX4/ROS/NF-κB信号通路,抑制氧化应激和神经细胞凋亡[13]。口服槲皮素负载的聚合物纳米胶囊,通过抑制ROS,保护线粒体结构和功能,抑制大鼠脑缺血再灌注损伤ROS介导细胞凋亡,从而起到神经保护作用。本实验结果显示,在全脑I/R后2 h,12 h和24 h,I/R组大鼠海马细胞内ROS含量显著高于sham组,而低剂量组和高剂量组ROS含量则较I/R组显著降低,表明槲皮素能够抑制全脑I/R后ROS的生成,与既往研究结果一致。证实了槲皮素能够抑制全脑I/R损伤后的氧化应激反应。
随着关于脑I/R损伤免疫机制研究的深入,炎症细胞和炎性因子在脑I/R损伤中的作用日益受到关注。有研究发现,槲皮素治疗联合人脐带间充质质细胞移植,抑制促炎因子IL-1β和IL-6,增加IL-4、IL-10和TGF-β1,可显著改善局灶性脑缺血大鼠神经功能的恢复[15]。Wang等[4]的研究观察异槲皮素在原代培养的大鼠海马神经元的氧糖剥夺再灌注模型和大鼠短暂性大脑中动脉闭塞再灌注模型的神经保护作用,结果表明,异槲皮素通过抑制TLR4,NF-κB和caspase-1的激活,ERK1/2、JNK1/2和p38的磷酸化,抑制TNF-α、IL-1β和IL-6,调控Bax、Bcl-2和caspase-3的表达,降低I/R损伤后的梗死面积、炎症反应、氧化应激及凋亡细胞数量。
本实验结果显示,与I/R组相比,低剂量组的IL-1β mRNA在48 h,TNF-α mRNA在2 h,IL-6 mRNA在2 h和12 h,与I/R组相比无显著性差异,其余各时间点mRNA水平以及各时间点蛋白表达均较I/R组显著降低。高剂量组在各时间点IL-1β、TNF-α以及IL-6 mRNA水平和蛋白水平均显著低于I/R组。ELISA检测海马组织和血清结果亦表明,低剂量组和高剂量组IL-1β、TNF-α、IL-6在再灌注后各时间点较I/R组显著降低。提示槲皮素可抑制全脑I/R损伤后IL-1β、TNF-α以及IL-6的表达。
I/R后,炎症因子既可以在脑组织内产生,也可以来源于外周免疫系统。Chang等[16]在局灶性脑缺血模型发现,脑缺血后IFN-γ在脑组织和外周血中表达均升高,与损伤关系密切。Seifert等[17]在局灶性脑缺血模型发现,来源于脾脏的IFN-γ加重了脑组织损伤。本实验结果显示I/R组大鼠脑组织中IFN-γ mRNA在全脑I/R后2 h和12 h与sham组无显著性差异,24 h开始升高,而在血清和脑组织出现同样的结果。说明脑组织增多的IFN-γ可能来源于外周免疫系统,BBB受损后进入脑组织。同时ELISA检测海马组织和血清结果发现低剂量组和高剂量组IFN-γ在24 h和48 h的表达较I/R组明显降低。说明槲皮素也可以抑制IFN-γ的表达。
综上所述,槲皮素能够改善大鼠全脑I/R后神经功能损伤,减轻血脑屏障损伤和脑水肿,减少ROS生成,抑制IL-1β、TNF-α、IL-6、IFN-γ的表达,减轻组织损伤。
