miR-582-5p通过诱导EMT抑制胃癌细胞的侵袭转移
2019-10-17王建华高增战刘思达段降龙毛智军普彦淞龙延滨
刘 栋,王建华△,高增战*,刘思达,段降龙,刘 斌,武 敏,毛智军,张 涛,薛 飞,普彦淞,龙延滨
(1陕西省人民医院普外二科,西安 710068;2陕西省人民医院内分泌科,西安 710068;△共同第一作者;*通讯作者,E-mail:gaoxi8004@163.com)
胃癌(gastric cancer,GC)的发病率逐年上升,全球的发病率占据恶性肿瘤发病率的第5位,死亡率位居恶性肿瘤第3位[1,2],死亡人数量约占全部恶性肿瘤死亡总人数的9.2%,严重危害人类的健康[3]。近年来多学科诊疗模式(multimodality therapy,MDT)在胃癌诊疗已经取得了很大的进展,但MDT所诊疗患者病情常较为复杂,或已失去胃癌的最佳治疗时机,大多数进展期胃癌患者预后仍较差,Ⅰ期胃癌患者5年生存率为大于85%,而Ⅳ期胃癌患者的5年生存率小于15%。侵袭和转移是导致患者胃癌死亡的重要因素之一[4]。有30%-50%的初诊胃癌患者同时合并肝转移,严重影响其预后[5]。因此,深入研究胃癌侵袭转移的发生发展的分子机制,为进展期胃癌的治疗策略提供实验依据,具有重要的现实意义。上皮-间质转化(epithelial-mesenchymal transition,EMT)是涉及上皮细胞恶性转化的一系列生物学程序,细胞失去极性并与邻近细胞接触,随后得到间充质样运动表型。EMT在肿瘤的恶性表型中发挥着关键和复杂的作用,包括癌症干细胞表型,耐药性,循环肿瘤细胞和肿瘤出芽的产生[6]。microRNA(miRNA)是一类19-25个核苷酸大小的非编码RNA,调节各类细胞的生长进程,包括生长、发育、分化、代谢和凋亡等等[7]。miR-582-5p是最初鉴定的一类重要的miRNA成员,前期研究已经证实其参与各类肿瘤的发生和发展,但其在不同肿瘤中的作用还存在不一致,如在直肠癌发生发展中miR-582-5p表现出促进肿瘤生长,而在前列腺癌中表现出抑癌基因,所以有必要研究miR-582-5p在胃癌中的作用以及侵袭转移机制[8-10]。本研究采用miR-582-5p mimics上调胃癌细胞miR-582-5p表达,研究其对胃癌细胞侵袭、迁移能力的影响,对EMT相关分子表达的影响,初步探讨对胃癌转移的机制。
1 材料与方法
1.1 主要试剂和仪器
Trizol试剂、LipofectamineTM2000转染试剂(美国Invitrogen公司);反转录试剂盒(日本TaKaRa公司)。miR-582-5p、U6引物、miR-582-5p mimics及Negative control(上海吉玛生物科技有限公司);RPMI-1640、Transwell小室培养基(美国Corning公司);胎牛血清、OPTI-MEN(法国Gibco公司);Matrigel胶(美国BD公司)。real-time PCR试剂(日本TaKaRa公司);real-time PCR仪(日本Bio-Rad公司)。
1.2 细胞培养
人胃癌细胞株SGC-7901、AGS和胃正常上皮细胞GES-1由陕西省人民医院实验室长期保存。RPMI-1640培养基(含10%胎牛血清),置于37 ℃、5% CO2培养箱中,采用0.25%胰蛋白酶消化、传代,取生长状态良好的对数生长期细胞用于后续实验。
1.3 real-time PCR检测胃癌细胞株miR-582-5p的表达量
Trizol试剂提取细胞总RNA,严格按照操作说明书进行实验,每样取2 μg RNA反转录成cDNA进行reai-time PCR检测,引物序列:miR-582-5P正向5′-GCACACATTGAAGAGGACAGAC-3′;反向:5′-TATTGAAGGGGGTTCTGGTG-3′。U6正向:5′-CTCGCTTCGGCAGCACA-3′;反向:5′-AACGCTTCACGAATTTGCGT-3′。反应条件:95 ℃预变性30 s;随后按95 ℃ 5 s,60 ℃ 30 s,40个循环。每个样本的U6作为内参,基因相对表达量采用2-ΔΔCt方法计算分析。
1.4 Western blot检测上调miR-582-5p对胃癌细胞EMT标志性基因表达的影响
取生长至对数期的SGC-7901和AGS细胞,6孔板中每孔加入2×105个细胞,当细胞生长、融合至80%左右时,收集细胞,RIPA裂解液提取细胞总蛋白,BCA蛋白浓度定量试剂盒按照操作说明进行蛋白定量,按照30 μg蛋白上样量进行12% SDS-PAGE分离蛋白,采用半干式转移法将蛋白质转移到PVDF膜上,脱脂牛奶封闭2 h,顺序经一抗(1 ∶100稀释的鼠抗人Slug、Snail、vimentin、fibronectin、E-cadherin抗体)和二抗(1 ∶1 000)孵育,ECL显色、凝胶成像分析系统采集图像,GAPDH作为内参,灰度分析。
1.5 细胞转染
将对数生长期SGC-7901和AGS细胞按照2×105个接种于6孔板,按照实验设计分为实验组(转染miR-582-5p mimics)、空白对照组(转染negative control)。用250 μl OPTI-MEN稀释LipofectamineTM2000转染试剂5 μl,室温下静置5 min,再用250 μl OPTI-MEN稀释实验组和空白对照组5 μl,两者混合室温静置20 min,每孔加入500 μl中的转染复合液,于5% CO2、37 ℃孵育6 h,用新鲜的完全培养基(含血清)替换含有转染复合物的培养基,供后续实验使用。
1.6 划痕试验检测上调miR-582-5p对SGC-7901和AGS细胞侵袭转移的影响
将对数生长期SGC-7901和AGS细胞按照5×105个接种于6 cm培养皿,待细胞长满后,用200 μl移液器枪头划痕,PBS冲洗3次,更换为无血清培养基,继续培养,取48 h曝光显影,测量迁移距离、计算相对迁移率,划痕迁移率=(划痕后即刻划痕面积-划痕后24 h划痕面积)/划痕后即刻划痕面积×100%。
1.7 侵袭实验检测上调miR-582-5p对SGC-7901和AGS细胞侵袭转移的影响
Matrigel胶在4 ℃过夜并融化,和1640培养基按照1 ∶8比例稀释,每孔50 μl包被Transwell小室底膜的上室面,室温风干。接种转染48 h的AGS和SGC-7901细胞,调整细胞密度至1×105个/ml,取200 μl接种于上层小室,小室加入600 μl含10%胎牛血清的1640培养基。在37 ℃、5% CO2培养箱中孵育48 h。取出Transwell小室吸除培养基,利用棉签拭去Transwell小室滤膜上面的Matrigel和未穿过滤膜的AGS和SGC-7901细胞,95%酒精固定5 min,结晶紫溶液染色1 h。显微镜观察并计数,取平均值。
1.8 统计学分析
采用SPSS21.0统计学分析软件,两组间差异分别采用两样本t检验,多组间差异采用单因素方差分析(One-way ANOVA),以P<0.05认为差异有统计学意义。
2 结果
2.1 miR-582-5p在胃癌细胞中的表达
实验采用real-time PCR检测人胃癌细胞株SGC-7901、AGS、MGC-803、BGC-823、MKN-28和正常胃上皮细胞GES-1细胞株miR-582-5p的表达量,结果显示,相比正常胃上皮细胞GES-1,miR-582-5p的表达在胃癌细胞SGC-7901、AGS、MGC-803、BGC-823、MKN-28中表达显著降低,差异有统计学意义(均P<0.05,见图1)。为了研究miR-582-5p在胃癌侵袭转移中的作用,选取miR-582-5p相对表达较高的SGC-7901和AGS细胞用作后续实验研究细胞株,采用转染miR-582-5p mimics法上调miR-582-5p的表达。

与EGS比较,*P<0.05图1 MiR-582-5p在5种胃癌细胞中的表达Figure 1 Expression of miR-582-5p in five gastric cancer cells
2.2 miR-582-5p过表达鉴定
miR-582-5p mimics转染前实验选中的SGC-7901和AGS细胞,real-time PCR鉴定过表达效率。SGC-7901和AGS细胞在转染miR-582-5p mimics后实验组miR-582-5p表达水平显著低于空白对照组(negative control),差异有统计学意义(均P<0.05,见图2)。
2.3 上调miR-582-5p对胃癌细胞侵袭的影响
研究miR-582-5p在胃癌侵袭、转移的作用,采用Tranaswell实验和细胞划痕实验研究上调miR-582-5p对SGC-7901和AGS细胞侵袭转移的影响。细胞划痕实验结果显示,与阴性对照组比较,转染组的SGC-7901和AGS细胞的迁移能力明显减弱,差异有统计学差异(均P<0.05,见图3)。Tranaswell实验结果显示,相比阴性对照组,转染了miR-582-5p mimics的SGC-7901和AGS细胞的侵袭能力明显降低,差异有统计学差异(P<0.05,见图4)。
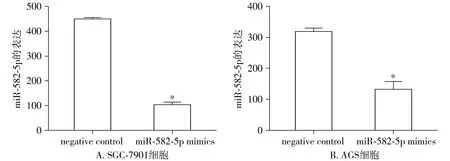
与negative control比较,*P<0.05图2 胃癌细胞株SGC-7901和AGS转染miR-582-5p mimics后miR-582-5p的表达Figure 2 Expression of miR-582-5p in SGC-7901 and AGS cells after transfection with miR-582-5p mimics

与negative control比较,*P<0.05图3 细胞划痕实验检测上调miR-582-5p对SGC-7901细胞和AGS细胞迁移能力的影响Figure 3 The effect of up-regulation of miR-582-5p on the migratory ability by would healing assay
2.4 上调miR-582-5p对胃癌细胞EMT标志性基因表达的影响
为了研究miR-582-5p对胃癌细胞EMT的作用,本研究采用了real-time PCR和Western blotting检测了上调miR-582-5p对胃癌细胞EMT标志性基因表达的影响。结果显示,相比对照组(negative control),转染了miR-582-5p mimics的SGC-7901和AGS细胞中Slug、Snail、vimentin及fibronectin表达降低,E-cadherin表达升高,差异具有统计学差异(均P<0.05,见图5,6)。结果提示上调miR-582-5p增加胃癌细胞EMT的作用。

与negative control比较,*P<0.05图4 Transwell实验研究上调miR-582-5p后胃癌SGC-7901和AGS细胞的侵袭能力 (结晶紫染色×100)Figure 4 The effect of up-regulation of miR-582-5p on the migratory ability by Transwell assay (crystal violet staining,×100)

与negative control比较,*P<0.05图5 real-time PCR检测上调miR-582-5p对SGC-7901和AGS细胞EMT指标的影响Figure 5 Effect of up-regulation of miR-582-5p on levels of EMT-related genes detected by real-time PCR
2.5 阻断Wnt/β-catenin信号通路减弱miR-582-5p对胃癌细胞侵袭转移的抑制作用
本研究采用Dickkopf-1阻断Wnt/β-catenin信号通路后,观察上调miR-582-5p后对细胞侵袭迁移的影响。结果显示,Dickkopf-1减弱了上调miR-582-5p对胃癌细胞侵袭的抑制作用(均P<0.05,见图7)。提示Wnt/β-catenin信号通路可能参与到miR-582-5p对结胃癌侵袭、转移的调控。
3 讨论
转移是导致胃癌死亡率增高的原因之一。肝脏是胃癌转移最常见的靶器官。未治疗的胃癌肝转移患者中位生存时间仅有6个月,失去切除机会的患者5年生存率低于5%。所以深入研究与胃癌侵袭、转移有关的基因及其致癌、侵袭信号传导通路非常有必要。miRNA是真核生物中广泛存在的一类重要的调控分子,是参与恶性肿瘤增殖、凋亡、侵袭转移及耐药等过程的关键基因。现阶段在膀胱癌的研究中,过表达miR-582-5p的膀胱癌增殖及侵袭减慢[10]。作用机制可能是miR-582-5p抑制TGF-β信号通路影响前列腺癌的侵袭和骨转移。然而,miR-582-5p对胃癌中侵袭、转移的机制和相关通路未见文献报道。本研究上调miR-582-5p表达明显抑制胃癌细胞侵袭、迁移能力,提示miR-582-5p可能参与胃癌的远处转移。

A.SGC-7901细胞中EMT相关蛋白的相对表达量 B.AGS细胞中EMT指标蛋白表达量与negative control比较,*P<0.05图6 Western blotting检测上调miR-582-5p对SGC-7901和AGS细胞EMT相关蛋白的影响Figure 6 Effect of up-regulation of miR-582-5p on levels of EMT-related proteins by Western blotting
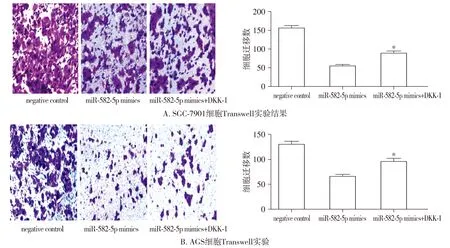
图7 Dickkopf-1阻断Wnt/β-catenin信号通路后观察上调miR-582-5p对SGC-7901和AGS细胞侵袭的影响Figure 7 Effect of blockage of the Wnt/β-catenin pathway by Dickkopf-1 on invasive abilities of SGC-7901 and AGS cells enhanced by up-regulation of miR-582-5p
上皮-间质转化(EMT)是多种生化变化中的必需过程,包括胚胎发育,组织重塑和伤口愈合[11]。近年来的研究表明EMT在肿瘤侵袭转移中起着关键性的作用。许多转移性肿瘤的侵袭前,常常伴有EMT转换[12]。已经有研究表明Slug、Snail、ZEB1和Twist等转录因子参与了EMT的调控[13]。其中,Snail基因是EMT主要的控制者,能够明显抑制E-cadherin的表达。而上皮性指标E-cadherin失去作用被公认为是EMT的标志[14]。本研究上调miR-582-5p抑制胃癌细胞Slug、Snail、fibronectin及vimentin表达升高和E-cadherin表达降低,提示上调miR-582-5p抑制胃癌细胞EMT的作用。
近年来,已证明几种关键信号通路参与肿瘤的EMT进程,包括Wnt/β-catenin、Hedgehog、TGF-β/Smad、PI3K/Akt和Notch通路[15-17]。Wnt/β-catenin信号通路是维持胃肠道稳定和增殖的主要信号传导途径之一[18]。Wnt信号传导的异常激活参与胃癌的发生发展。Wnt信号通路路径中组分的突变及下游的β-catenin的激活,是癌症发生的重要的标志性分子事件[19,20]。在非小细胞肺癌中,过表达miR-582-5p通过激活Wnt/β-catenin信号通路维持干细胞特性,抑制克隆形成能力和侵袭[7]。因此,本研究探讨了Wnt/β-catenin是否参与miR-582-5p对胃癌侵袭转移及EMT的调控,Dickkopf-1阻断Wnt/β-catenin信号通路促进miR-582-3p对胃癌细胞侵袭转移的抑制作用,提示上调miR-582-5p可能通过激活Wnt/β-catenin信号通路抑制胃癌侵袭转移及EMT。已有学者证明在非小细胞肺癌中,miR-582-5p通过靶向抑制Axin2、DKK3和SFRP1表达,促进Wnt/b-catenin通路激活。然而,在胃癌中,miR-582-5p激活Wnt/β-catenin信号通路的具体分子机制仍有待于进一步的研究。
远处转移是导致胃癌患者预后差的主要因素。尽管近年来,肿瘤的生物治疗取得了较大的进展,但也面临着诸多问题,如缺乏合适的预测肿瘤转移的指标。本研究上调miR-582-5p抑制胃癌侵袭转移及EMT,并且得出Wnt/β-catenin信号通路可能参与其中。因此上调miR-582-5p的表达,可以减缓胃癌的转移,可能为胃癌的生物治疗提供新的治疗策略。
