乳源六肽预防和降低小鼠急性酒精性肝损伤及其机制
2019-10-16刘沁雪李敬文姚晓炜吕志昊秦宜德
席 浩,刘沁雪,陈 曦,王 鹏,李敬文,姚晓炜,吕志昊,许 尹,秦宜德
研究[1-2]表明,生物活性肽具有抗氧化、抗高血压、抗肿瘤的生物学功能,同时能够修复受损的肝细胞。乳源免疫调节肽(immunomodulating peptide,PGPIPN)主要来自于α、β和κ-酪蛋白,多数为3~9个氨基酸残基的短肽[3-4]。目前实验室前期研究证实,PGPIPN具有加快酒精代谢,并显著降低血清中总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)活性的能力。由于PGPIPN良好的免疫调节功能和抗氧化作用[5-6],现通过高浓度酒精连续灌胃的方法建立小鼠急性酒精性肝损伤模型,探究PGPIPN的相关作用机制,以期进一步探究PGPIPN的药理学作用。
1 材料与方法
1.1 实验动物健康的60只昆明种雄性小鼠,清洁级,18~22 g,由安徽医科大学实验中心提供,饲养在安徽医科大学实验动物中心。
1.2 试剂北京红星牌56°二锅头酒(北京红星股份有限公司); PGPIPN(上海生物工程技术有限公司合成);谷胱甘肽片(glutathione,GSH,重庆药友制药有限公司生产)。TNF-α含量检测采用北京北方生物技术研究所的试剂盒,ALT、AST、TG和TC的含量检测采用南京建成生物工程研究所的试剂盒。改良型CBA法蛋白质浓度测定试剂盒由上海生物工程技术有限公司提供。
1.3 仪器ST16R低速冷冻离心机(美国赛默飞世尔科技公司);Multiskan Go全波长酶标仪(美国赛默飞世尔科技公司);倒置显微镜T300型(尼康仪器上海有限公司);自动放免仪(中国科大中佳公司);罗氏全自动生化分析仪(瑞士罗氏公司)。
1.4 分组60只昆明种小鼠,适应性喂养1周,然后分成6组:对照组、模型组、PGPIPN L组、PGPIPN M组、PGPIPN H组和GSH组,每组10只小鼠。分别以0.04、0.4、4 mg/kg进行灌胃;阳性对照GSH组以谷胱甘肽片200 mg/kg灌胃。持续灌胃2 d,每天1次。正常组和模型组以等量蒸馏水进行灌胃。进行到给药第12天开始,模型组及各给药组小鼠以56°红星二锅头酒灌胃,16 ml/kg,持续3 d,每天1次。正常组使用等量蒸馏水替代灌胃。各组小鼠均正常饲养。24 h后颈椎脱臼处死小鼠,取相关组织检测指标。
1.5 血清和肝匀浆提取末次灌胃结束后12 h内禁食处理,将各组小鼠称重,分离血清,测定血清中ALT和AST含量。取肝左叶约1.0 g,剪碎研磨,使用匀浆仪制成10%肝匀浆, 4 ℃ 4 000 r/min离心8 min,取上清液用CBA法检测新鲜制作的肝匀浆中蛋白质含量,测定肝脏中TG含量;按试剂盒说明操作,使用放射免疫检测TNF-α的含量。
1.6 免疫组化和原位末端转移酶标记技术检测(Tunel detection,Tunel)将小鼠的肝脏组织用10%的甲醛溶液固定、梯度酒精浓度脱水、石蜡包埋、切片,制作常规组织切片,使用Tunel试剂盒染色,荧光倒置显微镜观察。
1.7 分离原代肝脏组织测定细胞的凋亡将小鼠用水合氯醛麻醉,在解剖台上固定,打开腹腔,找到门静脉和下腔静脉。从门静脉入针,注入灌流液Ⅰ(250 ml Krebs Ringer with Glucose中加入0.5 ml 50 mmol/L EGTA),待肝脏组织灰白,将灌流液换成胶原酶Ⅰ,灌流至肝脏出现皲裂或水泡停止。抖落细胞,400目滤网过滤,静置后离心,用流式细胞术检测细胞的凋亡。

2 结果
2.1 PGPIPN对体质量、肝重和肝指数的影响与对照组相比,模型组的小鼠体质量下降,肝指数增大,组间差异有统计学意义(F=57.92,P<0.05)。图1C可见,与模型组相比,GSH组和PGPIPN H组的肝指数降低;同时 PGPIPN M组和PGPIPN L组小鼠肝指数有降低的趋势,但差异无统计学意义。
2.2 PGPIPN减轻小鼠酒精性肝损伤
2.2.1PGPIPN对小鼠血清中ALT和AST含量的影响 与对照组相比,模型组小鼠血清中的ALT和AST活性增加,并且PGPIPN的浓度越高,ALT和AST的活性降低,各组间差异有统计学意义(F=132.47,P<0.01)。见图2。
2.2.2PGPIPN对小鼠肝匀浆中TNF-α含量的影响 放射免疫法测定肝匀浆中 TNF-α含量,首先要测定标准样品中含量,绘制标准样品曲线图,再根据待测样品中的CPM值反求浓度值。与对照组相比,模型组中小鼠体内的 TNF-α含量升高。与模型组相比,PGPIPN H组、 PGPIPN M组和PGPIPN L组中的TNF-α含量降低,各组间差异有统计学意义(F=712.35,P<0.01)。见图3。

图1 小鼠体质量、肝重和肝指数变化
A:体质量;B:肝重;C:肝指数;1:对照组;2:模型组;3:GSH组;4:PGPIPN L组;5:PGPIPN M组;6:PGPIPN H组;与对照组比较:*P<0.05;与模型组比较:#P<0.05
2.3 PGPIPN降低小鼠肝细胞脂肪含量生化分析显示模型组小鼠血清中TG、TC和肝脏匀浆中TG含量均高于对照组,且PGPIPN H组、 PGPIPN M组和PGPIPN L组中的TG、TC含量降低,各组间差异有统计学意义(F=394.85,P<0.01),说明PGPIPN可能是通过调节脂质的代谢来预防急性酒精性肝损伤的。见图4。

图2 PGPIPN对小鼠血清中ALT、AST含量变化的影响
A:ALT;B:AST;1:对照组;2:模型组;3:GSH组;4:PGPIPN L组;5:PGPIPN M组; 6:PGPIPN H组;与对照组比较:**P<0.01;与模型组比较:##P<0.01

图3 PGPIPN对小鼠肝脏TNF-α的含量影响
1:对照组;2:模型组;3:GSH组; 4:PGPIPN L组;5:PGPIPN M组;6:PGPIPN H组;与对照组比较:**P<0.01;与模型组比较:##P<0.01
2.4 PGPIPN降低小鼠肝细胞凋亡
2.4.1Tunel染色的组织学分析 应用Image J对荧光图片进行半定量分析,荧光密度总和/区域面积=平均光密度,计算凋亡指数。与对照组相比,模型

图4 PGPIPN对小鼠血清中TG/TC和肝匀浆中TG含量变化的影响
1:对照组;2:模型组;3:GSH组;4:PGPIPN L组;5:PGPIPN M组;6:PGPIPN H组;与对照组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01
组肝脏组织有明显的病理变化。对照组肝细胞结构完整,肝索结构清晰,肝小叶排布整齐,肝细胞边界清晰,无明显坏死现象。模型组中肝索结构紊乱,液泡数目增加,肝细胞边界不清晰,细胞核消失,细胞皱缩。见图5、表1。

表1 各组小鼠肝细胞凋亡指数
与对照组比较:*P<0.05;与模型组比较:#P<0.05
2.4.2流式细胞术检测肝脏细胞凋亡情况 与对照组相比,模型组小鼠肝脏细胞早期凋亡严重,说明小鼠的急性酒精性肝损伤模型造模成功。与对照组比较,PGPIPN H组、 PGPIPN M组和PGPIPN L组中凋亡细胞比例降低,各组间差异有统计学意义(F=1187.42,P<0.05)。见图6、7。
3 讨论
根据前期的研究[7]表明PGPIPN具有增强免疫调节和缓解炎症反应的功能。急性酒精性肝损伤的发生机制就是短时间内大量摄入酒精导致乙醇及其代谢产物对肝脏组织的损伤[8],主要是氧化应激导致的炎症反应[9]。在急性酒精性肝损伤的初始阶段,肝脏组织内的TG和TC含量升高,致使脂肪变性[10],AST和ALT含量急剧升高,过氧化反应明显。
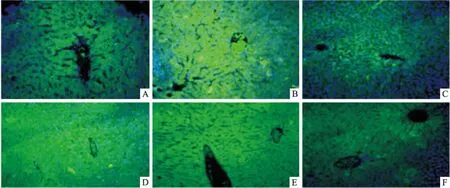
图5 各组小鼠肝脏组织的凋亡变化 ×200A:对照组;B:模型组;C:GSH组;D:PGPIPN L组;E:PGPIPN M组;F:PGPIPN H组

图6 流式细胞术检测各组小鼠肝脏细胞的凋亡变化A: 对照组; B: 模型组; C: GSH组; D:PGPIPN L组; E:PGPIPN M组; F:PGPIPN H组

图7 PGPIPN对小鼠肝脏细胞凋亡百分比的影响
1:对照组;2:模型组;3:GSH组;4:PGPIPN L组;5:PGPIPN M组;6:PGPIPN H组;与对照组比较:*P<0.05;与模型组比较:#P<0.05
PGPIPN可提高肝脏细胞的抗氧化能力,清除大量摄入酒精产生的自由基,从而对肝脏细胞进行保护。在急性酒精性肝损伤的后期阶段,肝脏细胞中的TNF-α含量大量增加,TNF-α作为标志性的炎性因子是由单核巨噬细胞产生的,参与机体的免疫调节,与发热和炎症的发生相关,是典型的促炎细胞因子。TNF-α人体内最重要的靶器官就是肝脏,正常状态下,机体内的TNF-α含量较低,但发生病理现象时,TNF-α的分泌大量产生,引起各种炎性因子迅速增加,导致炎症反应的发生,对细胞组织损伤严重。根据上述实验结果表明,本研究构建的小鼠急性酒精肝损伤模型是十分成功的。
通过病理学研究也可以看出,正常状态下,肝细胞结构完整,肝索结构清晰,肝小叶排布整齐,肝细胞边界清晰,未见细胞皱缩或鼓胀,无明显坏死现象。而肝脏组织在短时间内大量摄入酒精会导致肝索结构紊乱,液泡数目增加,肝细胞边界不清晰,细胞核消失,肝细胞间存在明显的炎性浸润。PGPIPN H组、 PGPIPN M组在PGPIPN的保护作用下,病理状态明显改善。
短时间内大量摄入酒精会导致肝脏组织脂肪变性,与酒精摄入产生的自由基结合导致氧化应激炎症反应的发生。实验证明了PGPIPN在体内能够有效地缓解短时间内大量酒精摄入对肝脏组织细胞的损伤,为临床上治疗急性酒精性肝损伤提供理论依据。
