hnRNP L在肝癌中的表达及与巨噬细胞极化相关性研究
2019-10-16葛勇胜荚卫东
石 旭,葛勇胜,荚卫东,王 涛,任 超
肝癌(hepatocellular carcinoma,HCC)是我国最常见的恶性肿瘤,也是世界上最常见和致命的癌症之一[1-2]。近年来,研究[3]表明肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)的极化在肿瘤的发生发展中起重要作用,其包括经典的促炎激活M1型和替代的抗炎激活M2型。巨噬细胞极化的失常普遍存在于多种包括HCC在内的恶性肿瘤中,并与肿瘤的生长和转移密切相关[4-5]。核不均一核糖核蛋白L(heterogeneous-nuclear ribonucleoprotein L,hnRNP L)是一种多功能RNA结合蛋白,在正常组织中微弱表达或不表达,但在多种恶性肿瘤中异常高表达,且与肿瘤进展相关[6-10]。然而,hnRNP L在HCC组织中的表达及其在HCC中的作用机制尚不清楚。有研究[11]表明hnRNP L可能具有调节巨噬细胞极化的潜力,这也可能是其参与肝癌进程的机制之一。该研究将对hnRNP L与肝癌中巨噬细胞极化的关系进行初步探究。
1 材料与方法
1.1 病例资料本研究回顾性收集了90例肝癌石蜡标本,标本来源于2011年1月~2016年12月就诊于安徽医科大学附属省立医院肝脏外科并在住院期间行根治性肝癌切除术的患者。术后病理均明确诊断为肝细胞癌。其中男71例,女19例,年龄20~80(51.79±12.51)岁。同时收集了20对新鲜冰冻肝癌组织及相对应癌旁组织(距离肿瘤边缘至少2 cm)用于后续Western blot及qRT-PCR实验测定。本研究中所有纳入病例手术前未接受放疗、化疗、靶向治疗及介入等抗肿瘤治疗。
1.2 主要试剂兔抗人多克隆抗体hnRNP L(北京bioss公司);鼠抗人多克隆抗体CD68、兔抗人多克隆抗体CD206、兔抗人多克隆抗体CD11c(美国Proteintech Group公司);DAB显色试剂盒、苏木精、通用山羊抗鼠/兔二抗、β-actin(北京中杉金桥公司);TRIzol试剂、ECL超敏发光试剂盒、逆转录试剂盒(美国Thermo公司);PCR引物(上海生工生物工程公司)。
1.3 实验方法
1.3.1免疫组化染色 采用免疫组化SP法检测hnRNP L及肿瘤相关巨噬细胞标志物(CD68、CD11c、CD206)的表达。制作2 μm厚度的肝癌石蜡组织连续切片。二甲苯脱蜡并在梯度乙醇中进行水化。之后将组织切片置于EDTA抗原修复溶液中进行高压抗原修复。将切片在3%过氧化氢中孵育20 min阻断内源过氧化物酶活性。孵育一抗,即添加兔抗人多克隆抗体hnRNP L(稀释比例为1 ∶200)、鼠抗人多克隆抗体CD68(稀释比例为1 ∶400)、兔抗人多克隆抗体CD206(稀释比例为1 ∶100)、兔抗人多克隆抗体CD11c(稀释比例为1 ∶100),然后4 ℃下孵育过夜。用PBST溶液冲洗后加入通用型二抗在37 ℃下孵育30 min。PBST洗片后,进行DAB显色;终止显色后,苏木精复染、梯度乙醇脱水、透明、封片及镜下观察。免疫组化结果的判定由两名临床经验丰富的病理科医师双盲下完成。hnRNP L免疫组化判定标准:400倍显微镜下随机选择切片组织上5个不重复视野进行免疫组化评分,评分包括染色强度和阳性细胞百分比。染色强度定义如下:棕褐色:3分;棕黄色:2分;淡黄色:1分;着色弱或不着色:0分;阳性细胞百分比即染色细胞占视野内全部细胞的百分比评分,定义如下:≤5%为0分;6%~25%为1分;26%~50%为2分;51%~75%为3分;>75%为4分。切片最终评分=着色细胞强度评分×阳性细胞百分比评分。最终评分0分记为阴性,1~3分记为弱阳性,4~6分记为中等强度阳性,9~12分记为强阳性,≥6分者定义为高表达。肿瘤相关巨噬细胞染色判定:400倍镜下选取5处代表性区域,评估其阳性细胞百分比,取平均值,最后大于平均值即定义为高表达,小于平均值定义为低表达。
1.3.2Western blot 各称取新鲜冰冻肝癌及癌旁组织100 mg,然后添加1 ml含PMSF的RIPA裂解液匀浆,在4 ℃、12 000 r/min离心15 min,取上清液。制配SDS-PAGE凝胶,按照1 ∶4比例添加5×SDS-PAGE蛋白上样缓冲液,沸水下充分变性。等量上样后进行电泳。电泳结束后将蛋白转移至PVDF膜。将PVDF膜置入Western洗涤液内,持续漂洗5 min。添加5%的脱脂奶粉,室温下水平摇床上缓动封闭2 h。PBST冲洗PVDF膜后添加稀释后的一抗(兔抗人多克隆抗体hnRNP L稀释比例为1 ∶500,β-actin抗体稀释比例为1 ∶1 000)。在4 ℃下缓慢摇动孵育过夜。按照1 ∶10 000比例稀释HRP标记的二抗在室温下缓动孵育2 h。PBST洗膜3次。之后进行条带显影操作,使用ECL试剂盒检测蛋白印迹,Image J软件分析条带灰度值。内参β-actin蛋白操作参照hnRNP L。
1.3.3qRT-PCR 用TRIzol提取20对新鲜冰冻肝癌和癌旁组织总RNA,逆转录合成cDNA。二步法进行qRT-PCR反应,反应条件为:95 ℃、2 min;95 ℃、5 s;60 ℃、10 s,40个循环。各引物序列如下:hnRNP L正向序列:5′-AGACTCTGGGCTTCCTGAAC-3′,反向序列:5′-TGTCTTCCTGCTCAGATGGG-3′,扩增长度为140 bp;β-actin正向序列:5′-CCCTGGAGAAGAGCTACGAG-3′,反向序列:5′-GGAAGGAAGGCTGGAAGAGT-3′,扩增长度为96 bp。最后2-ΔΔCt作为hnRNP L mRNA的最终相对表达量。

2 结果
2.1 hnRNP L在肝癌组织中的表达免疫组化结果显示hnRNP L主要在肝癌及癌旁组织的细胞质中表达,细胞核中偶见表达。其中,hnRNP L在肝癌组织中的阳性表达率为77.7%(72/90),在癌旁组织中的阳性表达率为53.3%(48/90),差异有统计学意义(χ2=11.908,P=0.001),见图1。qRT-PCR及Western blot实验结果显示,在转录和翻译水平,hnRNP L在肝癌组织的表达显著高于相对应癌旁组织,hnRNP L mRNA在肝癌组织及癌旁组织的相对表达量分别是(1.19±0.51)和(0.61±0.31),见图2,hnRNP L在肝癌组织及癌旁组织蛋白的相对表达量分别是(1.09±0.22)和(0.48±0.11),差异均具有统计学意义(t=5.690,P<0.001;t=15.829,P<0.001),见图3。
2.2 hnRNP L在肝癌组织中的表达及临床病理因素分析临床病理资料分析结果显示:hnRNP L在肝癌组织中的高表达与年龄、血管侵犯、肿瘤Edmondson分级及BCLC分期显著相关,差异有统计学意义(P=0.018、0.039、0.001、0.018)。而与患者其他临床资料如性别、肿瘤包膜、血清AFP、肿瘤数目、肿瘤大小、肝硬化及HBsAg则未见明显关系,差异无统计学意义(P>0.05)。见表1。
2.3 hnRNP L在肝癌组织中的表达与巨噬细胞极化的相关性为了探究hnRNP L在肝癌组织中的表达与巨噬细胞极化的关系,采用了免疫组织化学法对连续切片进行染色,同时Kappa一致性检验法分析用于评估二者之间的关系。结果显示TAMs标记主要在细胞质中表达,染色结果见图4。hnRNP L的表达强度与CD68(总巨噬细胞Marker)和CD206(M2巨噬细胞Marker)的浸润密度呈正向的一致性(κ=0.448,P<0.001;κ=0.455,P<0.001),但与CD11c(M1巨噬细胞Marker)的表达呈负向的一致性(κ=-0.394,P<0.001)(表2)。

图1 hnRNP L在肝癌及癌旁组织的免疫染色情况
A、C:hnRNP L在HCC组织中的表达;B、D:hnRNP L在癌旁组织中的表达;1、2:病例;A、B:×100;C、D:×400

图2 hnRNP L在20对HCC组织和癌旁组织中的相对mRNA表达水平与癌旁组织比较:***P<0.001

图3 Western blot检测hnRNP L在20对HCC组织和癌旁组织中的表达
A:在4对代表性HCC组织(T)和癌旁组织(P)中hnRNP L蛋白表达条带;B:20对HCC组织和癌旁组织中hnRNP L蛋白的表达情况;与癌旁组织比较:***P<0.001
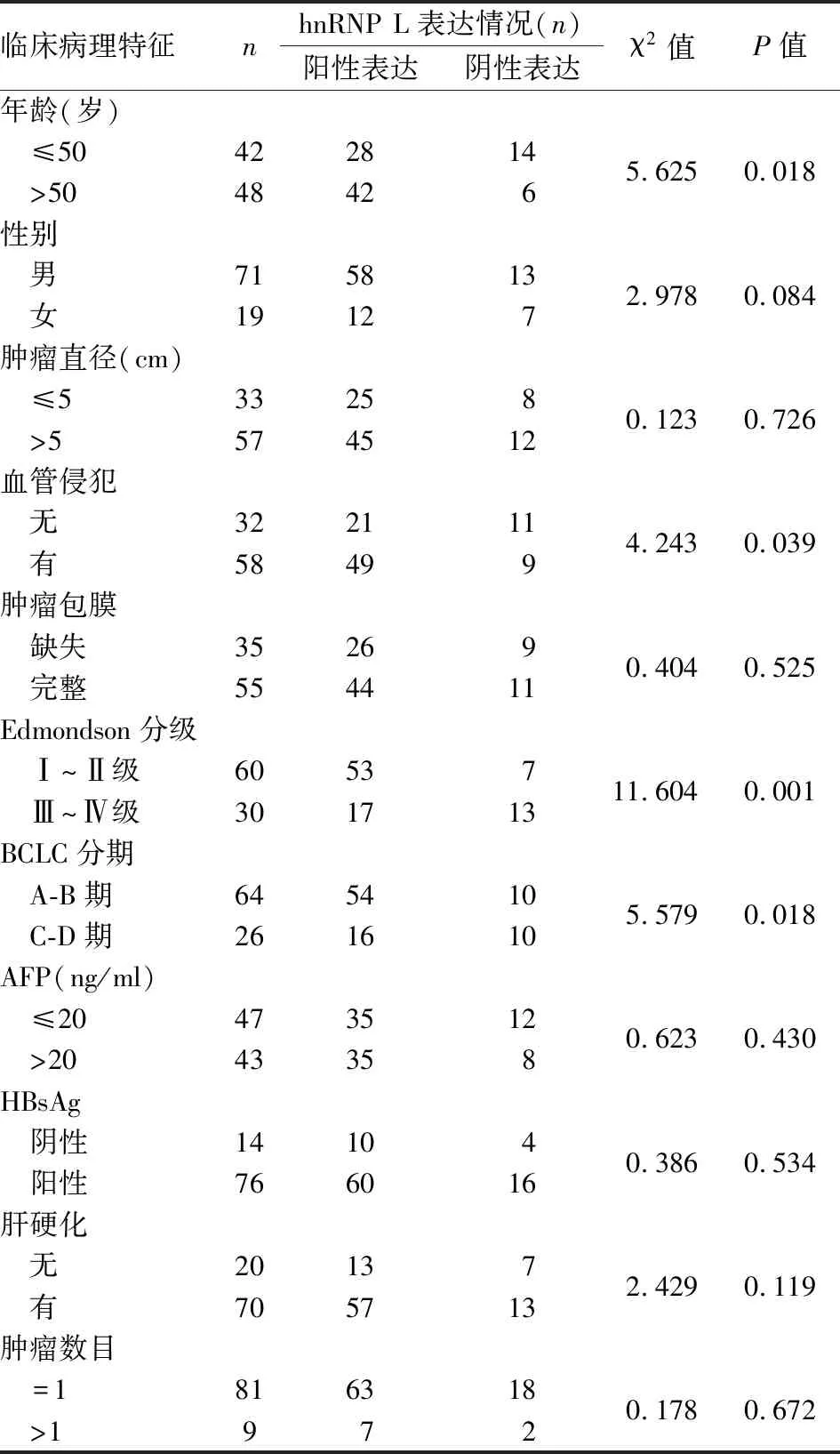
表1 hnRNP L在HCC组织中的表达与HCC患者临床病理因素之间的关系(n=90)

图4 巨噬细胞极化相关标志物在HCC组织中的免疫组织化学染色 ×400A:总巨噬细胞(CD68);B:M2巨噬细胞(CD206);C:M1巨噬细胞(CD11c)

表2 hnRNP L的表达与巨噬细胞极化之间的相关性
3 讨论
hnRNP L是一类富含甘氨酸及脯氨酸的RNA结合蛋白,也是一类剪接调节蛋白,其主要调节盒式剪接,对哺乳动物T细胞的发育和功能至关重要[6]。越来越多的研究[7-9]表明hnRNP L在多种恶性肿瘤异常高表达,与肿瘤的发生发展及侵袭转移密切相关。Goehe et al[8]发现hnRNP L在非小细胞肺癌中显著高表达,并与外显子剪接沉默相互作用,调节caspase-9前mRNA的加工,从而影响非小细胞肺癌(NSCLC)的致瘤能力。Zhou et al[7]还发现hnRNP L与前列腺癌侵袭性特征呈正相关性,并且通过影响细胞周期和固有凋亡信号,在前列腺癌中发挥促增殖和抗凋亡作用。Lv et al[9]在敲低膀胱癌细胞中的hnRNP L表达后发现可显著抑制肿瘤细胞增殖、迁移和上皮间质转化(EMT),诱导细胞凋亡和G1-S期阻滞,抑制MAPK信号通路表达调节膀胱癌细胞的命运。Liu et al[12]在胰腺癌的研究中发现hnRNP L作为一种伴侣蛋白协同lncRNA uc.345促进肿瘤进展,并对患者的生存有较好的预测作用。hnRNP L也被发现在口腔鳞状细胞癌中高表达,Jia et al[13]发现hnRNP L调节致癌剪接因子SRSF3的表达和外显子4的选择性剪接,促进肿瘤细胞的增殖和迁移同时参与G2/M细胞周期进程抑制细胞凋亡。Yau et al[10]在HCC中发现hnRNP L自身抗体的高滴度与肿瘤大小增加和生存率降低有关。
基于以往的研究,hnRNP L可能在恶性肿瘤中发挥致癌蛋白的作用。在此研究中,免疫组化、Western blot及qRT-PCR结果显示hnRNP L在HCC中的表达显著高于在癌旁组织中的表达。同时临床资料分析显示hnRNP L在HCC患者中的高表达与年龄、血管侵犯、Edmondson分级和BCLC分期等不良临床病理特征显著相关。关于hnRNP L表达水平的调节,之前的研究[6]表明,hnRNP L可通过激活其自身的毒物外显子6A复合物来自动调节其在可变剪接水平上的表达,从而介导无义衰变。因此,hnRNP L的异常表达可能与自调节环路失衡有关。但是,详细机制需要进一步研究。
hnRNP L在肿瘤中的特异性作用机制尚不清楚。以往的研究[7-9,14]表明,hnRNP L能够调节细胞周期蛋白的表达,同时参与DNA损伤反应的调控,影响肿瘤细胞凋亡。肿瘤在进展中的机制往往是多样化的,hnRNP L还可能具有调节巨噬细胞极化的作用。既往研究[4]表明M2及M1型巨噬细胞极化的失常与恶性肿瘤密切相关。在HCC主要浸润于的TAMs是M2型巨噬细胞,并促进肿瘤细胞的增殖、迁移和转移[5]。此研究初步探讨了hnRNP L与巨噬细胞极化之间的关系。结果显示,在HCC中hnRNP L的表达强度与CD68和CD206的表达强度呈正向的一致性,与CD11c呈负向的一致性。提示hnRNP L可能通过调节TAMs的极化来参与HCC进展。关于其调节通路,可能与PI3K/AKT信号通路有关。Vergadi et al[15]发现PI3K或Akt激酶的激活或过表达是巨噬细胞极化过程中必不可少的重要步骤,同时Akt1的缺失促进M1激活的上调而Akt2的缺失导致M2激活的上调。Klingenberg et al[14]发现hnRNP L可以增强Akt的磷酸化而Akt1是hnRNP L敲低后最显著调节的因子。上述研究支持了hnRNP L通过PI3K/AKT信号通路参与巨噬细胞极化调节的假设,但是还需要更深入的机制研究。此外,hnRNP L有可能不是单独起作用,一些研究[11,14]表明hnRNP L作为一种结合蛋白与lncRNA关系密切,两者通常形成复合物而共同作用。Atianand et al[11]发现lincRNA EPS联合hnRNP L可以抑制巨噬细胞对LPS介导的天然免疫应答,而其中M1巨噬细胞在应答中发挥重要作用;由lncRNA形成的调节复合物能够指导巨噬细胞等免疫谱系的发育。因此,lincRNA-EPS与hnRNP L可能共同参与巨噬细胞的极化。但其与hnRNP L在巨噬细胞极化中的关系及其特定的分子机制有待进一步研究。
此研究揭示了hnRNP L在HCC组织中的表达显著上调,并与HCC的恶性特征相关。此外,HCC中hnRNP L表达水平的增加与巨噬细胞的极化相关。然而,hnRNP L参与HCC发展的特异性分子机制及其对巨噬细胞极化的影响仍需要进一步研究。
