北京地区枸杞白粉病病原菌的鉴定
2019-10-15
(长江大学农学院,湖北 荆州 434025) (长江大学化学与环境工程学院,湖北 荆州 434023)
枸杞(LyciumchinenseMill)为茄科枸杞属的一种多年生落叶小灌木植物,是我国传统的中药材,同时还是国家卫生部公布的可药食同源的植物品种之一[1]。干燥成熟的枸杞子含类胡萝卜素、多糖、脂肪酸、黄酮和多酚等多种活性成分,此外还含有18种氨基酸及铁、磷、锂等多种微量元素,具有很高的药用价值和保健价值[2, 3]。因此,枸杞种植产业蓬勃发展,特别是我国西北地区的枸杞种植已形成产业化、商业化模式,是该地区的重要经济来源产业。近年来,由于枸杞种植面积的不断扩大,病害的发生也日益严重。其中枸杞白粉病的发生非常普遍,病害发生初期会在叶片上形成小范围白色霉斑,发生严重时枸杞植株会呈现出一片白色,阻碍植株进行光合作用及呼吸作用,最终导致植株叶片变黄、脱落甚至整株死亡[4]。调查发现,北京地区枸杞分布广泛,多分布于公园及野生自然环境,白粉病危害严重,影响了其观赏和生态价值。为此,笔者通过形态学和分子生物学方法对侵染北京地区枸杞白粉病的病原进行鉴定,旨在为白粉病的防治和其病原分类鉴定等提供科学依据。
1 材料与方法
1.1 试验材料
枸杞白粉病病原菌样品于2016年10月与2017年9月分别采自北京香山公园、北京植物园、中国农业科学院院内、八达岭长城公园等10个地方。
1.2 病原菌显微形态鉴定
采集白粉病症状严重的枸杞叶片进行病原菌显微观察:取感病严重叶片于体视镜观察,挑取白粉菌成熟闭囊壳,制备临时玻片标本,于显微镜下观察闭囊壳形态,拍照保存。
1.3 病原菌分子生物学鉴定
1.3.1 总DNA的提取
用液氮研磨感病叶片,加入提前预热的2%CTAB 1mL,混匀,65℃加热30min(间隔摇动);4℃、12000r/min离心10min,取上清,加等体积氯仿∶异戊醇(24∶1),充分混匀,4℃、12000r/min离心10min;取上清,加等体积氯仿∶异戊醇(24∶1),充分混匀,4℃、12000r/min离心10min;取上清,加等体积的异丙醇,于-20℃放置1h,4℃、12000r/min离心10min;去上清留沉淀,之后用70%乙醇清洗沉淀2次,采用真空干燥机干燥3~5min后,溶于适量无菌ddH2O中,-20℃下保存[5]。采用1%琼脂糖凝胶电泳检测所提取的总DNA的完整性。
1.3.2 ITS区域序列PCR扩增
ITS区域序列(包含internal transcribed spacer 1、5.8s ribosomal DNA gene和internal transcribed spacer 2全序列以及18s和28s ribosomal DNA gene部分序列)的PCR扩增采用专用白粉菌通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)、PM6(5’-GYCRCYCTGTCGCGAG-3’)、ITS4(5’-TCCTCCGCTTATTGATATGC-3’)、PM5(5’-TTGCTTTGGCGGGCCGGG-3’)[6],由南京金斯瑞生物科技有限公司合成。PCR反应体系20μL:模板DNA 0.5μL,引物ITS1和ITS4各1μL,2×HiFi Taq Mix 10μL,ddH2O 7.5μL。PCR反应条件:95℃预变性3min,95℃变性15s,54℃退火20s,72℃延伸1min,循环36次,72℃延伸5min。PCR产物经过1%琼脂糖凝胶电泳(含0.5μg/L EB 10μL染色)进行检测。
1.3.3 PCR产物纯化、克隆、测序
将获得的目的条带利用胶回收纯化试剂盒(参照TaKaRa DNA Fragment Purification Kit试剂盒说明)纯化后构建到PMD18-T载体上并转化至EscherichiacoliDH5α感受态细胞中,经过菌落PCR验证后,将获得的阳性克隆送至南京金斯瑞生物科技有限公司进行测序。
1.3.4 序列分析
将获得的测序在NCBI上进行BLASTn,下载与该序列同源性高的ITS序列,使用Clustal X软件进行全序列匹配,用MEGA 6.1软件对序列进行分析,基于Kimura-2-Para-meter双参数模型,采用NJ法(neighborhood-joining)构建系统进化树并分析亲缘关系。
2 结果与分析
2.1 白粉病病原菌的形态观察
白粉菌侵染枸杞后主要会感染枸杞植株叶片的两面、叶柄等部位,感染初期会在叶片上形成圆形菌斑,严重时叶片甚至整个植株都布满白色粉状物,影响植株进行光合作用(见图1(a)和图1(b)),侵染后期会产生许多黑色小粒点,即为病原菌有性世代闭囊壳(见图1(c))。成熟后闭囊壳为暗褐色,直径为110.5~168.4μm,附属丝较多并生于闭囊壳的‘赤道’部位,常相互交织在一起,长度为闭囊壳直径的0.5~1.8倍,长度为60.4~220.4μm,闭囊壳顶端1~3次二叉或三叉状分支,第一次分叉接近中部或下部,并在第一次分叉上进行第二次分叉,第二次分叉短且疏松,顶端钝圆或收缩,无色,壁薄。该闭囊壳形态与穆氏节丝壳(Arthrocladiellamougeotii(Lév.) Vassilk)有性态描述基本一致[7],所以初步鉴定其为穆氏节丝壳(A.mougeotii)。
2.2 白粉病病原菌的分子生物学鉴定
采用白粉菌通用引物ITS1和PM6、ITS4和PM5 2对引物去进行ITS区段扩增,经PCR扩增出500~750bp之间的目的片段(见图2)。通过测序和序列分析,10个采样地点的rDNA ITS序列一致,长度为593bp(GenBank登录号为MG757562.1),其中,1~30bp为部分18S rDNA序列,31~218bp为ITS1全序列,219~372bp为5.8S rDNA全序列,373~534bp为ITS2全序列,534~593bp为部分28S rDNA序列。将获得的序列于GenBank中进行BLASTn,显示其ITS序列与GenBank中的穆氏节丝壳(A.mougeotii)的ITS序列同源性大于99.8%,而与其他白粉菌ITS序列的同源性小于91.0%。

图1 枸杞白粉病的发病症状及显微形态结构
在NCBI的GenBank中搜索并下载相关白粉菌ITS序列,进行同源比对分析和构建系统进化树(见图3)。结果显示,其与节丝壳属的穆氏节丝壳中国菌株(JX546296.1、KP420475.1)、日本菌株(AB022380.1)、韩国菌株(AF455748.1)、土耳其菌株(KX017568.1)、澳大利亚菌株(AF073358.1)聚为一支,自展支持率达100%,亲缘关系最为接近,但与同族下的白粉菌(高氏白粉菌属(Golovinomyces)及新白粉菌属(Neoreysiphe)),如Golovinomycesambrosiae(KX987303.1)、Golovinomycesbiocellatus(FJ874774.1)、Golovinomycesorontii(AB769458.1)、Neoerysiphegaleopsidis(KR261582.1)、Neoerysiphegeranii(KR048092.1)等的ITS序列亲缘关系相对较远。鉴于节丝壳属只含穆氏节丝壳1个种,根据以上结果,鉴定来自北京地区的枸杞白粉病病原菌为穆氏节丝壳(A.mougeotii)。
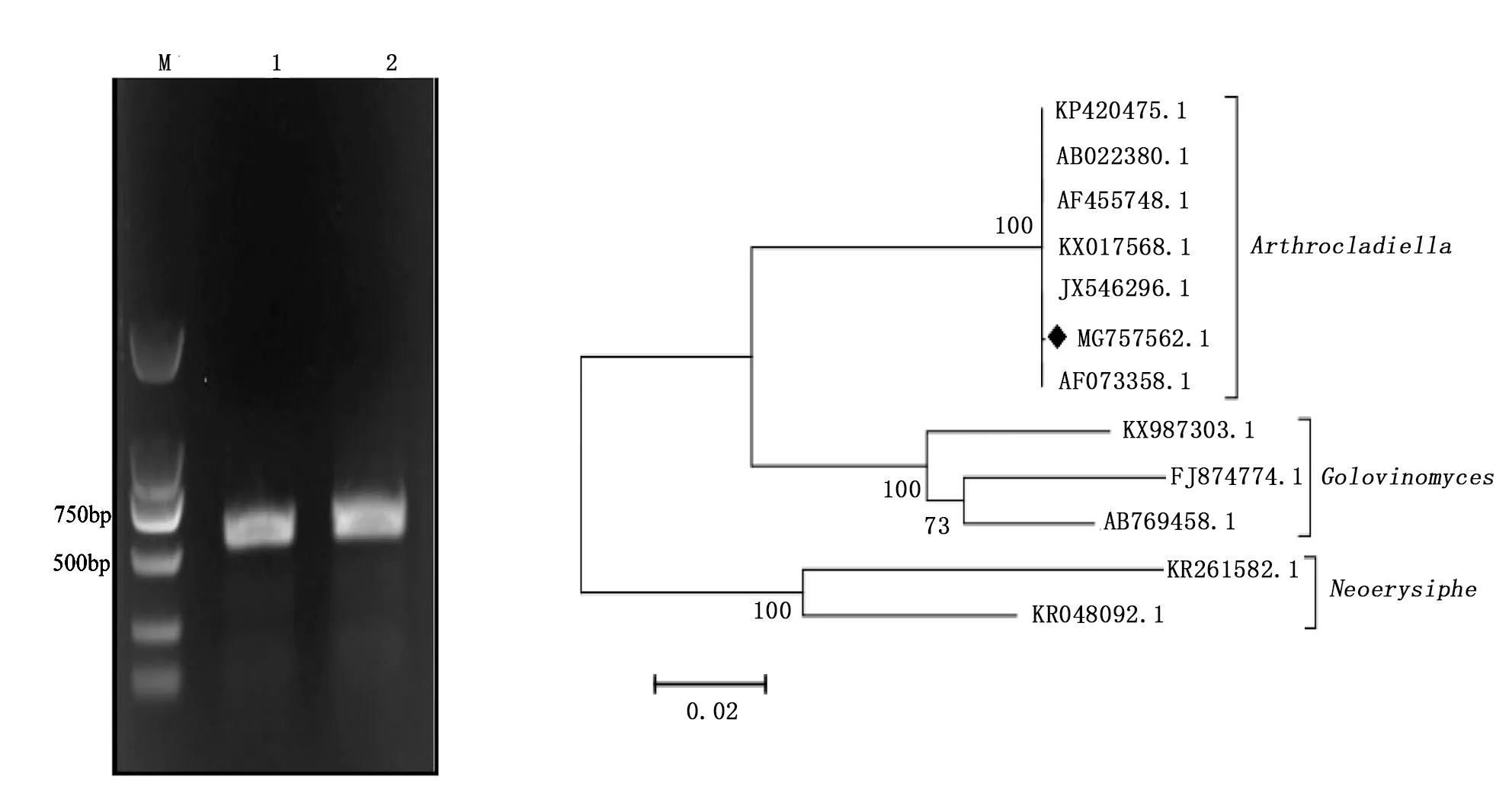
M:DL2000;1和2:ITS序列的PCR扩增产物图2 枸杞白粉病病原菌ITS的PCR扩增电泳图 图3 依据ITS序列构建的白粉病病原菌NJ系统进化树
3 讨论与结论
对来自于北京地区10个地点的枸杞白粉病病原菌进行了形态学观察,结果发现这10个地点的白粉菌有性世代闭囊壳与穆氏节丝壳(A.mougeotii)有性世代描述的特点[7]基本一致。由于穆氏节丝壳是节丝壳属下的唯一种,因此初步认为北京地区的枸杞白粉病病原菌为节丝壳属的穆氏节丝壳(A.mougeotii),这与已经报道的来自不同国家,如日本、澳大利亚、中国等地区的枸杞白粉菌菌株是一致的[8]。ITS序列作为一种遗传标记,具有明显优越性,ITS区受外界环境影响小,进化速度快,不但具有保守性而且在科、属、种水平上具有差异性,能够为病原菌的分类鉴定及系统发育等研究提供重要依据[9]。通过ITS序列比较及系统进化树分析等方法进一步鉴定北京地区枸杞白粉病病原菌,结果显示其与来自日本、韩国、土耳其等国家的枸杞白粉菌菌株的ITS序列同源性达99.8%以上,亲缘关系最为接近,在进化树中形成自展支持率为100%的分枝,由此进一步确定了该白粉菌为节丝壳属的穆氏节丝壳(A.mougeotii)。同时,由系统进化树也可以看出节丝壳属与同族的高氏白粉菌属亲缘关系相对较近,而与同族的新白粉菌属亲缘关系相对较远[10]。该研究鉴定了北京地区枸杞白粉病病原菌,对于枸杞白粉病的防治和探究高氏白粉菌族系统进化关系有着重要作用。
