Castleman病的影像学特征及临床病理表现分析
2019-10-15
(常州市第一人民医院影像科,江苏 常州 213000) (常州市第一人民医院病理科,江苏 常州 213000) (常州市第一人民医院影像科,江苏 常州 213000)
Castleman病(Castleman’s disease, CD)又名巨淋巴细胞增生症,是一种临床少见的淋巴细胞增生性疾病,因Castleman等[1]于1956年首次报道而命名。CD可发生于任何淋巴结存在的部位,临床上将发生于单个区域的淋巴结肿大称为局灶型CD(localized CD, LCD)、多个区域的淋巴结肿大称为多中心型CD(multicentric CD, MCD)。LCD多见,约占70%[2],多无明显临床症状。MCD表现为全身多处淋巴结肿大,常伴有发热、乏力、贫血、消瘦等全身症状,部分可伴有多系统受累的表现。据其病理学表现可分为透明血管型(hyaline vascular type, HV)、浆细胞型(plasma cell type, PC)及混合型。笔者回顾性分析CD患者24例临床资料,旨在提高CD术前诊断的准确率。
1 对象与方法
1.1 一般资料
回顾性分析我院2012年1月至2018年6月经病理证实的CD患者24例临床资料,其中男11例,女13例,年龄14~74岁,平均(40.0±5.4)岁。7例无明显不适,于体检时偶然发现;11例于数年或数月前无意间扪及体表肿块,其中2例于1月内就诊,9例自觉数年或数月间缓慢增大就诊;1例首发症状为胸痛、胸闷;1例咳嗽伴发热;1例下颌肿痛;1例下腹疼痛;1例咽部异物感;1例胸闷干咳。
1.2 影像学检查方法
16例行CT检查,3例行MR检查,10例行超声检查。①CT检查方法:采用GE Optima 64、Siemens Sensation 16 层螺旋CT进行扫描,管电压120kV,管电流300mA,层厚及层间距5mm。颈部及胸部患者行平扫+单期增强扫描,腹部患者行平扫+动态增强检查。对比剂采用优维显注射液(370mg/mL),注射流率3mL/s,注射剂量1.5mL/kg。颈、胸部增强于平扫后40~45s,腹部动脉期25s,静脉期75s,延迟期180s。②MR检查方法:采用Siemens Verio 3.0T MR进行扫描,平扫行TIWI横断位、T2WI横断位+冠状位及T2WI脂肪抑制序列扫描。增强采用三维容积式内插法屏气检查序列,对比剂采用Gd-DTPA(0.1mmol/kg),经肘静脉团注,注射流率2mL/s。③超声检查方法:采用GE-Logiq E9彩色多普勒超声显像仪进行检查,使用线阵探头及凸阵探头分别对颈部及腹部进行扫查,探头频率分别为8~15、3.5~5MHz,对颈部各区及腹部脏器进行扫查,对探及的病灶进行多切面、多角度观察。
1.3 图像分析
所有图像均由3名副高以上职称的高年资影像诊断医师进行阅片,对病灶位置、大小、边界、密度/信号/回声表现,强化程度/方式及周围情况进行分析评估。
2 结果
2.1 病灶位置、形态及大小
24例CD患者中,其中LCD 21例,MCD 3例。LCD患者21例中,颈部10例,腹膜后4例,纵隔2例,腋下2例,面颊部1例,咽旁间隙1例,盆腔1例。MCD患者3例中,右侧腋下及右侧腹股沟多发淋巴结肿大1例,肺门纵隔多组淋巴结肿大1例,双侧颈部多区淋巴结肿大1例。LCD患者21例中,15例为单发病灶,形态多为圆形或类圆形,少数呈不规则形,边缘有浅分叶,边界清楚;6例为主病灶周围伴多发肿大淋巴结即子灶。病灶大小不等,病灶最大径约1.5~15cm。3例MCD多发病灶呈圆形或类圆形改变,病灶最大径约0.8~4.6cm。
2.2 影像学表现
1)CT表现。行CT检查的16例患者,CT平扫示病灶均表现为软组织密度,CT值约31~56HU,平均CT值为(42±6.1)HU,多数病灶密度均匀,边界清楚,病灶多呈膨胀性生长,周围结构呈受压推移改变。其中1例腹膜后病灶中央可见斑点状及分支状钙化灶(图1(a))。1例颈部及1例盆腔病灶体积较大,密度欠均,内见斑片状低密度区(图2(a)),1例MCD可见肺门纵隔多组淋巴结肿大,两肺呈间质性肺炎改变并伴有胸腔积液(图3(a)、3(b))。5例主病灶周围可见多发子灶。CT增强示12例病灶呈显著强化,多数病灶均匀强化,增强后CT净增值约30~85HU,其中腹部病灶行动态增强检查,呈显著持续强化,其强化程度与动态变化与邻近大动脉同步(图1(b~d)),其中有5例病灶呈不均匀显著强化,内可见斑片状或裂隙样低密度区(图2(b)、2(c)),7例病灶内或周围可见迂曲增粗血管影(图2(b))。2例呈渐进性强化,静脉期及延迟期强化范围较动脉期增大。2例MCD多发病灶呈轻中度强化,强化程度低于邻近大动脉(图3(b)),另1例MCD病灶呈显著均匀强化。
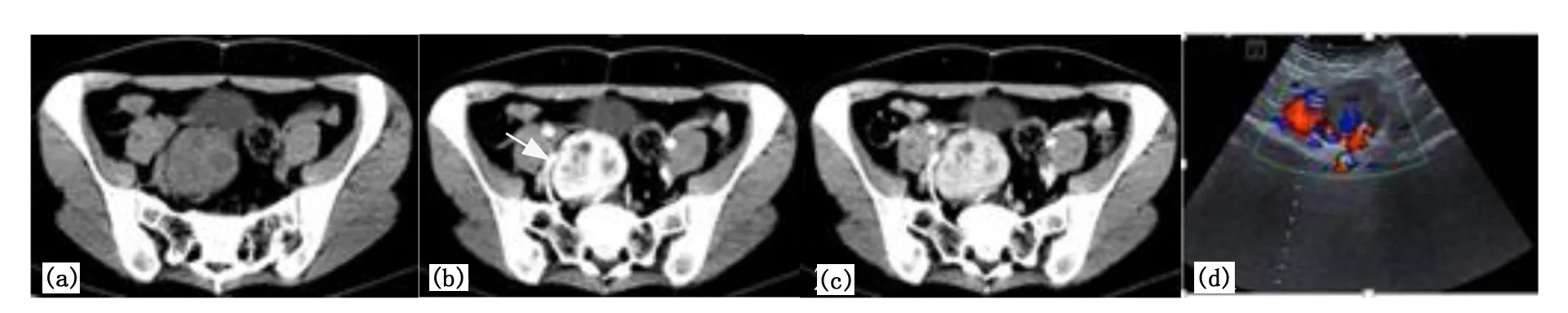
注:(a)CT平扫示盆腔右侧见类圆形不均匀软组织密度肿块,内见斑片状低密度区;(b)、(c) CT动态增强示病灶呈不均匀显著持续强化,病灶强化程度及动态变化与周围大动脉同步,病灶内可见不规则裂隙样、斑点状低密度区,病灶周围可见迂曲增粗血管影(箭头);(d)超声示不均质低回声肿块,后方回声增强,CDFI示病灶内及周围可见丰富血流信号。图2 右盆腔HV-LCD
2)MR表现。行MR检查的3例患者,MR平扫病灶T1WI呈均匀或稍低信号,T2WI呈高信号,脂肪抑制序列呈高信号,信号均匀,边界清楚(图4(a)、4(b)),2例病灶周围可见迂曲流空血管影(图4(c))。MR增强病灶均呈显著强化,增强表现与CT相仿,2例病灶周围可见迂曲增粗血管影。1例主病灶周围可见多发子灶,增强后强化程度与主病灶相似(图4(d))。
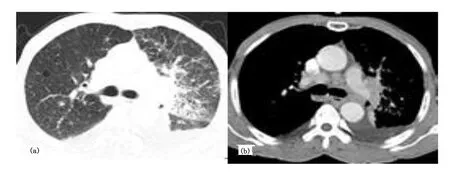
注:(a)双肺间质性肺炎改变,左肺为著;(b)纵隔肺门多组淋巴结肿大,呈轻中度强化,双侧胸腔积液。图3 胸部PC-MCD
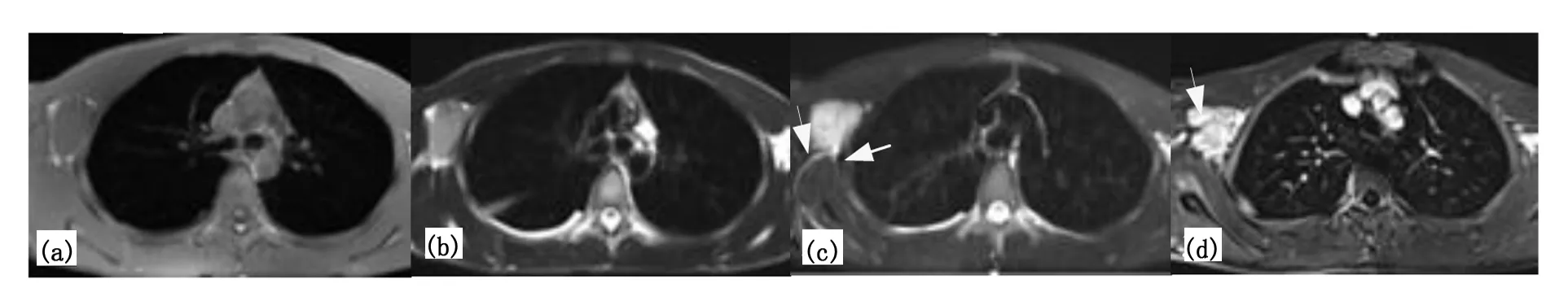
注:(a)、(b)MR平扫示右侧腋下类圆形等T1、长T2信号影,信号均匀,边界清晰;(c)脂肪抑制序列呈高信号改变,病灶边缘可见流空血管影(箭头);(d)MR增强示病灶明显强化,强化程度近主动脉,主病灶周围伴多发子灶(箭头),增强后子灶强化程度与主病灶相似。图4 右腋下HV-LCD
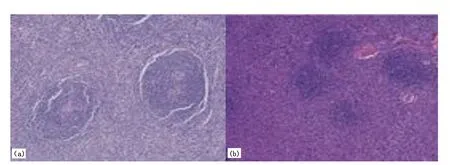
注: (a)HV镜下可见淋巴滤泡及血管增生,滤泡中心含玻璃样变性的血管,滤泡内可见同心圆样排列的淋巴细胞,呈“葱皮样”表现;(b)PC镜下可见血管增生不明显,滤泡间大量浆细胞浸润。图5 病理图像(HE, ×100)
3)超声表现。行超声检查的10例患者,8例病灶表现为圆形或类圆形不均质低回声肿块,边界清晰,可见包膜,2例呈不规则形,边缘有浅分叶。7例病灶后方回声增强。CDFI示所有病灶内部或周围可见血流信号(图2(d))。2例主病灶周围可见多发子灶,淋巴结未见融合,部分淋巴结淋巴门消失。
2.3 病理结果
经病理证实21例LCD均为HV-LCD,3例MCD中2例为PC-MCD,1例为HV-MCD。HV镜下可见淋巴滤泡内及血管增生,滤泡中心含较多玻璃样变性的毛细血管,部分滤泡内可见同心圆样排列的淋巴细胞,呈“葱皮样”表现(图5(a))。PC镜下可见血管增生不明显,滤泡间大量浆细胞浸润(图5(b))。
3 讨论
CD是一种慢性淋巴组织增生性疾病,临床少见,病因及发病机制目前尚不明确,可能与慢性炎症、自身免疫功能紊乱、病毒感染(HIV 、HHV-8、 EBV)及细胞因子调节异常如IL-6表达增加等有关[3,4],有学者[5]认为MCD的发生还可能与CD3+TCRαβ+CD4-CD8-双阴性T细胞的增加以及淋巴细胞凋亡受损有关。CD可发生于任何年龄段,以青中年多见,本组患者平均年龄(40±5.4)岁,其中3例MCD患者的平均年龄为(57±4.3)岁,明显高于本组中LCD 的平均年龄,与文献[3]报道相符。本组男11例(46%),女性13例(54%),男女发病率未见明显差异。CD可发生于任何淋巴结存在的部位,以胸部纵隔多见,约占60%,其次为腹膜后、颈部、腋下[3],而本组病灶多发生于颈部,其次为腹膜后、纵隔、腋下,与文献报道不符,可能与病例数量较少有关。
LCD最常见的病理类型是HV,约占90%,LCD中PC少见,约占8%~10%,而MCD以PC多见[2]。LCD临床多无明显症状,常于体检偶然发现或体表无意扪及,肿块较大时可出现局部压迫刺激症状,如胸痛、咳嗽、腹痛、黄疸等。本组21例LCD患者中7例于体检偶然发现,9例无意间扪及体表肿块就诊,1例因气胸引起胸痛、胸闷行CT检查时发现腋下淋巴结肿大,剩下3例皆因肿块增大压迫周围结构引起局部不适就诊。此21例LCD患者入院常规实验室检查中伴有贫血2例,余未见明显异常。MCD患者有多部位淋巴结肿大,常伴有全身症状如发热、乏力、贫血、消瘦等,及多系统受累症状如肝脾肿大、肾小球肾炎、血管炎、干燥综合征、间质性肺炎等,少数可并发Kaposi肉瘤、恶性淋巴瘤、副肿瘤性天疱疹、POEMS综合征等,实验室检查可出现贫血、血沉加快、血液丙种球蛋白增高、高γ球蛋白血症等。蒋婧瑾[6]报道胸部受累的MCD胸部病变的影像学特点主要是肺门纵隔多组淋巴结肿大、间质性肺炎和胸腔积液,间质性肺炎机理为大量浆细胞在肺间质内浸润所致。本组3例MCD患者,1例因胸闷干咳入院,胸部CT示间质性肺炎,纵隔肺门多组淋巴结肿大,胸腔积液,符合文献[6]中所示征象。实验室检查示该患者血沉加快、血常规三系减少,免疫球蛋白IgG升高、C反应蛋白升高等异常。2例为无意扪及体表肿块就诊,实验室检查未见明显异常。
影像学检查是CD术前诊断的重要方法,影像学表现与其病理类型相关。LCD常表现为孤立性圆形或类圆形肿块,边界清晰,多呈膨胀性生长,周围结构呈受压推移改变,无邻近结构浸润、破坏征象。CT平扫呈软组织密度,多数病灶密度均匀,因其血供丰富,囊变、坏死少见。本组中2例病灶CT平扫见斑片状低密度区,文献[7]报道瘤体内的斑片状或条状低密度区,病理证实为较多平行走行的纤维组织及发生玻璃样变性的血管结构,并不是缺血坏死。王仁贵等[8]认为钙化是LCD重要的特征性表现,是肿瘤内增生的血管组织玻璃样变或退变后钙质沉着所致,故形成血管样铸型的分支状或枯枝状特点,多呈中央性分布的分支状、枯枝状、斑点状或簇状,少数呈周边分布的弧形、环状或斑点状。本组病例中仅1例病灶可见钙化,呈中央性分布的分支状、斑点状钙化表现。CT动态增强病灶多呈显著持续强化,多数病灶均匀强化,动脉期显著强化,静脉期及延迟期持续强化,其强化程度与动态变化与邻近大动脉同步,呈“快进慢出”型,是LCD的特征性CT增强表现,主要是与丰富的瘤内毛细血管和瘤周供养血管有关。本组有5例病灶CT增强呈不均匀显著强化,增强后病灶内可见斑片状或裂隙样低密度区,裂隙样低密度区是LCD的另一特征,文献[9]报道增强病灶中间低密度是由于毛细血管玻璃样变、纤维化或其内皮细胞过度增生致血管狭窄、闭塞,使对比剂进入延迟或不能进入。LCD血供丰富,病灶周围可见迂曲增粗的血管,是肿块的供血动脉及引流静脉,是LCD影像学表现特征之一,本组有9例病灶可见此征象。另王仁贵等[8]认为LCD主病灶周围伴子灶也是其重要影像学特征之一,本组6例主病灶周围伴多发子灶,增强示周围子灶强化程度与主病灶相似,术后病理证实部分子灶与主灶病理改变相同,部分子灶为淋巴结反应性增生改变。MR平扫多数病灶TIWI呈均匀或稍低信号,T2WI呈高或稍高信号,脂肪抑制序列呈高信号,信号多均匀,边界清楚,病灶内或周围可见迂曲增粗流空血管影,是其特征性表现,MR增强强化表现与CT增强相仿。超声检查多数病灶呈圆形或类圆形不均质低回声肿块,包膜可见,多数病灶包膜完整,后方回声增强,CDFI示病灶内部或周围可见丰富血流信号,若见粗大血管进入病灶,可提示本病[10]。MCD中以PC多见,表现为全身多组淋巴结肿大,多数病灶密度均匀,形态规整,直径多小于LCD,增强呈轻中度强化,主要是由于PC-CD病理表现以滤泡间大量浆细胞浸润为主,毛细血管增生不明显,该组3例MCD,其中2例为PC-MCD,增强呈轻中度强化,1例为HV-MCD呈显著强化。
CD在影像学上有一定的特征性,但其发病率低,临床少见,术前诊断率较低,还需与以下疾病进行鉴别。①神经源性肿瘤:发生于颈部者多位于颈动脉鞘周围,长轴与神经走行一致,囊变坏死多见;发生于后纵隔者,多位于脊柱旁沟区,典型表现呈哑铃状,伴有椎间孔的增大。②胸腺瘤:多发生于前纵隔,常伴重症肌无力,其强化程度低于CD。③异位嗜铬细胞瘤:病灶囊变、坏死常见,增强多呈不均匀显著强化,有功能者可伴有异常波动的血压。④淋巴瘤:常呈多发改变,淋巴结增大明显,可融合成块,囊变、坏死可见,其强化程度低于CD,周围血管常见受压移位。
综上所述,CD在影像学表现上具有一定的特征性,影像学检查对于CD的术前诊断具有重要价值,结合其临床及病理表现,可提高术前诊断的准确率,减少误诊。
