可溶性MOG35-55多肽预防实验性自身免疫性脑脊髓炎机制的初步研究*
2019-10-11魏忠伟郑配国李付广
魏忠伟 郑配国 李付广#
(1 郑州大学基础医学院 河南郑州 450001;2 郑州大学第一附属医院检验科 河南郑州 450052)
髓鞘少突胶质细胞糖蛋白(Myelin Oligodendrocyte Glycoprotein,MOG)是髓鞘膜和少突胶质细胞表面最外层的膜蛋白,具有高度免疫原性,直接参与中枢神经系统体液免疫,是实验性自身免疫性脑脊髓炎(Experimental Allergic Encephalomyelitis,EAE)患者发生脱髓鞘改变的主要免疫靶点。多发性硬化(Multiple Sclerosis,MS)是一种主要累及中枢神经系统的慢性炎性脱髓鞘疾病。实验性自身免疫性脑脊髓炎可以作为多发性硬化的理想动物模型,两者具有相似的病理学特征和脱髓鞘改变[1]。目前大多数学者认为,MS 实质是自身免疫性疾病[2],发病可能与病毒感染、环境、遗传因素以及免疫学因素有关,其中免疫学因素起着关键作用[3]。即使目前对于控制MS 病情已经有许多方法,但是根治性治疗的药物尚未发现[4]。我们团队的前期研究显示,MOG35-55 多肽可以缓解实验性自身免疫性脑脊髓炎小鼠的症状,使临床评分降低,且T 淋巴细胞定向迁移可以诱导小鼠胸腺萎缩[5]。在本次研究中,我们制备实验性变态反应性脑脊髓炎小鼠模型,并予MOG35-55,观察中枢神经系统和脾效应性T 细胞(Effector T Cell,Teff)的表达变化,探讨MOG35-55 预防实验性自身免疫性脑脊髓炎的免疫学机制,以为临床治疗实验性自身免疫性脑脊髓炎提供理论依据。现报道如下:
1 材料与方法
1.1 实验动物 C57BL/6 小鼠共50 只,6~8 周龄,体质量20~25 g,由北京维通利华实验动物中心提供(许可证号:11400700058264)。小鼠饲养于河南省实验动物中心,温度20~25℃,相对湿度40%~60%。每天观察小鼠状态。
1.2 试剂与仪器 MOG35-55 溶液(1.50 mg/ml)购自上海吉尔生化公司,不完全弗氏佐剂和热灭活的结核分支杆菌溶液(5 mg/ml)由美国BD Difco 公司提供,百日咳毒素(Pertussis Toxin,PT)由北京联立信生物技术有限责任公司提供。Anti-CD4-FITC、Anti-CD8-PE、Anti-CD44-APC、Anti-CD62L-PreCP等流式抗体由eBioscience 公司提供,Mouse IFN-γ ELISA assay kit、Mouse TNF-α ELISA assay kit、Mouse IL-17 ELISA assay kit 购买于R&D Systems公司。
1.3 动物分组与模型制备(1)动物分组:50 只C57BL/6 小鼠采用随机数字表法随机抓取45 只制备实验性自身免疫性脑脊髓炎模型,余5 只为空白对照组(对照组)。(2)模型制备:将MOG35-55 溶液与灭活的结核杆菌素溶液以体积比1:1 充分混合乳化,EAE 组小鼠于双侧背部皮下注射200 μl,注射当天和注射第2 天于尾静脉注射百日咳毒素200 μg,制备实验性自身免疫性脑脊髓炎模型。模型小鼠的病程特点为进展期病情进展迅速,发病高峰期临床评分稳定且维持3 d 不变为准。第6 天开始给予模型小鼠MOG35-55 多肽[50 μg/200 μl 磷酸盐缓冲液(PBS)],随机抓取20 只小鼠作为MOG 组,每天一次性腹腔注射,连续注射10 d。剩余的25 只小鼠不做处理,为EAE 组。对照组小鼠仅于双侧背部皮下注射PBS 200 μl,注射当天和注射第2 天于尾静脉注射磷酸盐缓冲液200 μl。
1.4 临床评分 采用Kono's 5 分法对小鼠进行临床评分[6],从第2 天开始每天观察小鼠并记录小鼠状态。0 分,正常,无临床症状;0.5 分,尾部部分瘫痪;1 分,尾部完全瘫痪;1.5 分,单侧后肢无力;2 分,双侧后肢无力;2.5 分,单侧后肢瘫痪;3 分,双侧后肢完全瘫痪;3.5 分,双侧后肢完全瘫痪,单侧前肢瘫痪;4 分,四肢完全瘫痪;4.5 分,濒死状态;5 分,死亡。
1.5 HE 染色 第16 天取EAE 组小鼠脊髓组织切片进行HE 染色,同时取MOG 组小鼠脊髓组织进行HE 染色,每组3 只小鼠。2%戊巴比妥钠腹腔注射深度麻醉小鼠,待小鼠麻醉完全后,以40 g/L 多聚甲醛溶液灌注心脏处死小鼠,切取脊髓组织,固定、脱水、石蜡包埋,制备厚度不少于7 μm 的切片,行HE 染色,观察脊髓组织淋巴细胞浸润和脱髓鞘改变。
1.6 不同组织淋巴细胞计数 EAE 组小鼠选取临床评分2.5~4.0 分的小鼠,同时取MOG 组小鼠,每组3 只。心脏灌注处死小鼠,切取脑和脊髓组织、淋巴结(dLNs)和脾(SP),采用ACK 裂解液裂解红细胞,密度梯度离心法,转速1 900 r/min,离心20 min,然后轻轻吸取中间层悬状物(勿要吸取到Percoll 分离液),置于15 ml 离心管中,加入3~4 倍体积的PBS,转速1 700 r/min,离心5 min,倒掉上清液,加入PBS 重悬,制备单个核细胞悬液,于显微镜下记录T 淋巴细胞计数。
1.7 流式细胞术分析淋巴细胞表型 EAE 组小鼠选取临床评分2.5~4.0 分的小鼠,同时取MOG 组小鼠,每组4 只,首先取各组细胞计数约2×106个细胞,PBS 重悬,离心5 min,弃上清,收集细胞,加入抗 小 鼠 CD4-FITC、CD8-PE 抗 体,CD44-APC、CD62L-PerCP,进行染色。然后流式细胞术检测。利用FlowJo 软件对流式结果进行分析,观察小鼠脾脏及CNS 浸润细胞CD4、CD8、CD44、CD62L 的表达情况。
1.8 酶联免疫吸附试验检测细胞因子表达变化在第15 天时EAE 发病高峰期选取EAE 组小鼠临床评分2.5~4.0 分的小鼠,同时取MOG 组小鼠进行试验,每组4 只,然后同时提取两组小鼠脾淋巴细胞,置于含10%胎牛血清(FBS)的DMEM 培养基,37℃和5%二氧化碳环境下培养72 h,取上清液。酶联免疫吸附试验检测细胞因子白细胞介素-17(IL-17)、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)的表达变化。
1.9 统计学方法 采用GraphPad Prism7.0 统计软件进行数据处理与分析。呈正态分布的计量资料以表示,采用两独立样本的单因素方差分析,两两比较行LSD-t 检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 EAE 小鼠模型诱导成功 在没有注射MOG多肽的情况下,小鼠诱导第9 天后显示出临床症状[最高临床评分为(3.7±0.3)分],并且伴有严重的脾脏和淋巴结萎缩(见图1)。C57BL/6 小鼠双侧背部皮下注射MOG35-55 多肽乳化剂免疫,尾静脉注射PT后,EAE 小鼠病程经历进展期,到达发病高峰期,出现典型的运动系统障碍的症状,EAE 小鼠发病高峰期脊髓组织切片HE 染色显示大量炎症细胞浸润(见图2)。以上表明EAE 小鼠模型诱导成功。

图1 EAE 组和MOG 组小鼠临床评分

图2 EAE 组和MOG 组小鼠脊髓病理切片(HE,10×40)
2.2 T 淋巴细胞计数 MOG 组小鼠完全阻止了EAE 的发展和淋巴结的萎缩。SP、dLNs 及CNS 中T淋巴细胞计数见表1。随着EAE 阻止,在MOG 组中,CNS 中极少有T 淋巴细胞浸润,MOG 组:(1.5±0.2)×106个;EAE 组:(4.2±0.9)×106个(P<0.01)。
表1 MOG 组和EAE 组小鼠SP、dLNs 和CNS 中T 淋巴细胞计数(个,±s)
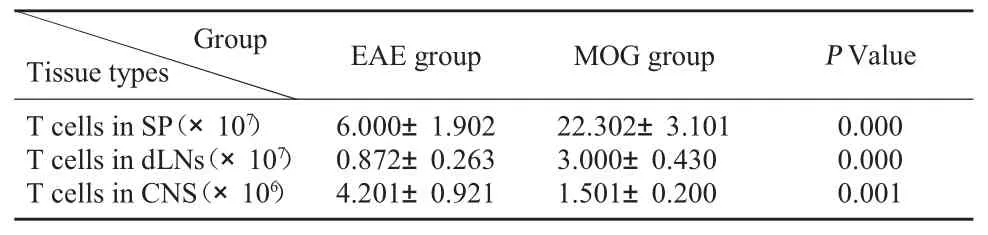
表1 MOG 组和EAE 组小鼠SP、dLNs 和CNS 中T 淋巴细胞计数(个,±s)
2.3 脾脏及中枢神经系统T 淋巴细胞表型流式细胞术分析 EAE 组和MOG 组CNS 浸润的T 淋巴细胞均由效应T 细胞(CD44highCD62Llow)和记忆T细胞(CD44highCD62Lhigh)构成:EAE 组CD4+细胞中CD44highCD62Llow占 71.5%,CD8+细 胞 中CD44highCD62Llow占68.2%;MOG 组CD4+细 胞 中CD44highCD62Llow占 73.4%,CD8+细 胞 中CD44highCD62Llow占66.9%。EAE 组脾脏中的CD4+细胞和CD8+细胞均是CD44-细胞占大多数,其中CD4+细胞中CD44-CD62Llow占50.3%、CD44-CD62Lhigh占4.88%,CD8+细胞中CD44-CD62Llow占49.7%、CD44-CD62Lhigh占11.4%;MOG 组中CD4+细胞和CD8+细胞均是CD44+细胞占大多数,其中CD4+细胞中CD44-CD62Llow占37.0%、CD44-CD62Lhigh占26.1%,CD8+细 胞 中CD44-CD62Llow占9.42% 、CD44-CD62Lhigh占47.6%。所以EAE 诱导之后,脾脏中CD4+和CD8+T 细胞被激活,但是只有较少的CD44highT 细胞群浸润到了CNS。
2.4 细胞因子IFN-γ、IL-17 和TNF-α 的分泌情况ELISA 分析 ELISA 分析发现与EAE 组相比,MOG 组细胞因子IFN-γ、IL-17 和TNF-α 的分泌均高于EAE 组,差异具有统计学意义(P<0.05)。见图3。

图3 细胞因子IFN-γ、IL-17 和TNF-α 的分泌情况ELISA 分析
3 讨论
本实验发现在第9 天EAE 组出现了典型的临床症状,并伴有严重的脾脏和淋巴结萎缩,EAE 诱导后脾脏和dLNs 淋巴细胞数量增加,在EAE 发病前10 d 达到高峰。EAE 组中,随着EAE 小鼠周围淋巴系统中T 细胞的减少,CNS 中T 细胞增多,尤其是CD4+T 细胞。随着MOG 的输注导致更多的T 细胞聚集在脾脏和dLNs 中,而不是CNS 中。在EAE进展过程中,我们还观察到在接种处偶尔出现了皮肤溃疡,文献报道这种形成溃疡的小鼠经常具有抵抗EAE 和淋巴结萎缩的能力[6]。本研究中两组中枢神经系统浸润的 T 淋巴细胞均由效应 T 细胞(CD44highCD62Llow)和记忆T 细胞(CD44highCD62Lhigh)构成。EAE 组脾脏中的CD4+细胞和CD8+细胞均是CD44-占大多数,而MOG 组中CD4+细胞和CD8+细胞均是CD44+细胞占大多数。说明EAE 诱导之后,脾脏中CD4+和CD8+T 细胞被激活,但是只有较少的CD44highT 细胞群浸润到了CNS。综上所述,可溶性MOG 可能是通过阻止效应T 细胞向中枢神经系统迁移而实现预防EAE 的发生和淋巴组织的萎缩。
