极性蛋白Par3在宫颈鳞状细胞癌中的表达及其临床意义
2019-10-10郭春凤赵骏达马俊旗
郭春凤 赵骏达 马俊旗
[摘要] 目的 探討极性蛋白Par3(Par3蛋白)在慢性宫颈炎、宫颈上皮内瘤变Ⅱ~Ⅲ(CINⅡ~Ⅲ)、宫颈鳞状细胞癌(CSCC)以及转移淋巴结组织中的表达及临床意义。 方法 选择新疆医科大学第一附属医院妇科2016年1月~2017年12月收治的CINⅡ~Ⅲ、CSCC以及因良性疾病行子宫切除术患者宫颈组织标本存档石蜡包埋组织共93例,其中慢性宫颈炎14例、CINⅡ~Ⅲ36例、CSCC 43例。另CSCC淋巴结转移灶组织标本7例。应用免疫组织化学染色法检测极性蛋白Par3在上述组织中的表达。 结果 Par3蛋白在慢性宫颈炎、CINⅡ~Ⅲ、CSCC和转移淋巴结组织中的阳性表达率分别为100.0%(14/14)、97.2%(35/36)、62.8%(27/43)、0,各组间差异均有统计学意义(P < 0.05)。CSCC中高分化组Par3蛋白100%(7/7)表达,而中低分化组的表达下调为55.6%(20/36),差异有统计学意义(P < 0.05);根据是否发生淋巴结转移分组(淋巴结转移组7例;未发生淋巴结转移组36例),Par3蛋白在淋巴结转移组宫颈组织中阳性表达率是28.6%(2/7),而非转移组为58.3%(21/36),差异有统计学意义(P < 0.05)。Par3蛋白的低表达与组织学分化和发生淋巴结转移有关,差异有统计学意义(P < 0.05)。 结论 极性蛋白Par3在慢性宫颈炎、CINⅡ~Ⅲ以及CSCC、淋巴结转移灶组织中的表达有差异,CSCC组织中表达下调,其异常低表达与CSCC发生发展有关,可以作为判断宫颈上皮内瘤变发展为CSCC预警指标以及判断CSCC恶性程度和预后的指标。
[关键词] 宫颈肿瘤;Par3蛋白;蛋白表达;宫颈上皮内瘤变
[中图分类号] R737.3 [文献标识码] A [文章编号] 1673-7210(2019)07(c)-0093-04
Expression of polar protein Par3 in cervical squamous cell carcinoma and its clinical significance
GUO Chunfeng ZHAO Junda MA Junqi
Department of Gynecology, the First Affiliated Hospital of Xinjiang Medical University, Xinjiang Uygur Autonomous Region, Urumqi 830011, China
[Abstract] Objective To explore the polarity protein Par3 (Par3 protein) in chronic cervicitis, cervical intraepithelial neoplasia Ⅱ-Ⅲ (CINⅡ-Ⅲ), cervical squamous cell carcinoma (CSCC) and the expression differences in metastasis lymph node tissue and its clinical significance. Methods From January 2016 to December 2017, Xinjiang Medical University First Affiliated Hospital of CINⅡ-Ⅲ CSCC, as well as the line of hysterectomy for benign disease patients with cervical tissue samples archived paraffin embedding tissue, a total of 93 cases were seleeted from Department of Gynaecology. Among them 14 cases of chronic cervicitis, 36 cases of CINⅡ-Ⅲ, and 43 cases of cervical squamous cell carcinoma. Another 7 cases of cervical squamous cell carcinoma lymph node metastasis tissue samples. The expression of polar protein Par3 in the above tissues was detected by immunohistochemical staining. Results The positive expression rate of Par3 protein in chronic cervicitis, CINⅡ-Ⅲ, CSCC and metastasis lymph node tissues were 100.0% (14/14), 97.2% (35/36), 62.8% (27/43), 0 respectively, the differences between each group had statistical significance (P < 0.05). The Par3 protein expression was 100% (7/7) in the high differentiation group of CSCC, while the expression was down-regulated to 55.6% (20/36) in the low and medium differentiation group, with statistically significant difference (P < 0.05). They were grouped according to whether lymph node metastasis had occurred (7 cases in lymph node metastasis group 36 cases in the group without lymph node metastasis. The positive expression rate of Par3 protein in cervical tissues of the lymph node metastasis group was 28.6% (2/7), while that of the non-metastasis group was 58.3% (21/36), with statistically significant difference (P < 0.05). The low expression of Par3 protein was correlated with histological differentiation and lymph node metastasis, and the difference was statistically significant (P < 0.05). Conclusion Polarity protein Par3 in chronic cervicitis, CINⅡ-Ⅲ CSCC and are differentially expressed, the expression of CSCC is down-regulated, and its abnormal low expression is related to the occurrence and development of CSCC, which can be used as an early warning indicator to judge the development of cervical intraepithelial neoplasia into CSCC, as well as an indicator to judge the malignancy degree and prognosis of CSCC.
[Key words] Uterine cervical neoplasms; Par3; Protein expression; Cervical intraepithelial neoplasia
近年来,我国宫颈癌的发病率呈现明显上升趋势,流行病学调查表明,发病率可达(274~483)/10万[1]。宫颈癌侵袭转移率高是该病病死率高的主要原因,晚期宫颈癌患者治疗的效果和预后很差,5年生存率也较低[2]。目前,研究[3]证明肿瘤细胞发生侵袭迁移,极性蛋白异常的表达(缺失或上调)被视为最为关键的原因。细胞间相互连接作用减弱,肿瘤细胞极性发生紊乱,细胞间黏连减弱或丢失,细胞骨架遭到破坏并重构,细胞获得了间质细胞形态和特性,引发上皮-间质转变(epithelial-mesenchymal transition,EMT)。这其中极性蛋白复合物Par3-Par6-aPKC在上皮肿瘤侵袭转移过程中发挥着重要的功能,Par3是复合物中的最为关键组分[4]。研究[5-7]证实极性蛋白Par3在乳腺癌、原发性食管癌及胰腺癌中低表达;且与肿瘤的低分化、转移及总生存期相关。但是在肝癌、前列腺癌及肾透明细胞癌等组织中,Par3蛋白阳性表达率却高于正常组织,且与患者低生存率正相关[8-9]。因Par3蛋白在宫颈鳞癌中的表达研究甚少,故采用免疫组织化学方法测定慢性宫颈炎、宫颈上皮内瘤变Ⅱ~Ⅲ(CINⅡ~Ⅲ)以及宫颈鳞状细胞癌(CSCC)、淋巴结转移灶组织中Par3蛋白的表达,分析其与临床病理参数的关系,探讨Par3蛋白在CSCC的发生、发展和转移中的作用机制。
1 对象与方法
1.1 研究对象
选取新疆医科大学第一附属医院(以下简称“我院”)2016年1月~2017年12月慢性宫颈炎、CINⅡ~Ⅲ和CSCC患者的石蜡包埋组织93例,另7例CSCC患者淋巴结转移灶组织标本。其中慢性宫颈炎14例,CINⅡ~Ⅲ36例,CSCC 43例(按国际妇产科联盟(FIGO)2009年的标准进行分期:≤ⅠB 16例,>ⅡA 27例。病理分级:高分化鳞癌7例,中低分化鳞癌36例)。所有标本经我院病理科2位副主任医师复审确诊。本研究获我院医学伦理委员会批准,标本提供者均知情同意。
纳入标准:经病理组织活检确诊为CSCC、CINⅡ~Ⅲ以及慢性宫颈炎患者。
排除标准:①合并其他恶性肿瘤者;②妊娠期及哺乳期患者;③宫颈癌诊断不明确者④宫颈鳞癌术前应用放疗、化疗者或免疫治疗者;⑤临床病例资料不完整者。
1.2 抗体和试剂
SP试剂盒及DAB显色剂均购买自北京中杉金桥公司。鼠抗人Pard3抗体(1∶300稀释,Santa Cruz公司)。
1.3 方法
1.3.1 免疫组化SP法检测不同组织中Pard3蛋白表达 切片采用常规二甲苯脱蜡,梯度酒精水化,再用微波炉进行抗原修復,加入适量的H2O2阻断内源性过氧化物酶,最后加入一抗,置入4℃冰箱过夜(磷酸盐缓冲溶液(PBS)作阴性对照。第2天再加二抗(各步间隔PBS缓冲液冲洗10 min)。用DAB显色,苏木精复染后再常规脱水、透明封片待用。
1.3.2 结果判断 选择2位病理科副主任医师,采取双盲法判读免疫组化的结果,采用阳性细胞数计数和染色程度综合判断表达结果。在光学显微镜下(200×)观察全视野的细胞,并且计数阳性细胞数所占上皮细胞的比例。根据所占比例判读记分,阳性细胞数<5%记0分,5%~25%记1分,>25%~75%记2分;>75%记3分。染色强度判定:完全不显色或显色不明显为0分,淡黄色为1分,棕黄色为2分,深棕色视为3分。综合积分=(染色细胞分数+染色强度分数)/2。综合判定:如积分<0.5分则为表达缺失,0.5~1.5分为表达下调,积分>1.5分视为正常表达[10]。
1.4 统计学方法
采用SPSS 17.0软件对所得数据进行统计分析,计数资料采用百分率表示,组间比较采用χ2检验以及Fisher精确概率法,以P < 0.05为差异有统计学意义。
2 结果
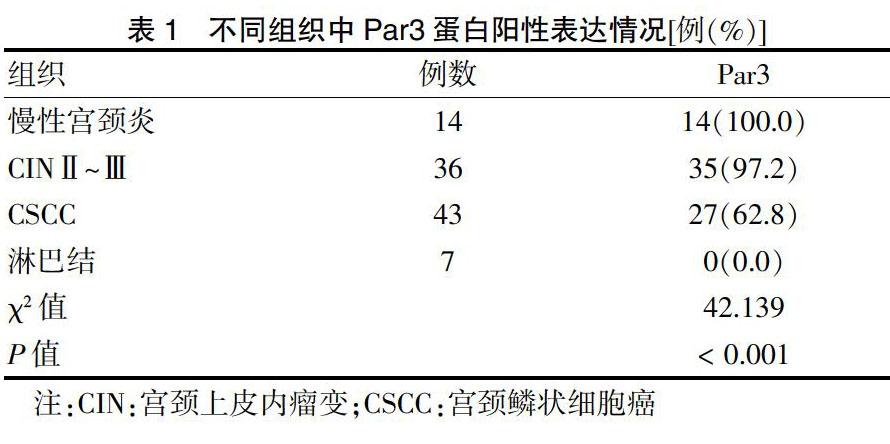
2.1 Par3蛋白在慢性宫颈炎、CINⅡ~Ⅲ、CSCC以及转移淋巴结组织中的表达
与慢性宫颈炎组织比较,CINⅡ~Ⅲ和CSCC组织中Par3阳性表达率明显减少,转移淋巴结组织中表达缺失,各组间差异有统计学意义(P < 0.05)。见表1。免疫组织化学检测结果显示,Par3阳性表达主要定位在细胞质,阳性细胞染色呈深黄色或棕黄色。见图1(封四)。
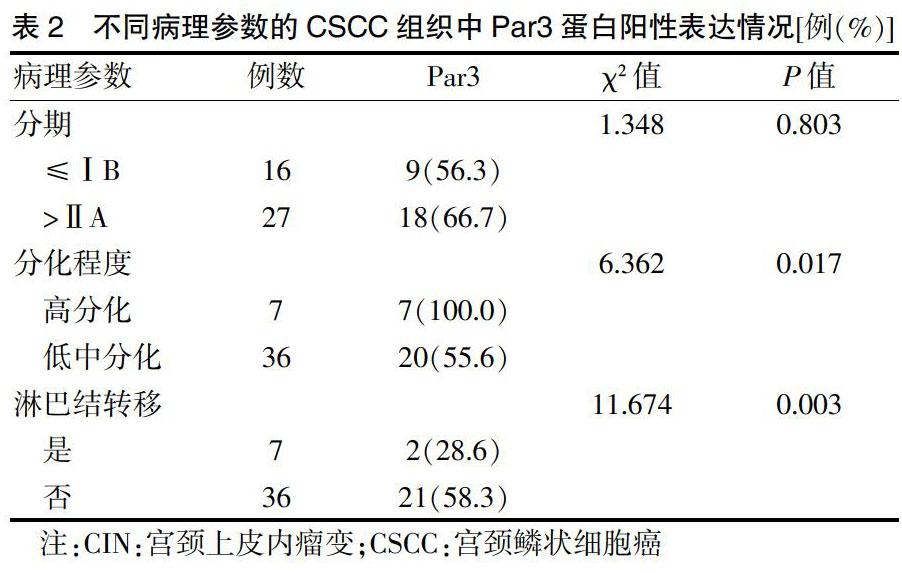
2.2 CSCC组织中Par3蛋白阳性表达与临床病理参数的关联性分析
Par3蛋白的阳性表达量与CSCC的组织学分化相关,高分化宫颈癌组织中阳性表达率高于中低分化宫颈癌组织,差异有统计学意义(P < 0.05)。Par3蛋白在淋巴结转移宫颈癌组织中的表达低于淋巴结未转移组宫颈组织,差异有统计学意义(P < 0.05)。见表2。
3 讨论
研究[11-12]指出,在哺乳动物的上皮细胞顶端侧膜上存在Par3-Par6-a PKC聚合体定位,其主要作用是保持上皮细胞紧密连接(tight junction,TJ),维持细胞的正常极性,在TJ形成时,极性蛋白Par3承担锚定蛋白及脚手架蛋白的作用,招募Par6或aPKC蛋白共同定位。研究[11,13]证实Par3蛋白过表达或缺失都会破坏TJ,同时Par6、aPKC和TJ蛋白也会定位错误,Par3蛋白的骨架作用被破坏,细胞极性丢失。伴随Par3表达或定位错误,许多生长类因子异常渗入通过自分泌或旁分泌形成了肿瘤微环境,诱导上皮细胞发生肿瘤化[14]。
Bilder[15]将果蝇设计成模型,研究使细胞极性丢失,上皮细胞的增殖会失调,从而促进肿瘤的形成。研究[16-17]发现,Par复合体主要表达于细胞之间的TJ处,aPKC与Par3/Par6的相互作用是细胞极性发生的关键因素,复合体的稳定性主要由Par3承担。一旦Par3丢失或定位错误,细胞将发生增殖失调。许多有关上皮肿瘤的研究也证实了极性蛋白是众多肿瘤调控因子之一,各种原因导致的丢失或错误定位诱导上皮细胞增殖失调,促进乳腺癌、前列腺癌等的发生,甚至在肿瘤细胞侵袭转移过程当中也起到尤为关键的作用。故对于上皮肿瘤的早期判断指标将细胞的极性丢失以及组织架构紊乱列为首要标准。目前,人类肿瘤发生发展的热点研究逐渐聚焦极性蛋白的始动因素,其中大多数集中在乳腺癌和消化道肿瘤领域。本研究通过检测慢性宫颈炎、CINⅡ~Ⅲ以及CSCC和转移淋巴结组织中Par3蛋白的表达水平,分析蛋白水平表达差异与CSCC发生是否有关,以及其与CSCC病理参数的关系。
Mescher等[18]一项有关恶性黑色素瘤研究显示,表皮极性蛋白Par3低表达促进恶性黑色素瘤细胞的分化、运动和增殖,在自体黑色素瘤模型中,导致肿瘤形成并增加肺转移率。Par3低表达或缺失可以上调表皮P-cadherin,这对促进黑色素瘤细胞增殖和表型分化至关重要。即上皮低表达Par3和高P-cadherin表达与人类黑色素瘤进展相关,且后者与黑色素瘤患者生存期降低相关。鳞癌组织中的Par3较正常组织明显低表达,低表达的Par3与肿瘤淋巴结转移和低分化肿瘤相关[6]。本研究结果与之相同。胰腺癌组织中发现,在Par3/Par6/aPKC复合物中仅Par3蛋白低表达,Par3蛋白高表达的患者总生存期长于低表达组[7]。Par3蛋白表达升高与前列腺癌转移呈正相关。Par3的下调在体外抑制前列腺癌细胞的迁移和侵袭,在体内抑制肿瘤的转移,而过表达Par3则产生相反的结果。在卵巢癌中Par3表达也是升高的,其机制是通过调控IL6/STAT3通路促进卵巢癌的发生及转移[19]。由此可见,Par3蛋白表达可能与肿瘤中的发生、发展及肿瘤分类相关,不同肿瘤组织中其表达也或高或低,其促癌或抑癌的作用机制尚需进一步探究。
本研究中Par3蛋白在慢性宫颈炎组织中阳性表达率为100.0%,CINⅡ~Ⅲ、CSCC以及转移淋巴結组织中分别为97.2%、62.8%、0.0%。在宫颈疾病由宫颈炎症、CIN发展至CSCC,甚至盆腔淋巴结转移的疾病进程中,Par3蛋白的阳性表达率逐渐降低。CSCC组织中低表达,而转移淋巴结组织中甚至是表达缺失。因此,我们可以将Par3蛋白表达下调视为细胞间变或者发生恶性变的早期预警信号。对Par3表达水平与CSCC的临床病理参数的关联性进行分析,显示Par3的阳性表达率与肿瘤的组织学分化及淋巴结转移有关。Par3蛋白低表达,细胞之间的黏连遭到破坏、同时细胞极性丢失,细胞之间连接松散细胞分化发生改变,直至细胞异常增殖恶性变。由此推测Par3蛋白是作为CSCC的抑制因子参与疾病发生发展,同时可能与CSCC组织学分化以及淋巴结转移有关,也可视为CSCC术后预后不良的重要因素之一。本研究7例转移淋巴结组织中Par3蛋白表达缺失,推测Par3蛋白低表达甚至表达缺失可能与肿瘤侵袭及淋巴结转移有关。故临床中Par3蛋白低表达甚至表达缺失,提示肿瘤的细胞恶变程度和淋巴结转移的可能性大。Zheng等[20]也认为CSCC的发生与Par3蛋白的表达降低有关。Par3蛋白表达缺失促进细胞增殖,抑制细胞凋亡,促进迁移和侵袭。Par3的缺失导致SiHa细胞中MMP9的表达和EMT相关基因(N-cadherin、E-cadherin、a-catenin)表达的改变。认为Par3蛋白低表达可以作为宫颈癌患者预后不良的标志,其机制可能是通过增强EMT促进肿瘤的发生[19]。本研究因纳入样本量少,尚需进一步扩大样本量研究转移淋巴结组织中Par3蛋白表达与CSCC不良预后的相关性。Par3蛋白作为众多极性蛋白之一,与其他极性蛋白以及下游通道之间一定存在相互调节、诱导甚至拮抗作用,从而促使肿瘤微环境形成。
Par3蛋白作为多个极性蛋白家族成员之一,可调控细胞极性,在多种肿瘤中Par3蛋白异常表达。本研究得出Par3蛋白在CSCC组织中低表达,并与肿瘤的组织学分化及淋巴结转移有关。推测Par3蛋白低表达与CSCC发生有关,并在肿瘤的组织学分化、侵袭转移中有重要的作用。但因本研究仅为组织学的蛋白表达研究,进一步需设计细胞和动物水平的研究,探究极性蛋白Par3低表达在CSCC发生发展的机制,希望丰富CSCC发生发展、侵袭转移的实验依据。
[参考文献]
[1] Yang BH,Bray FI,Parkin DM,et al. Cervical cancer as a priority for prevention in different world regions:anevaluation using years of life lost [J]. Int J Cance,2004,109(3):418-424.
[2] Mezei AK,Armstrong HL,Pedersen HN,et al. Cost-effectiveness of cervical cancer screening methods in low-and middle-income countries:A systematic review [J]. Int J Cancer,2017,141(3):437-446.
[3] Etienne-M anneville S. Polarity proteins in m igration and invasion [J]. Oncogene,2008,27(55):6970-6980.
[4] Xue B,Krishnamurthy K,Allred DC,et al. Loss of Par3 promotes breast cancer metastasis by compromising cell cell cohesion [J]. Nat Cell Biol,2013:15(2):189-200.
[5] Lin WH,Asmann YW,Anastasiadis PZ. Expression of polaritv genes in human cancer [J]. Cancer Inforrn,2015,14(suppl 3):15-28.
[6] Zhou PJ,Wang X,An N,et al. Loss of Par3 promotes prostatic tumorigenesis by enhancing cell growth and changing cell division modes [J]. Oncogene,2019,38(12):2192-2205.
[7] Guo X,Wallg M,Zhao Y,et al. Par3 reglulates invasion of pancreatic cancer cells via interaction with Tiaml [J]. Clin Exp Med,2016,16(3):357-365.
[8] Zhou PJ,Xue W,Peng J,et al. Elevated expression of Par3 promotes prostate cancer metastasis by forming a Par3/aPKC/KIBRA complex and inactivating the hippo pathway [J]. J Exp Clin Cancer Res,2017,36(1):139.
[9] Dugay F,Le Goff X,Rioux-Leclercq N,et al. Overexpression of the po1arity protein PAR-3 in clear cell renal cell carcinoma is associatedwith poor pmrognosis [J]. Int J cancer,2014,134(9):2051-2060.
[10] 趙志华,田研,陈奎生.多发性骨髓瘤中c-myc和MDM2蛋白的表达及其临床意义[J].临床与实验病理学杂志2017,33(2):165-168.
[11] Joberty G,Petersen C,Gao L,et al. The cell-polarity protein Par6links Par3 and atypical protein kinase C to Cdc42 [J]. Nat Cell Biol,2000,2(8):531-539.
[12] Forteza R,Wald FA,Mashukova A,et al. Par-complex a PKC andPar3 cross -talk with innate immunity NF-κB pathway in epithelialcells [J]. Biol Open,2013,2(11):1264-1269.
[13] Soriano EV,Ivanova ME,Fletcher G,et al. aPKC inhibition by Par3CR3 flanking regions controls substrate access and underpins Apical-junctional polarization [J]. Dev Cell,2016,38(4):384-398.
[14] Soler AP,Miller RD,Laughlin KV,et al. Increased tight junctional permeability is associated with the development of coloncancer [J]. Carcinogenesis,1999,20(8):1425-1431.
[15] Bilder D. Epithelial polarity and proliferation control:Links from the Drosophila neoplastic tumor suppressors [J]. Genes Dev 2004,18(16):1909-1925.
[16] Gzalez-Mariscal L,Miranda J,Ortega-Olvera JM,et al. Involvement of Tight Junction Plaque Proteins in Cancer [J]. Current Pathobiology Reports,2016(3):1-17.
[17] Guyer RA,Macara IG. Loss of the polarity protein PAR3 activates STAT3 signaling via an atypical protein kinase C(aPKC)/NF/κB/interleukin-6(IL-6) axis in mouse mammary cells [J]. J Biol Chem,2015,290(1/3):8457-8468.
[18] Mescher M,Jeong P,Knapp SK,et al. The epidermal polarity protein Par3 is a non-cell autonomous suppressor of malignant melanoma [J]. J Exp Med,2017,214(2):339-358.
[19] Nakamura H,Nagasaka K,Kawana K,et al. Expression of Par3 polarity Protein correlates with poor prognosis in ovarian cancer [J]. Bmc Cancer,2016,16(1)897.
[20] Zheng JH,Jiao SJ,Na L,et al. Defective expression of polarity protien Par3 promotes cervical tumorigenesis and metastasis [J]. Eur J Gynaecol Oncol,2017,38(2):199-206.
