花生硬脂酰-ACP酸脱饱和基因FAB2表达的分子机制
2019-10-10李海芬李少雄陈小平梁炫强洪彦彬
刘 浩 鲁 清 李海芬 李少雄 陈小平 梁炫强 洪彦彬
花生硬脂酰-ACP酸脱饱和基因表达的分子机制
刘 浩 鲁 清 李海芬 李少雄 陈小平 梁炫强*洪彦彬*
广东省农业科学院作物研究所 / 广东省农作物遗传改良重点实验室, 广东广州 510640
位于油酸合成通路的上游, 编码硬脂酰-ACP脱饱和酶, 调控硬脂酸(C18:0)向油酸(C18:1)转化。本研究发现高油酸品种开农176种子发育前期的表达量升高, 而成熟期油酸过量积累会抑制的表达。利用开农176与开农70构建F2杂交群体, 发现当植株油酸含量超过60%时会从整体水平上抑制的表达。种子发育前期, 油酸不断积累会导致过氧化物酶活性升高, 并且活性氧含量随之增加; 但是在种子发育后期均降低, 该结果与的表达量变化趋势相同。亚细胞定位结果表明,与分别定位于叶绿体与内质网。编码区序列多态性分析显示, 该蛋白序列氮端的氨基酸结构缺失可能会导致硬脂酸含量升高。启动子序列存在大量AT碱基的富集区域, 并且含有光响应、激素调控、转录因子结合的保守顺式元件。本研究发现过量积累的油酸会激活过氧化物酶介导的活性氧信号途径, 进而通过细胞核内的未知转录因子调节上游基因的表达量, 该结果不仅拓展了对的功能认知, 也为培育高油酸花生品种提供了相关的理论指导。
花生; 高油酸;; ROS; 反馈调节
油酸分子为18碳烯酸, 因第9位与第10位碳原子间存在双键而形成单不饱和脂肪酸, 且第12位碳原子继续脱氢后会生成亚油酸。()基因位于油酸合成通路的下游, 是控制油酸(C18:1)向亚油酸(C18:2)转化的关键因子[5]。花生的2种隐性突变型与可阻断油酸向亚油酸转化, 是调控花生高油酸性状的主要基因。基于此原理, 通过选育携带基因的品种, 是目前花生高油酸育种的主要策略[6]。经过多年探索, 我国已培育出诸多油酸含量(油酸/总脂肪酸)高于70%的花生品种, 例如花育32、开农176、冀花16、桂花37等[7]。
对培育高油酸花生做出了巨大贡献, 而调控油酸合成的上游基因并未被广泛应用于育种实践。[8](Stearoyl-ACP Desaturase 2)编码存在于质体与细胞基质内的可溶性硬脂酰-ACP脱饱和酶, 在18碳脂肪酸长链的C9和C10之间加入双键(图1-A), 将硬脂酰-ACP转化为油酰ACP后, 机体利用乙酰辅酶A转运途径将油酰-ACP输入内质网继而合成油酸, 该反应决定了植物体内油酸的含量[8]。多数高等植物中,呈现组织特异性表达, 且在发育的种子内表达量比其他组织要高[9]。此外,兼具调控多种植物生理生化反应的功能。拟南芥突变体内硬脂酸(C18:0)含量增加, 油酸(C18:1)含量降低, 结果增强了水杨酸与茉莉酸介导的抗病反应[10]; 敲除水稻的基因, 植株提高了稻瘟病及白叶枯抗性[11-12]; 过量表达小麦同源基因, 转基因拟南芥植株对白粉病的抗性降低[13]。研究表明, 在花生克隆的3个同源基因中,与在种子中表达量较高, 随着种子发育两者表达水平持续升高; 而在花中的表达量较高, 只在种子发育的早期呈现上调表达趋势; 并且异位表达花生可提高酵母体内的油酸含量[14]。但是, 花生基因的研究尚处于基因克隆阶段, 具体分子功能研究相对滞后。因此, 充分解释在花生种子发育阶段调控油酸合成的分子机制, 有助于为高油酸育种提供理论指导, 该基因可能是继续提高油酸含量的潜在突破点。
花生为异源四倍体豆科植物, 其油酸合成的蛋白调控网络仍不清楚。鉴于此, 本课题组前期以花生高油酸品种开农176 (Kainong 176, KN176)与对照种开农70 (Kainong 70, KN70)为材料, 采用ITRAQ (Isobaric Tags for Relative and Absolute Quantitation)技术分析种子动态发育的差异蛋白, 发现在开农176中, 种子成熟阶段高度积累的油酸可能反馈抑制上游关键限速酶基因的表达量[15], 即生成产物抑制限速酶活性, 而反馈抑制的具体原因并不清楚, 本研究则针对该问题进行深入研究。
1 材料与方法
1.1 花生材料
花生普通品种开农70与高油酸品种开农176种子均由开封市农林科学院谷建中研究员提供, 相同栽培条件下, 分别在2个品种果针入土后的第20、30、40、50、60、70 d (day after flowering, DAF)取发育的种子开展相关研究[15]。利用2个品种构建F2代杂交群体, 该群体单株油酸含量变异幅度为40%~75%。本研究所用到的种质资源均有国家油料改良中心南方花生分中心提供。
1.2 种子总RNA提取及RT-PCR分析
花生种子经液氮研磨后, 取0.1 g粉末, 利用Invitrogen的TRIZOL试剂提取总RNA。取1 μg RNA,利用TOYOBO的FSK-100 cDNA反转录试剂盒合成第一条单链cDNA备用。荧光定量PCR的总反应体积为20 µL, 所用试剂为SYBR Premix Ex(TaKaRa, 中国大连), 仪器为ABI StepOne Plus系统。所用的荧光定量引物由Invitrogene公司合成, 利用2–ΔΔCT进行计算差异基因表达倍数[16]。内参基因为(F: 5¢-GACGCTTGGCGAGATCAACA-3¢, R: 5¢-AACCGGACAACCACCACATG-3¢),荧光定量引物为F: 5¢-TACTTGATTGGCTCTGGAATGGA T-3¢, R: 5¢-TTCTTCCTCATCATGTCAGCAA-3¢。
1.3 过氧化物酶活性及活性氧H2O2含量测定
花生种子经液氮研磨至粉末状, 取300 mg粉末转移至5 mL离心管, 4 mL 0.05 mol L-1PBS缓冲液(pH 7.8)重悬, 10,000 ×离心沉淀15 min, 转移上清溶液至新的5 mL离心管。POD活性表示为体外降解H2O2的速率, 愈创木酚作为氢离子供体, 436 nm波长下用分光光度计检测愈创木酚氧化酶颜色的变化速率。采用铁二甲酚橙方法测定过氧化氢含量。预冷的丙酮研磨花生种子, 过滤掉残渣, 用CCl4-CHCl3抽提上清液, 转移至新的离心管中, 加入250 μmol L-1硫酸亚铁铵盐、100 μmol L-1山梨醇、100 μmol L-1二甲酚橙和25 mmol L-1的浓硫酸, 混合后黑暗室温下反应30 min, 测量溶液在560 nm波长下的吸光度[17]。
1.4 亚细胞定位
与不含终止密码子的全长编码序列克隆到载体pNA580 (p35S-GFP)上, 将构建好的质粒转化大肠杆菌DH5α, 利用DNA提取试剂盒(Omega)提取大肠杆菌质粒, Nanodrop-1000检测-GFP与-GFP质粒浓度, 约30 μg μL-1。将拟南芥叶片切成细丝, 加入酶解液[含1.5% Cellulase RS (w/v)、0.75% Macerozyme R-10 (w/v)、0.6 mol L-1mannitol、10 mmol L-1MES、10 mmol L-1CaCl2、0.1% BSA; pH 5.7]游离5 h, 用W5溶液(含有154 mmol L-1NaCl、125 mmol L-1CaCl2、5 mmol L-1KCl、2 mmol L-1MES; pH 5.7)洗涤原生质体2次, MMG溶液(含有0.4 mol L-1mannitol、15 mmol L-1MgCl2、4 mmol L-1MES; pH 5.7)重悬。加入10 μL-GFP与-GFP质粒经40% PEG-4000介导共同转化拟南芥原生质体, 16 h后使用激光共聚焦显微镜Carl Zeiss LSM 780检测观察。-GFP引物为F: 5¢-GTTGTTACTAGTATGGCTCTGAGGCTG AACCCTAAC-3¢, R: 5¢-GTTGTTCCCGGGGAGTTG CACTTCCCTATCGTAAAT-3¢;-GFP引物为F: 5¢-GTTGTTTCTAGAATGGGAGCTGGAGGGCGTGTCACT-3¢, R: 5¢-GTTGTTGGATCCGAACTTGTTC TTGTACCAATAAAC-3¢。
1.5 脂肪酸含量测定
脂肪酸含量检测采用国标GB/T 17377-2008/ ISO 5508:1990。100 mg的花生种子经液氮研磨成粉末状, 加1.5 mL氯仿/甲醇(2∶1, v/v)与100 μL内标C17:0 (1 mg mL-1)溶液, 超声波辅助提取30 min, 12,000 ×离心6 min, 取1 mL上清液转移到新的离心管中。在脂肪酸粗提溶液中加0.2 mL KCl (75%, w/v)溶液, 12,000 ×离心6 min, 转移400 μL氯仿相到新的离心管内, 加2 mL硫酸甲醇(5∶95, v/v), 85℃水浴1.5 h。随后加1 mL H2O与1 mL己烷, 混合液体5000 ×离心5 min, 加入500 μL己烷提取相用于气相色谱检测。花生干种子无损伤脂肪酸成份检测采用近红外谷物分析仪Perten DA7250。
2 结果与分析
2.1 油酸积累反馈调节FAB2的表达
开农176的油酸含量约占总油脂的70%, 开农70的油酸含量约占总油脂的45% (图1-B, E)。利用RT-PCR在种子发育的6个时期(20~70 DAF)检测的表达量显示,的表达量在高油酸种子发育的第20~40天呈上升趋势, 且显著高于正常品种; 而进入种子发育的后期(50~70 DAF), 高油酸种子内的表达丰度逐渐降低, 而在正常品种内,的表达量呈逐渐增加的趋势(图1-C, D)。开农176种子发育阶段油酸呈逐渐增加的趋势(图1-F), 该趋势与的表达量呈负相关。该结果表明, 随着花生种子内油酸含量的增加会反馈调节上游合成基因的表达量。
对场效应器件的进一步改进方法是采用三维石墨烯通道,来增强器件的性能并减小功耗。Ameri等[20]研制了基于涂有HfO2薄膜的石墨烯悬浮网络的pH传感器,此传感器在高离子强度[(289±1) mmol/L]的介质中也显示出极高的pH敏感性[(71±7) mV/pH],这归因于电解液中悬浮的三维石墨烯材料,提高了电解液与通道间的静电耦合效率以及电解液中离子对器件通道的栅极控制能力。同时,涂有HfO2薄膜的石墨烯为氢离子提供了结合位点,从而提高了检测灵敏度。
2.2 反馈调节FAB2表达的油酸积累阀值
从F2群体中筛选出25个具有代表性的单株, 在种子发育的成熟期(70 DAF)进行油酸与亚油酸含量检测, 其油酸含量变化幅度为40.30%~72.74% (图2-A)。并以F2-25单株为对照, 相对应地检测每个单株种子成熟期(70 DAF)的表达量, 结果油酸含量为46.23%~54.77%的单株, 其的表达量显著高于对照单株; 但是随着油酸含量的不断升高且超过60.21% (F2-12)时,的表达量迅速降低, 当油酸含量超过66.17% (F2-6)时,的表达水平相对于对照单株表达量非常微弱(图2-B)。因此, 可以肯定花生植株的油酸含量超过60%则会抑制的表达。
2.3 油酸积累影响POD活性及H2O2含量
在种子发育的6个阶段, 对过氧化物酶活性以及H2O2的含量进行检测显示高油酸种子发育的第30~40天, 过氧化物酶活性显著高于正常品种开农70, 第50~70天POD活性逐渐降低直至检测不到(图3-A)。高油酸种子发育的第30~40天, H2O2含量显著高于正常品种, 并且在种子发育后期逐渐降低(图3-B)。表明过度积累油酸不仅会影响过氧化物酶活性, 亦可能通过POD介导脂肪酸氧化反应, 进而导致H2O2含量升高。

图1 花生油酸积累反馈调节FAB2的表达量
A: 油酸合成示意图; B: 开农176与开农70的植株照片; C: 种子发育的6个时期; D:在高、低油酸品种种子发育过程中的表达变化量; E: 开农176与开农70的油酸与亚油酸含量; F: 开农176与开农70种子发育阶段油酸与亚油酸含量变化。
A: schematic diagram of oleic acid synthesis; B: photograph of Kainong 176 and Kainong 70; C: photograph of the six stages in the developing seeds; D: expression level ofduring seeds development in the high- and normal-oleic varieties; E: contents of oleic acid and linoleic acid in Kainong 176 and Kainong 70; F: relative content changes of oleic acid and linoleic acid during seed development in Kainong 176 and Kainong 70.
2.4 FAB2与FAD2的亚细胞定位
利用拟南芥的原生质体细胞, 对-GFP与-GFP的亚细胞定位进行活体检测显示,- GFP融合蛋白释放的绿色荧光与叶绿体Marker释放的红光重合, 表明主要被定为在叶绿体; 而-GFP的绿色荧光与内质网Marker的红光重合后显示为明亮的黄色荧光, 黄色荧光被叶绿体自激活的粉色荧光包裹, 表明定位于内质网(图4)。亚细胞定位结果表明,与虽然位于油酸合成的上游与下游, 但是两者存在细胞器间的隔离关系。
2.5 FAB2 CDS序列多态性分析
是否对油酸具有一定的调控作用, 本研究首先克隆了的全长CDS序列, 并利用不同的种质资源, 对的编码区序列多态性进行了分析。FAB2蛋白含有406个氨基酸残基, 且第85至第400位氨基酸区段为脂肪酸脱饱和酶结构域(图5),第148位氨基酸处含有乙酰ACP脱饱和酶, 为FAB2蛋白发挥功能最主要的结构域。高油酸开农176与正常品种开农70的编码区序列存在16个位点的差异, 但是305 bp与614 bp位点处的突变导致氨基酸序列102的甘氨酸变为谷氨酸, 205处的

图2 花生FAB2表达受抑制的油酸积累值
A: F2群体单株的油酸与亚油酸含量。OA: oleic acid; LOA: linoleic acid。B: F2群体单株的表达量变化。F2-25位对照单株, 柱状图结果表明3次独立重复。
A: contents of oleic acid and linoleic acid in the individual plant of F2population. OA: oleic acid; LOA: linoleic acid. B: relative expression ofin the individual plant of F2population. F2-25 as the control, bar value represented three independent replications.

图3 POD活性与H2O2含量变化
A: POD活性检测; B: H2O2含量检测; **代表< 0.01, *代表< 0.05。
A: changes of POD activity; B: changes of H2O2content; **< 0.01, *< 0.05.
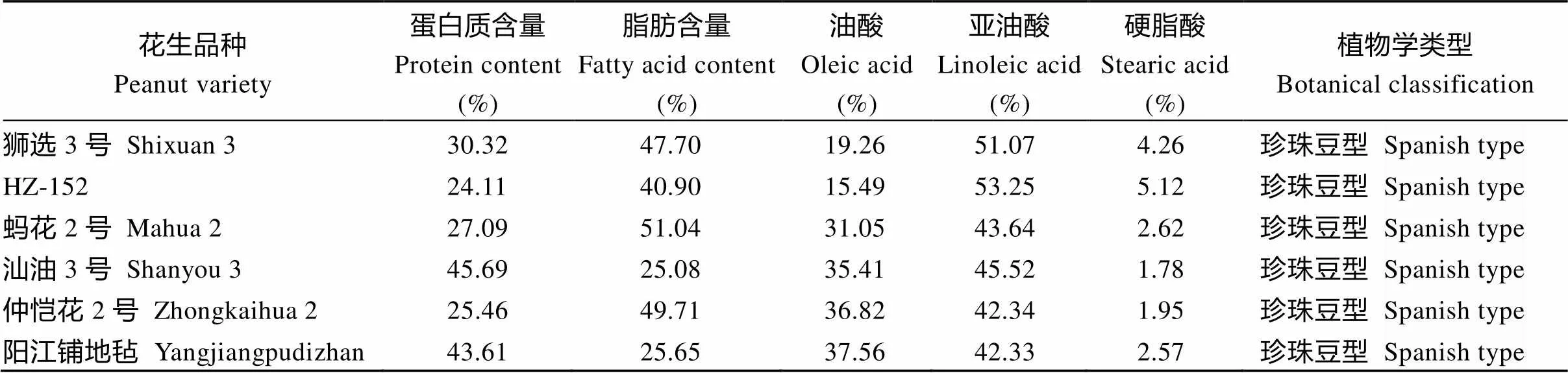
亮氨酸变为丝氨酸, 这两处突变均位于FAB2蛋白的核心结构域内[15]。通过克隆不同种质资源中的基因, 构建基因进化树表明,可被划分为5个具有代表性的亚家族(图5); 其中HZ-152品种的硬脂酸含量较高, 可达到5.6% (表1), 但其FAB2 41蛋白(FAB41)的氨基端(N端)含有6个氨基酸残基的缺失, 该区域的氨基酸缺失可能会影响FAB2的蛋白活性, 导致硬脂酸含量增加(图6)。编码序列比对结果表明, FAB2蛋白序列在不同的种质资源中常呈现氨基与羧基端发生多态性, 但是其发挥主要功能的核心结构域很少出现氨基酸位点的变异。

图4 FAB2与FAD2的亚细胞定位

表1 种质资源农艺性状
(续表1)

图5 不同花生种质的FAB2蛋白进化树

图6 不同花生种质FAB2蛋白序列多重比对
2.6 FAB2启动子序列分析
本研究发现高油酸通过活性氧途径反馈调节的表达, 那么启动子区域是否存在其他保守元件响应油酸激活的信号通路。于是利用Peanutbase数据库, 克隆了上游的1474 kb的启动子序列, 并利用PlantCare数据库, 对启动子序列进行保守元件预测。预测结果显示,上游启动子区间存在多种保守元件, 依照功能划分, 最多的为光响应元件, 其次是激素响应元件, 包括赤霉素、生长素、茉莉酸响应元件, 以及MYB、MYC等转录因子的结合元件(表2)。按照序列特异性分析,的启动子区间存在大量的AT碱基富集的区域(图7-A)[18], 这些AT-rich基序是许多核内转录因子与染色质调控的保守区间, 可能对调控的表达量至关重要。
3 讨论
脂肪酸脱饱和酶基因位于油酸合成通路的下游, 其突变后抑制油酸向亚油酸转化, 导致花生种子内油酸含量增加,的亚细胞定位表明该过程主要发生在内质网。油酸的合成前体是C18:1- ACP, 主要由调节硬脂酰-ACP (C18:0-ACP)脱饱和形成,的亚细胞定位显示该反应主要发生在细胞的质体内。花生是典型的地上开花、地下结果作物, 其果针进入土壤后, 种子发育过程中不受光照影响[19], 可以推断主要在细胞的质体中发挥主要功能。油酰-ACP必须被转化为油酰-CoA,再通过乙酰辅酶A转运系统由质体输送进内质网, 由于的突变, 油酰-CoA不能向亚油酸转化, 使得脱去辅酶A的游离态脂肪酸C18:1与甘油骨架生成高含量的三酰甘油进行储存[20]。油酸过量积累使种子体内增加了对人体较为有益的油酸分子, 但是对于植株生长却产生负向效应, 拟南芥与水稻的同源突变体均表现出植株矮小、而且不饱和脂肪酸的种类随之减少, 细胞膜流动性降低, 植株对低温敏感[21]。种子是植物用于繁衍后代的载体, 各类储存物质相对均衡有利于萌发, 过量积累的油酸使得单一类型的贮藏物质增加, 不利于成熟种子萌发, 因此机体需要将过量积累的油酸氧化代谢, 以消除后续种子萌发时产生的负向作用[22]。脂肪酸氧化过程中, 过氧化物酶发挥着重要作用, 脂肪酸长链的2次氧化均发生在过氧化物酶体内[23], 本研究发现POD的活性、H2O2含量以及的表达量在种子发育的6个时期均呈现出相同的变化趋势, 前期升高, 后期降低。油酸过量积累可能会通过活性氧途径反馈调节的表达量, 即过量积累的油酸可能会在过氧化物酶体发生氧化代谢反应, 该反应释放的活性氧信号传递进入细胞核后, 利用转录因子抑制的表达, 导致质体定位的FAB2蛋白丰度降低, 继而使合成的底物油酰-ACP含量降低(图7-B), 油酸抑制表达的跨细胞器调节的机制仍然需要深入研究。

图7 油酸调控FAB2表达的模型
A:启动子区域内AT碱基富集区域示意图; B: 油酸反馈调节表达的假定模型。
A: schematic diagram of AT-rich region inpromotor sequence; B: a proposed putative model of oleic acid feedback regulatingexpression.
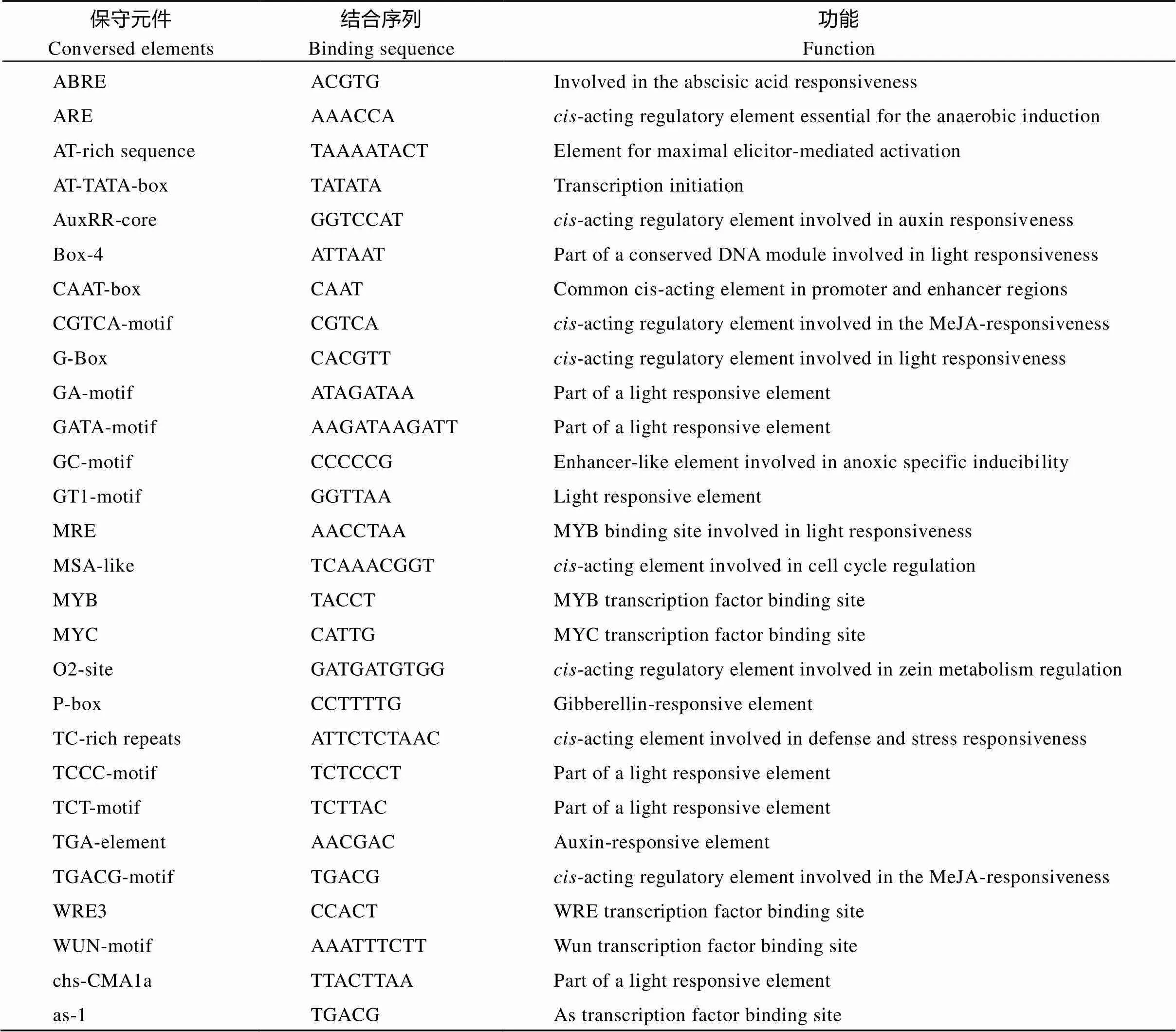
表2 FAB2启动子区间保守元件
的编码区序列相对较为保守, 筛选不同花生种质资源中的等位基因, 发现其编码区5¢和3¢端的序列存在碱基多态性, 根据碱基多态性可将划分为5种亚类型, 而核心的酰基脂肪酸脱饱和酶结构域内氨基酸位点差异相对较少。FAB2蛋白的核心结构域相对保守, 对调控硬脂酸向油酸转化具有重要作用, 但是氨基酸序列N端的结构缺失可能会导致蛋白酶催化活性降低, 从而使得花生种子硬脂酸(C18:0)含量升高。花生油相对于高端的橄榄油以及山茶油, 其油脂中的硬脂酸含量相对较高, 硬脂酸为饱和脂肪酸, 低温存储条件下油品易出现絮状沉淀。基因是调控18碳的饱和脂肪酸向不饱和脂肪酸转化的关键限速因子, 该蛋白酶活性直接影响食用油种子体内不饱和脂肪酸的含量, 饱和脂肪酸对人体健康不利, 因此通过种质资源筛选获得的强优势等位基因, 是减少种子饱和脂肪酸含量的有效方法。同时,的强优势等位基因挖掘也能够为高油酸花生育种提供理论指导,即建立“开源节流”型高油酸育种策略。突变会导致油酸含量增加, 但是现有高油酸品种油酸含量通常为70%以上, 若在突变体内过量表达,理论上可以继续提高油酸含量。再者, 花生含有野生种A与B两套基因组,同时突变, 虽增加油酸含量, 但是与原种对比会出现产量降低的负面影响, 能否在单一基因突变体或中过量表达的强优势等位基因以增加油酸含量, 并且降低突变导致的不利表型仍需要深入研究。
本研究发现的表达与活性氧信号爆发存在正相关,启动子序列存在大量保守的顺式作用元件, 光响应元件数量最多, 由于花生种子发育的特殊性, 推测光响应元件主要在植株的地上部分调控的表达; 此外,启动子区还含有赤霉素、生长素、茉莉酸信号的调控元件。拟南芥的突变体兼具调控茉莉酸与水杨酸的交互途径, 从而影响植株的抗病性,突变导致油酸不能向亚油酸转化, 亚油酸在的作用下生成亚麻酸, 亚麻酸通过LOX酶氧化作用生成茉莉酸合成的前体物质[24]。花生高油酸品种内由于的突变, 导致茉莉酸合成的主要途径被截断, 亚油酸、亚麻酸含量均减少, 可能会导致茉莉酸含量减少, 而的启动子元件内存在2个茉莉酸信号整合元件, 本研究推测的表达量在高油酸种子发育的后期受到抑制, 可能与激素合成途径存在密切关系,的表达不仅受到活性氧信号的调节, 也可能受到茉莉酸信号途径的影响。
4 结论
突变导致的高油酸表型反馈调节表达, 在种子发育前期升高, 后期降低。油酸积累增加了种子内活性氧含量, 进而影响的表达, 并且明确了油酸积累抑制表达的阈值。定位于叶绿体, 氨基酸序列的突变会抑制自身的蛋白酶活性,启动子序列存在大量AT碱基富集区以及多种顺式调节元件。
[1] 鲁清, 李少雄, 陈小平, 周桂元, 洪彦彬, 李海芬, 梁炫强. 我国南方产区花生育种现状、存在问题及育种建议. 中国油料作物学报, 2017, 39: 556–566. Lu Q, Li S X, Chen X P, Zhou G Y, Hong Y B, Li H F, Liang X Q. Current situation, problems and suggestions of peanut breeding in southern china., 2017, 39: 556–566 (in Chinese with English abstract).
[2] Gupta K, Kayam G, Faigenboim-Doron A, Clevenger J, Ozias-Akins P, Hovav R. Gene expression profiling during seed-filling process in peanut with emphasis on oil biosynthesis networks., 2016, 248: 116–127.
[3] Akhtar S, Khalid N, Ahmed I, Shahzad A, Suleria H A. Physicochemical characteristics, functional properties, and nutritional benefits of peanut oil: a review., 2014, 54: 1562–1575.
[4] Isleib T G, Pattee H E, Sanders T H, Hendrix K W, Dean L O. Compositional and sensory comparisons between normal- and high-oleic peanuts., 2006, 54: 1759–1763.
[5] Dar A A, Choudhury A R, Kancharla P K, Arumugam N. Thegene in plants: occurrence, regulation, and role., 2017, 8: 1789. doi: 10.3389/fpls.2017.01789.
[6] Patel M, Jung S, Moore K, Powell G, Ainsworth C, Abbott A. High-oleate peanut mutants result from a MITE insertion into thegene., 2004, 108: 1492–1502.
[7] 刘芳, 王积军, 汤松. 我国高油酸花生品种选育与推广应用. 中国农技推广, 2017, 33(1): 14–15. Liu F, Wang J J, Tang S. High-oleic peanut variety cultivation and popularized application in china., 2017, 33(1): 14–15 (in Chinese with English abstract).
[8] Chi X, Yang Q, Pan L, Chen M, He Y, Yang Z, Yu S. Isolation and characterization of fatty acid desaturase genes from peanut (L.)., 2011, 30: 1393–1404.
[9] Kachroo A, Shanklin J, Whittle E, Lapchyk L, Hildebrand D, Kachroo P. Thestearoyl-acyl carrier protein-desaturase family and the contribution of leaf isoforms to oleic acid synthesis., 2007, 63: 257–271.
[10] Mandal M K, Chandra-Shekara A C, Jeong R D, Yu K, Zhu S, Chanda B, Navarre D, Kachroo A, Kachroo P. Oleic acid- dependent modulation of NITRIC OXIDE ASSOCIATED1 protein levels regulates nitric oxide-mediated defense signaling in., 2012, 24: 1654–1674.
[11] Shi J, Cao Y, Fan X R, Li M, Wang Y, Ming F. A rice microsomal delta-12 fatty acid desaturase can enhance resistance to cold stress in yeast and., 2012, 29: 743–757.
[12] Jiang C J, Shimono M, Maeda S, Inoue H, Mori M, Hasegawa M, Sugano S, Takatsuji H. Suppression of the rice fatty-acid desaturase geneenhances resistance to blast and leaf blight diseases in rice., 2009, 22: 820–829.
[13] Song N, Hu Z, Li Y, Li C, Peng F, Yao Y, Peng H, Ni Z, Xie C, Sun Q. Overexpression of a wheat stearoyl-ACP desaturase () geneinmutant compromise its resistance to powdery mildew., 2013, 524: 220–227.
[14] Chi X, Zhang Z, Chen N, Zhang X, Wang M, Chen M, Wang T, Pan L, Chen J, Yang Z, Guan X, Yu S. Isolation and functional analysis of fatty acid desaturase genes from peanut (L.)., 2017, 12: e189759.
[15] Liu H, Li H, Gu J, Deng L, Ren L, Hong Y, Lu Q, Chen X, Liang X. Identification of the candidate proteins related to oleic acid accumulation during peanut (L.) seed development through comparative proteome analysis., 2018, 19 (4). pii: E1235. doi: 10.3390/ijms19041235.
[16] Wen S, Liu H, Li X, Chen X, Hong Y, Li H, Lu Q, Liang X. TALEN-mediated targeted mutagenesis of fatty acid desaturase 2 () in peanut (L.) promotes the accumulation of oleic acid., 2018, 97: 177–185.
[17] Sui N, Wang Y, Liu S, Yang Z, Wang F, Wan S. Transcriptomic and physiological evidence for the relationship between unsaturated fatty acid and salt stress in peanut., 2018, 9: 7. doi: 10.3389/fpls.2018.00007.
[18] Zhao J, Favero D S, Qiu J, Roalson E H, Neff M M. Insights into the evolution and diversification of the AT-hook motif nuclear localized gene family in land plants., 2014, 14: 266. doi: 10.1186/s12870-014-0266-7.
[19] Chen X, Zhu W, Azam S, Li H, Zhu F, Li H, Hong Y, Liu H, Zhang E, Wu H, Yu S, Zhou G, Li S, Zhong N, Wen S, Li X, Knapp S J, Ozias-Akins P, Varshney R K, Liang X. Deep sequencing analysis of the transcriptomes of peanut aerial and subterranean young pods identifies candidate genes related to early embryo abortion., 2013, 11: 115–127.
[20] Grevengoed T J, Klett E L, Coleman R A. Acyl-CoA metabolism and partitioning., 2014, 34: 1–30.
[21] Yang W, Dong R, Liu L, Hu Z, Li J, Wang Y, Ding X, Chu Z. A novel mutant allele ofconfers a better balance between disease resistance and plant growth inhibition on., 2016, 16: 208. doi: 10.1186/s12870- 016-0898-x.
[22] Theodoulou F L, Eastmond P J. Seed storage oil catabolism: a story of give and take., 2012, 15: 322–328.
[23] Kao Y T, Gonzalez K L, Bartel B. Peroxisome function, biogenesis, and dynamics in plants., 2018, 176: 162–177.
[24] Wasternack C, Song S. Jasmonates: biosynthesis, metabolism, and signaling by proteins activating and repressing transcription., 2017, 68: 1303–1321.
Molecular mechanism of stearoyl-ACP desaturase geneexpression in peanut
LIU Hao, LU Qing, LI Hai-Fen, LI Shao-Xiong, CHEN Xiao-Ping, LIANG Xuan-Qiang*, and HONG Yan-Bin*
Crops Research Institute, Guangdong Academy of Agricultural Science / Guangdong Provincial Key Laboratory of Crop Genetic Improvement, Guangzhou 510640, Guangdong, China
Stearoyl-ACP desaturase, encoded by, and located on the upstream of oleic acid biosynthesis pathway, modulates the conversion of stearic acid (C18:0) into oleic acid (C18:1). The expression ofwas increased at the early stage of seed development in high-oleic variety Kainong 176, but over-accumulated oleic acid repressed theexpression at the period of seed maturation. An F2hybrid population was constructed using Kainong 176 and Kainong 70, showing that the content of oleic acid up to 60% directly repressed theexpression on the whole. The activity of peroxidase (POD) and content of ROS were increased at the early stage of seed development with the oleic acid gradual accumulation, but decreased at the maturation stage. Subcellular localization analysis indicated thatandwere located on chloroplast and endoplasmic reticulum, respectively. Encoding sequence polymorphism analysis ofsuggested that amino acid deficient at the N-terminal of FAB2 protein sequence probably induced the high content of stearic acid in peanut. Furthermore, the promotor sequence ofcontained multiple AT-rich region, and possessed the light responsive, hormone regulation, and transcription factor binding site-regulating elements. Taken together, this study found that over-accumulated oleic acid activated the POD-induced ROS robust pathway, and then regulated the expression ofby unknown transcription factor in nucleus. The results extend the knowledge offunction, and provide a relevant theoretical guidance in future peanut breeding for high oleic acid.
peanut; high oleic acid;; ROS; feedback regulation
本研究由国家自然科学基金项目(31771841, 31801401), 广东省自然科学基金项目(2017A030311007), 国家重点研发计划项目(2018YFD0201009-02)和广东省农业科学院优秀博士计划联合资助。
This study was supported by the National Natural Science Foundation of China (31771841, 31801401), the Natural Science Foundation of Guangdong Province (2017A030311007), the National Key Research and Development Program (2018YFD0201009-02), and Excellent PhD Program of Guangdong Academy of Agricultural Science.
梁炫强, E-mail: liangxuanqiang@gdaas.cn; 洪彦彬, E-mail: hongyanbin@gdaas.cn
E-mail: liuhao2054@stu.scau.edu.cn
2019-01-02;
2019-05-12;
2019-05-30.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20190530.0959.002.html
10.3724/SP.J.1006.2019.94003
