补骨脂酚对光老化HSF细胞保护作用研究
2019-09-30刘国良姚远张宁郭玮王瑶刘斌
刘国良 姚远 张宁 郭玮 王瑶 刘斌


[摘要] 目的 研究補骨脂酚对中波紫外线(UVB)照射诱导的光老化人皮肤成纤维细胞(HSF)的保护作用。 方法 体外培养HSF细胞,分为空白组(正常培养,不进行UVB辐射)、UVB模型组(UVB辐射)、雌二醇组及补骨脂酚低(1 μmol/L)、中(10 μmol/L)、高(100 μmol/L)剂量组。采用MTT法检测细胞活力;采用Western blot法检测细胞内Ⅰ型胶原蛋白(COL Ⅰ)、基质金属蛋白酶-1(MMP-1)和基质金属蛋白酶-3(MMP-3)的表达量;采用逆转录PCR法(RT-PCR)检测细胞COL Ⅰ、MMP-1 mRNA的表达水平。 结果 确定光老化HSF细胞模型的最佳UVB照射剂量为25 mJ/cm2。与空白组比较,补骨脂酚低、中、高剂量组细胞活力及MMP-1、MMP-3、COL Ⅰ分泌差异无统计学意义(P > 0.05);UVB模型组的细胞活力、COL Ⅰ的表达水平显著下降(P < 0.05),MMP-1和MMP-3的表达水平显著上升(P < 0.05);MMP-1 mRNA表达水平升高、COL Ⅰ mRNA表达水平下降(P < 0.05)。与UVB模型组比较,补骨脂酚低、中、高剂量组细胞活力、COL Ⅰ的表达量显著上升(P < 0.05),MMP-1和MMP-3的表达水平显著下降(P < 0.05),MMP-1 mRNA表达下降、COL Ⅰ mRNA表达上升(P < 0.05)。 结论 补骨脂酚能够促进HSF细胞COL Ⅰ表达,抑制MMP-1与MMP-3的表达,防护UVB对HSF细胞的损伤,发挥抗皮肤光老化的作用。
[关键词] 中波紫外线;补骨脂酚;成纤维细胞;植物雌激素;光老化
[中图分类号] R965.2 [文献标识码] A [文章编号] 1673-7210(2019)07(a)-0011-06
Study on protective effect of bakuchiol on photoaging HSF cells
LIU Guoliang1 YAO Yuan1 ZHANG Ning1 GUO Wei2 WANG Yao2 LIU Bin1
1.College of Jiamusi, Heilongjiang University of Chinese Medicine, Heilongjiang Province, Jiamusi 154007, China; 2.the First Clinical Medical College, Heilongjiang University of Chinese Medicine, Heilongjiang Province, Harbin 150040, China
[Abstract] Objective To study the protective effect of bakuchiol on photoaging human skin fibroblasts (HSF) induced by ultraviolet radiation B (UVB) irradiation. Methods HSF cells were cultured in vitro and divided into blank group (normal culture, no UVB radiation), UVB model group (UVB radiation), estradiol group and bakuchiol low (1 μmol/L), medium (10 μmol/L) and high dose (100 μmol/L) groups. Cell viability was detected by MTT assay. The protein expressions of type Ⅰ collagen (COL Ⅰ), matrix metalloproteinase-1 (MMP-1) and matrix metalloproteinase-3 (MMP-3) were detected by Western blot. The expression levels of COL Ⅰ and MMP-1 mRNA were detected by reverse transcription polymerase chain reaction (RT-PCR). Results The optimal UVB radiation dose for photoaging HSF cell model was 25 mJ/cm2. Compared with the blank group, there was no significant difference in cell viability and secretion of MMP-1, MMP-3 and COL Ⅰ between the low, medium and high dose groups of bakuchiol (P > 0.05); the cell viability and COL Ⅰ expression level in the UVB model group decreased significantly (P < 0.05), the protein expression levels of MMP-1 and MMP-3 increased significantly (P < 0.05); the mRNA expression levels of MMP-1 and COL Ⅰ decreased significantly (P < 0.05). Compared with the UVB model group, the cell viability and COL Ⅰ expression in the low, middle and high dose groups of bakuchiol increased significantly (P < 0.05), the protein expression levels of MMP-1 and MMP-3 decreased significantly (P < 0.05), the mRNA expression levels of MMP-1 and COL Ⅰ increased significantly (P < 0.05). Conclusion Bakuchiol can promote the expression of COL Ⅰ in HSFs, inhibit the expression of MMP-1 and MMP-3, protect UVB from damage to HSFs and exert anti-photoaging effects on skin.
[Key words] Ultraviolet radiation B; Bakuchiol; Fibroblasts; Phytoestrogen; Photoaging
由于地球臭氧层遭到破坏,加之户外活动随着人们生活水平的提高而增加,过分暴露在紫外线下导致皮肤光老化[1]。皮肤光老化可导致皮肤干燥、毛细血管扩张、色素沉着斑、甚至恶性肿瘤[2]。光老化皮肤的主要组织学特征是皮肤真皮层基质构成的改变,即胶原成分的减少和异常弹性纤维沉积[3]。雌激素对抗皮肤衰老效果显著,但长期应用雌激素易产生皮肤色素沉着、妇科肿瘤、高凝血、高血压等副作用[5]。植物雌激素是天然存在于某些植物中、具有雌激素效能的一类化合物。其因与雌激素结构类似,可以与体内雌激素受体结合模拟、干扰雌激素的生理生化作用[6]。体内雌激素水平较低时,其具有拟雌激素作用[7];体内雌激素水平较高时,其可发挥抗雌激素活性。因此,植物雌激素称为“选择性雌激素受体调节剂”。
中药补骨脂在治疗光老化方面具有显著效果[8],而补骨脂富含多种植物雌激素成分。在前期研究基础上,本研究从补骨脂中筛选出多种植物雌激素成分,其中以补骨脂酚的雌激素样活性最强,且在治疗光老化方面具有良好的效果,但其抗光老化作用机制尚未阐明。本研究以揭示植物雌激素抗皮肤光老化的作用机制为目的,选择确切具有雌激素样作用的植物雌激素补骨脂酚为研究对象,围绕调节人皮肤成纤维细胞增殖能力及胶原合成与降解相关蛋白表达这一分子机制,开展植物雌激素抗光老化机制研究。
1 材料与方法
1.1 材料
人皮肤成纤维细胞(HSF,北京协和细胞中心提供);补骨脂酚(南京泽朗科技有限公司,生产批号:072815);鼠抗人MMP-1单克隆抗体(Santa Cruz公司,生产批号:20170513);鼠抗人MMP-3单克隆抗体(Santa Cruz公司,生产批号:20170526);鼠抗人I型胶原单克隆抗体(Santa Cruz公司,生产批号:20170521);兔抗鼠β-actin单克隆抗体(Santa Cruz公司,生产批号:20170216)。
1.2 仪器
电泳仪(北京六一仪器厂,DYY-10C);紫外光疗仪(希格玛,ss-03);二氧化碳培养箱(上海印溪仪器仪表有限公司,LHH.CP-150);酶标仪(上海热电仪器有限公司,SuPerMax 3100);凝胶成像系统(BIO-RAD 公司,ChemiDocTM XRS+)。
1.3 试药配制
雌二醇药液制备:分析天平精密称取雌二醇5.5 mg,4 mL无水乙醇溶解,500 μL吐温-80助溶,950 mL 细胞培养基(DMEM)完全培养液混匀容量瓶定容至1 L,配制成20 μmol/L的母液,稀释至终浓度10-3 μmol/L,调节pH至6.8,0.22 μm微孔滤膜过滤除菌。
補骨脂酚药液制备:分析天平精密称取补骨脂酚2.6 mg,用DMEM完全培养液溶解定容至100 mL,配制成200 μmol/L的母液,稀释成1000、500、100、10、1 μmol/L梯度浓度药液,调节pH至6.8,0.22 μm微孔滤膜滤过除菌。
1.4 人皮肤成纤维细胞培养
将细胞稀释至3×105个/mL,将细胞悬液按1 mL/孔加入至6孔细胞培养板,20 μL/孔接种于96孔板中,置于CO2培养箱中孵育培养过夜。
1.5 造模
UVB照射剂量分别给予0、15、25、35、45 mJ/cm2。UV剂量=UV辐照强度×时间(s)强度。照射时,UV组96孔培养板离灯管8 cm。每孔加80 μL 磷酸缓冲盐溶液(PBS)防止组织变干,照射完毕后PBS液清洗细胞2次,继续培养24 h,采用MTT法检测。
1.6 给药
细胞接种96孔培养板中,细胞生长至80%左右融合时,血清饥饿24 h后,加入高(100 μmol/L)、中(10 μmol/L)、低剂量(1 μmol/L)补骨脂酚孵育24 h,UVB照射,继续培养24 h,弃上清液,收集细胞;或继续培养48 h后,收集上清液,-20℃保存,待检测。空白组则在相同培养条件下培养,且未经UVB照射。
1.7 MTT法检测细胞活力
96孔板中HSF接受不同浓度补骨脂酚预处理24 h,再照射相应剂量UVB。继续孵育24 h后,从CO2培养箱中取出96孔板,吸弃培养基,每孔加入90 μL新鲜培养基及10 μL 5 mg/mL MTT。将96孔板置于CO2培养箱中继续孵育培养4 h。吸弃培养基,每孔加入100 μL二甲基亚砜(DMSO),震荡混匀10 min。用酶标仪测定570 nm处的吸光值,计算细胞活力。
1.8 Western blot法检测细胞蛋白表达
从CO2培养箱中取出药物处理过的6孔板,按100 μL/孔加入RIPA裂解液,转移至1.5 mL EP管中,冰上孵育30 min。4℃,12 000 r/min离心15 min,将上清转移至1.5 mL离心管中。电泳:浓缩胶电压为80 V,电泳2 h。转膜:恒压80 V转移60 min。封闭:封闭液室温封闭2 h。一抗孵育:一抗(1∶500稀释)及内参蛋白β-actin一抗(1∶1000稀释),4℃孵育过夜。二抗孵育∶二抗(1∶1000稀释),在摇床上室温孵育1 h。ECL发光:等量的A液和B液按1∶1混合。作用1 min左右,将膜放入化学发光成像仪内,曝光照相及图像分析。
1.9 RT-PCR法检测基因表达
从CO2培养箱中取出经实验分组给药处理过的6孔板,按1 mL/孔加入Trizol试剂,室温静置2 min,用移液器将细胞悬液转移至无RNAase的1.5 mL的EP管中。按0.2 ml/mL Trizol比例加入氯仿。室温静置5 min,4℃、12 000 r/min离心5 min,将上层溶液小心转移至新的EP管中。室温静置10 min后,4℃、12 000 r/min离心15 min。向含有沉淀的EP管中加入1 mL于-20℃预冷的75%乙醇,轻轻上下颠倒,洗涤沉淀,4℃、12 000 r/min离心5 min。移液器除去上清液,室温放置5 min,干燥,用30 μL RNase-free水溶解沉淀。逆转录反应:总RNA溶液稀释至200 ng/μL。逆转录反应在PCR仪中进行,反应条件:70℃ 5 min, 37℃ 5 min,42℃ 60 min,70℃ 10 min。反应结束后,将cDNA溶液放置于4℃保存(长期保存置于-20℃)。
在冰水浴上的PCR管中依次加入样品、16.1 μL ddH2O、1.5 μL cDNA、2.5 μL 10×PCR Buffer、2.5 μL dNTP、1.3 μL MgCl2,最后加入0.1 μL Taq酶,各0.5 μL上游引物和下游引物,使PCR管内终体积达到25 μL。将PCR管放入PCR扩增仪上扩增。引物的设计与合成由上海生工生物工程技术服务有限公司提供,以GAPDH为内参照。见表1。
1.10 统计学方法
采用SPSS 18.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析;计数资料用率表示,组间比较采用χ2检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 UVB照射剂量测定
照射剂量<25 mJ/cm2,基本不影响成纤维细胞的活力;照射剂量>25 mJ/cm2,明显抑制细胞活性。提示25 mJ/cm2开始对成纤维细胞造成损伤,且随着剂量的增大,细胞活力降低更明显,呈剂量依赖性,UVB照射(25 mJ/cm2)对HSF细胞没有明显细胞毒性作用。因此,本研究选择UVB(25 mJ/cm2)进行实验。见表2。
2.2 补骨脂酚对正常HSF细胞增殖的影响
补骨脂酚在100 μmol/L以下,不影响HSF细胞活性,与空白组比较,差异无统计学意义(P > 0.05);在500 μmol/L以上时,显著抑制HSF细胞活性,与空白组比较,差异有高度统计学意义(P < 0.01)。本研究选择补骨脂酚1、10、100 μmol/L进行实验。见表3。
2.3 补骨脂酚对光老化HSF细胞增殖的影响
与空白组比较,UVB照射(25 mJ/cm2)后HSF细胞活力显著下降,差异有高度统计学意义(P < 0.01);与UVB模型组比较,补骨脂酚低、中、高剂量组(1、10、100 μmol/L)HSF细胞活力显著升高,差异有统计学意义(P < 0.01)。见图1。
2.4 补骨脂酚对光老化HSF细胞MMP-1、MMP-3蛋白表达的影响
与空白组比较,UVB模型组HSF细胞中MMP-1和MMP-3蛋白表达量显著增加,差异有高度统计学意义(P < 0.01);与UVB模型组比较,雌二醇组和补骨脂酚高、中、低剂量组HSF细胞中MMP-1和MMP-3蛋白表达量显著降低,差异有高度统计学意义(P < 0.01)。见图2~3。
2.5 补骨脂酚对光老化HSF细胞COLⅠ表达的影响
与空白组比较,UVB模型组COLⅠ蛋白表達水平显著降低,差异有高度统计学意义(P < 0.01);与UVB模型组比较,雌二醇组和补骨脂酚高、中、低剂量组COL Ⅰ蛋表达水平显著升高,差异有高度统计学意义(P < 0.01)。见图4。
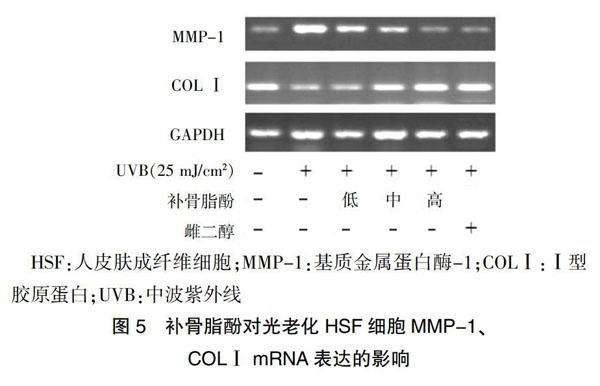
2.6 补骨脂酚对光老化HSF细胞MMP-1、COLⅠ mRNA表达的影响
与空白组比较,UVB模型组MMP-1 mRNA表达水平显著升高,COLⅠ mRNA表达水平显著下降,差异有高度统计学意义(P < 0.01);与UVB模型组比较,补骨脂酚低、中、高剂量组HSF细胞中MMP-1 mRNA表达水平显著下调,COLⅠ蛋白mRNA表达水平显著上调,差异有高度统计学意义(P < 0.01);与雌二醇组比较,补骨脂酚低、中剂量组MMP-1 mRNA 表达水平显著上调,COLⅠ蛋白mRNA表达水平显著下调,差异有统计学意义(P < 0.05),补骨脂酚高剂量组MMP-1和COLⅠ蛋白mRNA表达水平差异无统计学意义(P > 0.05)。见图5、表4。
3 讨论
光老化是皮肤暴露在紫外线下而引起的皮肤结构和功能的改变[9]。皮肤光老化导致皮肤粗糙、增厚、松弛、深而粗的皱纹,局部有过度的色素沉着或毛细血管扩张,甚至可能引起恶性肿瘤(如日光角化病、鳞状细胞癌、恶性黑素瘤等)[10]。紫外线导致的胶原纤维减少是皮肤光老化的重要原因,COLⅠ是皮肤真皮层主要的细胞外基质成分,约占人体真皮蛋白质总量的90%,胶原蛋白的变化主要是由基质金属蛋白分解而引起,MMPs在胶原降解和光老化发生起着重要作用,其中MMP-1、MMP-3是降解COLⅠ的主要酶[11-12]。
雌激素在对抗皮肤衰老方面作用显著,但长期应用雌激素易产生皮肤色素沉着、妇科肿瘤、高凝血、高血压等副作用[13-14]。中药植物雌激素是一类结构与雌激素相似的多羟基化合物,能够与雌激素受体结合发挥雌激素样作用,又可以与内源性雌激素竞争雌激素受体,从而发挥抗雌激素作用,抑制雌激素的副作用,其有望成为雌激素抗皮肤光老化的替代品[15-16]。
补骨脂酚是一种植物激素,具有抗衰老、抗氧化和抗凋亡等多种生物学活性[17-18],而对光老化的保护作用尚未见到报道。UVB波长短,穿透力强是造成皮肤光老化的主要原因。因此,本研究以UVB为光源,以人成纤维细胞为研究对象,参照大量实验研究和众多参考文献[19-20]的报道进行体外培养人成纤维细胞光老化模型的构建,并以此模型研究补骨脂酚的抗光老化作用。
本研究结果提示,UVB照射后HSF细胞增殖得到抑制,细胞中COL Ⅰ蛋白含量降低,而MMP-1、MMP-3含量增加,这与任捷[21]的研究结果一致,提示UVB照射后影响HSF细胞增殖,导致胶原蛋白合成减少,同时分解增加而导致皮肤光老化。补骨脂酚干预后,可降低UVB对HSF细胞的损伤作用,降低UVB对细胞增殖的影响,增加COLⅠ的合成以及mRNA的表达,下调MMPs蛋白的合成及mRNA的表达,从而降低胶原的分解,增加HSF细胞COLⅠ合成,最终起到防治HSF细胞光老化的作用。
植物雌激素样物质补骨脂酚具有防护皮肤光老化作用。在后续实验中,我们将针对其作用靶点进行预防光老化作用机制研究,以植物雌激素与雌激素受体相互作用及相关信号通路进行全面深入的研究,为植物雌激素预防皮肤光老化药物的开发奠定基础。
[参考文献]
[1] 吴斯敏,杨慧龄.紫外线引起皮肤光老化机制及防治的研究进展[J].医学综述,2018(2):341-346.
[2] 杨锐,陈丽娟.中西医防治皮肤光老化新进展[J].中医药信息,2017,34(3):117-120.
[3] 刘少英,孟祥璟,张祥奎,等.皮膚光老化机制及抗光老化药物[J].生理科学进展,2018,49(4):265-269.
[4] 张昕,李承新.皮肤光老化治疗进展[J].中国激光医学杂志,2018,27(1):47-51.
[5] 左俊,李勤,吴燕虹.雌激素调控皮肤衰老作用机制的研究进展[J].中国美容整形外科杂志,2013,24(2):122-124.
[6] 张欢,李青峰.雌激素对皮肤衰老的调控[J].组织工程与重建外科,2009,5(1):58-60.
[7] 雷秀东.雌激素抗皮肤老化的作用机制探讨[J].医学信息,2014(39):284-284.
[8] 倪晨宁.皮肤光老化的中医药治疗研究进展[J].名医,2018(2):96,98.
[9] Antoniou C,Kosmadaki MG,Stratigos AJ,et al. Photoaging [J].Am J Clin Dermatol,2010,11(2):95-102.
[10] Zegarska B,Jówicki W,Zegarski W,et al. Histopathological lesions in different types of skin aging [J]. Acta Dermatovenerol Alp Pannonica Adriat,2010,19(2):17-21.
[11] Chiu AE,Ab JLC,Ms DGK,et al. Double-Blinded,Placebo-Controlled Trial of Green Tea Extracts in the Clinical and Histologic Appearance of Photoaging Skin [J].Dermatol Surg,2005,31(Supplement s1):855-860.
[12] Jung HY,Shin JC,Park SM,et al. Pinus densiflora,extract protects human skin fibroblasts against UVB-induced photoaging by inhibiting the expression of MMPs and increasing type Ⅰ procollagen expression [J]. Toxicol Rep,2014(1):658-666.
[13] 刘俊岑,刘海洋,刘国良,等.异补骨脂素对紫外线诱导人真皮成纤维细胞损伤的保护作用及机制研究[J].国际中医中药杂志,2018,40(4):339-344.
[14] 刘俊岑,董蕊,朴成玉,等.松脂醇二葡萄糖苷对UVB诱导HDF细胞损伤的保护作用及机制研究[J].中药材,2017,40(6):1410-1414.
[15] 周勇,谢臻蔚,金杭美.雌激素在抗皮肤衰老中的生物学作用[J].中国美容医学,2017,26(1):27-30.
[16] Sjerobabskimasnec I,Situm M. Skin aging [J]. Acta Clinica Croatica,2010,49(4):515-518.
[17] 魏毅君,张荣军,罗文颖,等.补骨脂酚通过抑制凋亡、氧化应激和炎症反应缓解小鼠脓毒症脑病[J].现代生物医学进展,2018,18(20):3840-3844.
[18] Xin Z,Wu X,Ji T,et al. Bakuchiol:A newly discovered warrior against organ damage [J]. Pharmacol Res,2019, 141.
[19] 徐美娇.二苯乙烯苷对中波紫外线诱导人皮肤成纤维细胞光老化的保护作用研究[D].杭州:浙江中医药大学,2016.
[20] 王继慧.绞股蓝总皂苷对人皮肤成纤维细胞光老化模型凋亡信号通路的影响[D].沈阳:辽宁中医药大学,2014.
[21] 任捷.中草药对紫外线照射下真皮成纤维细胞保护作用的研究[D].上海:复旦大学,2010.
