生物技术药物药代动力学研究进展
2019-09-25何晓波朱佳慧高方圆
何晓波,朱佳慧,高方圆
(海军军医大学:a.学员十六队,b.学员一队,c.海军医学系卫生毒理学教研室,上海 200433)
生物技术药物(biotechnology drugs)是利用DNA重组技术、单克隆抗体技术或其他创新生物技术,以生物体作为原料而生产的用于预防、诊断及治疗的药物[1]。生物技术药物产生于活细胞且具有优良的靶向性、高特异性、生物活性以及免疫原性,其最大的特点是能对疾病的致病机制发挥药效,而不易引起与传统小分子药物相关的副作用,对使用传统药物治疗效果不佳的患者,可有效改善治疗效果,被誉为21世纪以来最具希望和发展潜力的新兴高科技药物[2]。但生物技术药物与传统的小分子药物在理化性质、生物性质上极为不同,其在体内的药代动力学过程也存在很大的差别。
生物技术药物药动学研究与传统小分子药物之药动学研究理念相同,即运用数学模型和动力学原理,定量或定性描述生物技术药物通过各种给药方式进入机体后,在吸收、分布、代谢、排泄 (absorption,distribution,metabolism,excretion,ADME)过程中发生的变化和动态规律,如利用insilico和invitro[3]等模型探究药物分子在体内发生作用时的代谢特征和分子性质。然而,生物技术药物分类广泛,每一类都有其各自的特点和作用机制,使得各类药物的药动学特征表现出极大的不同。深入而透彻地研究生物技术药物药动学特征,是整个药物研发过程不可缺少的部分,同时也为后续的药理学研究、毒理学评价、药物制剂研究和临床评价等提供重要的科学参考价值[3]。
1 生物技术药物的分类
生物技术药物包括治疗性蛋白质、多肽、抗生素、抗原、基因和细胞治疗药物等,目前已上市的生物技术药物主要用于治疗癌症、人类免疫缺陷病毒性疾病、心血管疾病、自身免疫性疾病、遗传疾病等。本文将生物技术药物分为两类:第1类是重组蛋白类或重组多肽类药物,包括单克隆抗体(monoclonal antibody,mAb)药物、细胞因子(cytokines)药物、激素(hormones)药物等[5]。第2类是重组DNA药物,包括反义寡核苷酸药物(antisense oligonucleotides,ASON)、DNA疫苗等。
2 分析方法
2.1 重组蛋白、多肽类药物
蛋白多肽类药物作为现代主流的生物技术药物,其药动学研究相较于小分子药物存在一定的困难,主要归于两方面原因:一是单次给药量小、血药浓度低,二是容易受内源性物质的干扰。因此,对此类药物的研究需采用灵敏度更高、专属性更强的实验分析方法。目前常用的分析方法主要有以下4大类。
2.1.1同位素标记示踪法
同位素标记示踪法包括放射性同位素示踪法和稳定性同位素示踪法,前者通过3H、18F、125I、14C等放射性核素作为示踪剂替换相应的普通元素(两者具有相同的化学性质和生物学性质)对药物分子进行标记,而后利用放射性检测仪器检测特征性射线来追踪标记药物的位置、数量和代谢过程[6]。林立红等[7]利用14C标记2-氟-6-三氟甲基吡啶(JJBD),通过放射性检测仪器液体闪烁计数仪(LSC)测定JJBD在大鼠血浆、组织、粪便等样品中的放射物含量,对应计算药物的浓度。稳定同位素示踪法原理上是以同位素替换对应元素产生的质量差作为特征,用质量测定仪器进行分析的技术。
同位素示踪法解决了蛋白多肽类药物在体内代谢途径复杂、含量限度低导致难以检测等问题,具有操作简洁、灵敏度高且具有对药物性质和机体影响小的优点,但其具有的放射性污染仍是该技术难以避免的一大缺点。
2.1.2活体成像法
活体成像技术是一种运用多种成像方法,在活体中直接观察药物分子在组织、细胞层面分布变化的技术。目前主要包括核素成像技术与荧光标记成像技术两大类。
核素成像技术在临床上应用广泛,是活体成像技术的经典方法之一,利用放射性核素的放射特征,应用检测仪器对放射性核素标记的生物分子进行成像分析。荧光标记成像技术联合了荧光标记与活体成像技术,具有灵敏度高、结果直观的优点,广泛应用于药物开发等行业。赵小亮等[8]用活化的荧光染料(Cy7)标记海茸 β-1,3/1,6-葡聚糖(DAG)获得荧光标记的Cy7-DAG,利用小动物成像系统对尾静脉注射该药物的小鼠进行荧光信号成像处理,可直观分析其在小鼠体内组织和器官的分布情况,为后续药动学、毒理学等研究提供了重要参考。
活体成像技术将体内药物分布可视化,为药物的药动学研究提供了强有力的手段。其非侵入性的分析特征可对同一实验体进行连续数据分析,避免了不同个体可能带来的数据差异性。
2.1.3免疫分析法
生物技术药物本身的免疫原性,使得免疫分析法也成为其药动学研究的分析手段之一。传统的免疫分析法包括酶联免疫吸附(ELISA) 、放射免疫分析(RIA)、荧光免疫分析(FIA)等,新型的免疫分析技术还包括生物传感器免疫分析(biosensor immunoassay,BIA)、毛细管电泳免疫分析(capillary electrophoresis-based immunoassay,CEIA)、测流免疫分析等。
传统免疫分析法虽然经典但反应速度慢,易受外界因素影响。近年来具有更高灵敏度、更高效率、较低成本的新型免疫分析法逐渐诞生。毛细管电泳免疫分析技术结合了毛细管电泳的分离能力和免疫分析的配体特异性,具有检测时间短、易于检测复杂生物化合物的优点,目前已被广泛用于蛋白质、激素等生物技术药物的药动学研究[9-10]。
2.1.4色谱法
目前常用于蛋白质和多肽药物药动学分析的色谱技术有HPLC法和高效毛细管电泳(HPCE)法。HPLC法是基于液相色谱和气相色谱发展起来的新型色谱技术,具有检测灵敏度高、分离效率高、速度快等优点。HPCE法采用高压电场作为驱动力,在微米级内径的毛细管中分离生物技术药物,故比起前者分析速度更快、柱效更高,且样品消耗量低,但分离容量小是其一大缺点。
色谱法常与质谱等其他技术联合使用,既能达到高效分离的目的,也可获取蛋白结构信息,以便于定性鉴别。Wang等[11]通过尾静脉注射、口服灌胃、腹腔注射3种给药方式对雌性ICR小鼠给予轮枝菌素A,并在给药后不同时间点通过心脏穿刺获取血液样本,利用液-质联用技术定量分析血浆样本中的轮枝菌素A,探究了不同给药方式对轮枝菌素A在小鼠体内药动学的影响,并发现口服和静脉注射给药引起轮枝菌素A在小鼠体内相对较高的暴露量。
2.2 重组基因药物
重组基因药物的药动学分析技术与蛋白多肽类药物部分重叠,可使用色谱法、免疫分析法、同位素标记示踪法、聚合酶链式反应(PCR)法等技术。目前基于色谱法已发展出许多高灵敏检测技术,例如离子对反相液相色谱-串联质谱(ion-pair reversed-phase LC-MS/MS)[12],利用离子对系统改善了LC / MS性能,弥补了传统反相色谱对寡核苷酸保留时间不足的缺点。此外,Dong等[13]通过基质场放大和柱头场放大堆叠注射的结合,在不降低分辨率的情况下成功开发出灵敏度高于电动注射近3 000倍的毛细管凝胶电泳联用紫外检测法(capillary gel electrophoresis with ultraviolet detection,CGE-UV)。色谱法虽然具有重复性好、分离效能高、分析速度快等优点,但由于基因药物药动学研究的特殊性和复杂性,其他先进的分析技术也必不可少。
由于液-质联用技术对于部分基因药物灵敏度不高,其可以检测到的血浆定量下限(LLOQ)过高,范围可达50~150 ng/ml[14],难以对基因药物给药24 h后的“分布后阶段”血药浓度进行定量分析,所以需要更灵敏的生物分析方法进行监测。例如Burki等[15]研发的超灵敏杂交ELISA法,对多肽磷酸二酰氨基酚吗啉寡核苷酸的检测下限能达到5 pmol/L,比普通液-质联用技术更灵敏,可根据分布后阶段血药浓度与组织分布存在的平衡关系,分析组织内药物的累积和清除情况。
3 生物技术药物的药动学特点
3.1 吸收
生物技术药物胃肠道稳定性有限、分子量较大、亲脂性差,致其既难以在胃肠道中稳定存在,又不易渗透过亲脂性的肠壁,因此主要通过静脉注射、皮下注射、肌内注射3种侵入性方式给药。目前对于非侵入性的给药方式也在进一步的研究和改进,以降低药物的施用难度,提高患者的依从性并改善药物的治疗潜力。非侵入性给药途径主要包括口服、吸入或经鼻腔黏膜、口腔黏膜和透皮给药[16-17]。Ueno[18]等研制出的胰高血糖素样肽-1(GLP-1)鼻腔给药技术,能从人体鼻黏膜下层迅速吸收入血,既提高了患者的依从性,又降低了药物的不良反应。
由于受药物溶解度和注射体积的限制,皮下注射和肌内注射仅适用于药物效力相对较高的生物技术药物,其余药物仍需静脉注射给药。生物技术药物的体内吸收主要通过淋巴管的对流运输和跨血管扩散两种途径。毛细淋巴管相比毛细血管缺乏基底膜而富含内皮细胞间的空隙,故其对大分子药物的渗透性更强。如皮下注射给药,当药物相对分子质量(分子量)较小时,主要通过扩散进入毛细血管;当分子量较大时,主要以淋巴系统吸收为主[19]。
3.2 分布
生物技术药物受自身理化特性、与组织的结合能力、不同的给药途径以及较高的组织渗透性等因素影响,与小分子药物相比,从分布血液到外周组织均缓慢而有限。有文章报道,静脉注射生物技术药物后,表观分布容积接近血浆容量,表明其向外周组织分布有限[20]。生物技术药物体内分布的主要方式是细胞的胞吞作用以及毛细管壁空隙的对流运输。对流运输的主要影响因素是毛细血管壁两侧的静态压和毛细血管壁的孔径尺寸。胞吞作用主要涉及受体介导的胞吞作用和液相胞饮,前者通过药物分子与细胞表面特异性受体结合引起内吞,由于受体数量有限而具有饱和性;后者是受细胞外浓度驱动的非特异性过程,例如mAb进入内皮细胞的主要途径为液相胞饮[21]。
此外,生物技术药物与靶点的亲和性以及体内的屏障系统也会影响其在体内的分布。例如,根据生物技术药物与目标靶点的亲和性,预测其表观分布容积以及体内分布情况。Hansen等[22]对实验兔静脉注射人源化单克隆抗体康昔单抗,通过免疫组化分析显示其主要定位在肝、皮肤、主动脉等器官的微血管内皮上。血-脑屏障(blood-brain barrier,BBB)的存在会限制生物技术药物在脑和脑脊液中的分布。亲水性的大分子生物技术药物(如mAb)难以通过血-脑屏障,其在脑脊液中的水平仅达血清水平的0.1%~1%[23-24]。
3.3 代谢与排泄
影响生物技术药物代谢的主要因素包括结构特征、分子大小、电荷密度与分布、亲脂性与亲水性差异等。与传统小分子药物不同,生物技术药物一般不通过细胞色素酶进行代谢,而与内源性蛋白质的分解代谢途径相同,可被蛋白酶水解为多肽或氨基酸,以能源物质或蛋白质合成原料的形式被代谢消除[25-26]。生物技术药物在体内有两条代谢途径,一是通过Fab区域与药物靶点之间相互作用介导的特异性清除途径,二是通过Fc区和Fc受体之间相互作用介导的非特异性清除途径[27-28]。此外,Robbie等[29]表明人源化单克隆抗体莫他维珠单抗-YTE突变体在体内能通过与新生儿Fc受体(FcRn)的结合来减缓非特异性途径的清除。
生物技术药物的体内代谢部位主要有肝脏、肾脏、血液和血管外组织等。在肝脏中,肝细胞通过转运过程中受体介导的吞饮作用参与药物的分解代谢。肾脏的分解代谢主要针对低分子量的生物技术药物(分子量<30 000),如小分子蛋白和多肽,经肾小球过滤,然后经肾近端小管被上皮细胞以受体介导方式摄取,分解为氨基酸原料再次进入体循环,尿液中的原形药物含量可忽略不计[30]。生物技术药物可通过胆汁排泄,例如胰岛素和表皮生长因子在肝脏中被代谢分解,随后产物排入胆汁,以粪便形式排出体外[20]。
4 生物技术药物与小分子药物药动学比较
为深入探讨生物技术药物的药动学特征,以近年来备受关注的mAb作为研究对象。总结2017—2018年美国批准的9种mAb药物的药动学数据[31-32],见表1。
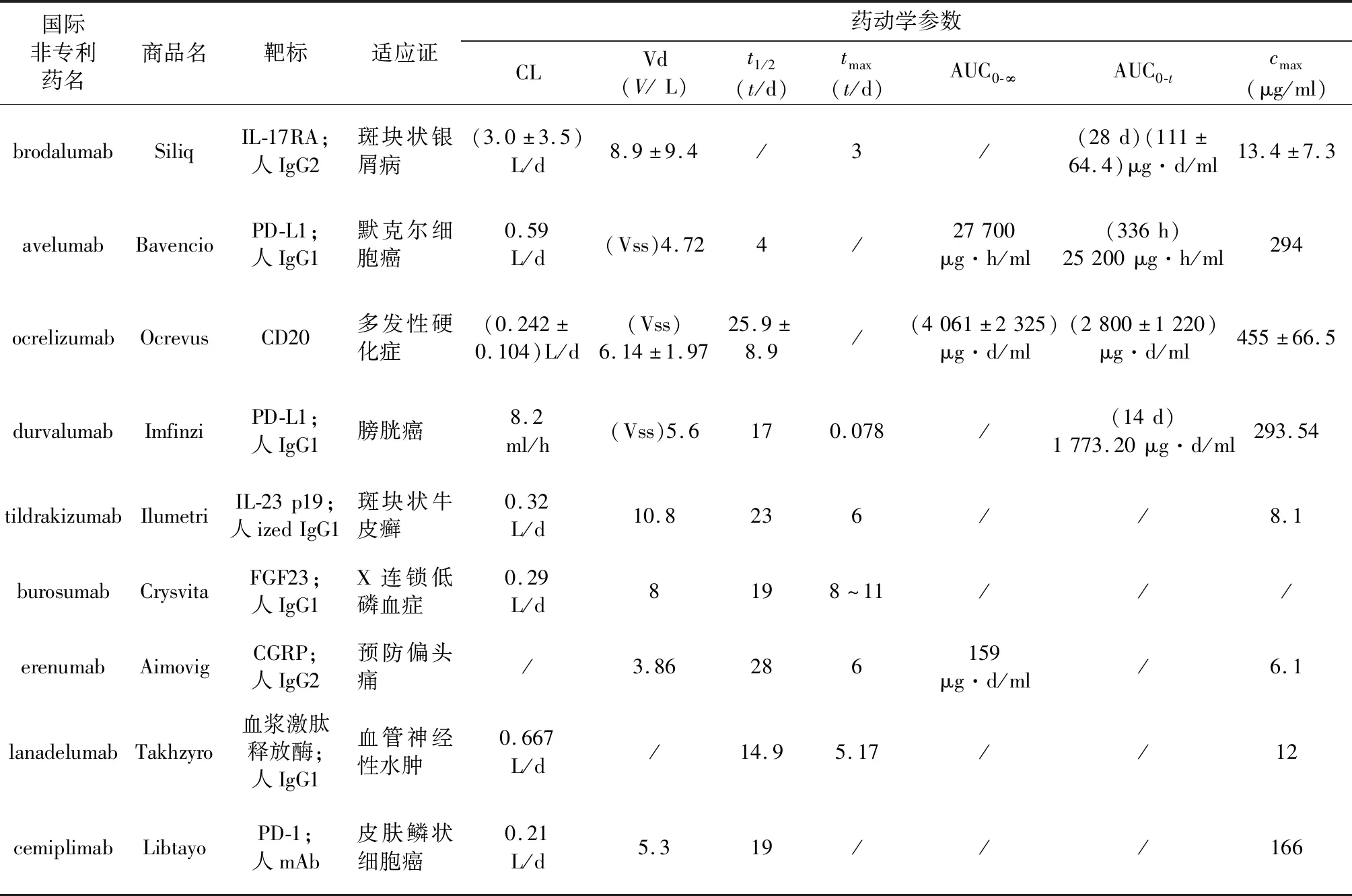
表1 2017-2018年美国批准的单克隆抗体药物的药动学特征
注:“/”表示FDA公布的处方信息中未涉及
mAb药物的药动学特征与传统小分子药物相比呈现极大的不同:①呈非线性药动学(PK)。mAb药物在体内主要与靶标蛋白或靶标细胞特异性结合,不与血浆蛋白发生结合,当目标靶点为可溶性抗原且内源水平较低时,表现出非线性PK的趋势;传统小分子药物在体内的结合往往是非特异性的,能影响多种酶的作用,一般呈线性PK,其与血浆蛋白的结合是影响PK的重要因素。②半衰期较长。mAb的代谢方式需依赖于与内源性蛋白相同的非特异性代谢途径或与受体结合的特异性代谢途径,半衰期较长;传统小分子的代谢途径一般通过例如细胞色素P450等酶的作用进行,半衰期短于mAb[33-36]。③表观分布容积较小。mAb在体内的分布通常局限于血管和细胞间质中,传统小分子药物分布可深入组织,拥有更大的表观分布容积。
5 展望
随着生物技术药物的不断兴起,人们逐渐加深了对其药动学的认知。生物技术药物药动学特征相比于传统小分子药物更为复杂,研究更具难度。但随着分子生物学、免疫学、药物分析学等相关学科的不断发展,更加灵敏、高效的新一代生物分析方法必将研制出来,以进一步研究生物技术药物的药动学特点和机制,为优化生物技术药物的研发方案以及指导临床用药提供强有力的后盾[35]。
