纤溶酶原激活物抑制剂1在疾病中的研究进展
2019-09-21张虎孙婧李璐璐董竞成
张虎 孙婧 李璐璐 董竞成
复旦大学附属华山医院中西医结合科,上海200040
纤溶酶原激活物抑制剂1(plasminogen activator inhibitor-1,PAI-1)是一种47 000的球状单链糖蛋白,来源于丝氨酸蛋白酶抑制剂超家族,由379个氨基酸残基组成,有3个β-折叠(A、B、C)和9个α-螺旋[1-2]。PAI-1基因存在多态性,其多态性(5G/4G)源于启动子区一个鸟嘌呤的插入/缺失,而在4G/4G纯合子基因的患者体内,PAI-1蛋白表达水平较高[3]。该蛋白可在多个组织和细胞类型中合成,如肝脏、脾脏、脂肪细胞、血小板、巨噬细胞、平滑肌细胞、成纤维细胞、肿瘤细胞和内皮细胞[4]。本文对PAI-1在与其相关联疾病中的作用研究进行总结。
1 PAI-1简介
PAI-1作为丝氨酸蛋白酶抑制剂基因家族的进化枝成员,是细胞周围蛋白水解微环境的负调节因子之一。正常情况下,机体血凝块中纤维蛋白溶解与细胞外周蛋白水解的作用受组织型纤溶酶原激活剂(tissue plasminogen activator,t-PA)和尿激酶型纤溶酶原激活剂(urokinasetype plasminogen activator,u-PA)调控。t-PA和u-PA通过激活纤维蛋白溶解蛋白酶(简称纤溶酶)对纤维蛋白、细胞外基质进行降解,防止血栓的产生。PAI-1是促凝血剂,与二者形成共价键,抑制纤溶酶的活性和细胞外基质的降解,并活化纤维蛋白,保证正常的凝血功能[5]。PAI-1还可通过与其他配体如细胞黏附蛋白、玻连蛋白结合来调节纤溶酶原的活性。作为体内纤溶系统的主要调控因子,PAI-1的病理生理作用涉及细胞迁移、血栓形成、血管新生,参与肿瘤、病态肥胖、糖尿病、动脉粥样硬化等疾病的发展(图1)[6]。

图1 PAI-1的病理生理作用示意图
2 PAI-1对相关疾病的影响
2.1PAI-1对血栓的影响 纤溶系统的平衡对于心血管疾病患者动脉内血栓的形成有着决定性作用。受细胞因子如IL-6、肿瘤坏死因子(tumor necrosis factor,TNF)和转化生长因子β(transforming growth factor-β,TGF-β)等的影响,PAI-1表达上调,与t-PA、u-PA的动态平衡被打破,血管局部纤维蛋白降解受限制,沉积加重,同时增强内皮细胞血管黏附分子表达,加速血栓的形成[7]。早期在冠状动脉组织的动脉粥样病变中发现了PAI-1的高表达,ST段抬高的心肌梗死患者其5年内的病死率与PAI-1的表达升高有关[8-9]。在动物实验中,PAI-1的升高与深静脉血栓形成、冠状动脉疾病、心肌梗死相关[10]。当小鼠敲除PAI-1后,其深静脉血栓的消退速度明显上升[11]。有学者通过对Toll样受体4敲除小鼠制造主动脉缩窄病理模型用以检测小鼠血栓形成。造模4周后,对照小鼠体内的PAI-1水平明显升高,细胞黏附分子表达增加,核转录因子κB(nuclear factor-κB,NF-κB)活性增强,内皮型一氧化氮合酶磷酸化程度下降,小鼠血栓形成的加重可能与升高的PAI-1调控Toll样受体4/NF-κB有关[12]。由肝脏和脂肪组织分泌释放的PAI-1阻止纤维蛋白溶解,较近的研究报道皮下脂肪组织与内脏脂肪组织相比,表现出与高凝状态具有更强的联系,提示脂肪于解剖位置的沉积可影响血栓形成的类型,即内脏脂肪组织多与动脉血栓有关,而皮下脂肪组织倾向于形成静脉血栓[13]。早期对啮齿动物内脏脂肪组织的研究中,肥胖伴随明显PAI-1的表达上调[14]。与低水平PAI-1小鼠相比,高表达PAI-1可使其在更短的时间内实现完全动脉闭塞,说明PAI-1可能通过抑制纤维蛋白清除而增加血栓形成的风险[15]。并且接受Roux-en-Y胃旁路手术的过肥胖患者体内PAI-1水平明显降低,现有研究常借促进肥胖机体内致炎细胞因子分泌对PAI-1与血栓的关系予以解释[16]。
2.2PAI-1对糖尿病的影响 PAI-1抑制纤维蛋白溶解,除了参与血栓形成外,因其在脂肪细胞较高表达,研究发现PAI-1随脂肪的上调而累积,与胰岛素抵抗呈正相关[17-18]。2型糖尿病的发展与加速的血栓性并发症有关,严重的脑血管疾病是导致患者死亡的主要原因。血栓性并发症的患者体内出现高水平的PAI-1,而同样的高表达在糖尿病模型小鼠体内得到验证[19]。Zheng等[20]通过对182例2型糖尿病患者的血清相关细胞因子表达进行分析发现,糖尿病伴微血管病变患者体内PAI-1升高的同时伴随着炎症因子如C反应蛋白、IL-6等的升高,表明过量的PAI-1可能通过诱导炎症促进内皮细胞功能障碍,提升促凝血因子表达,抑制纤维蛋白溶解,使组织纤维化。随后Sultan等[21]通过10年长期临床观察,也同样发现这一特点。有学者对1 391例1型糖尿病伴视网膜血管病变患者血清进行检测,除C反应蛋白、IL-6升高外,细胞黏附分子和血管黏附分子的表达也显著升高,进一步证明PAI-1可能通过诱发炎症促进凝血功能参与糖尿病的发生、发展(图2)[22]。Guo等[23]经对糖尿病小鼠予以脂联素干预,发现其PAI-1、TGF-β1、纤连蛋白等细胞因子表达均减少,清除了血管紧张素Ⅱ的刺激作用,抑制小鼠肾纤维化标志物的表达并减缓小鼠肾小球硬化进展。微小RNA作为血小板反应性的重要分子标志物,具有协调病理生理状态的作用。近期研究认为,miR-30c靶向于人类细胞中的PAI-1[24]。Luo等[25]由此细探miR-30c发现其主要表达于机体血小板,可直接靶向PAI-1的3'-UTR并对其表达产生负调节作用。高血糖环境可诱导miR-30c的抑制而增加2型糖尿病PAI-1的表达和血栓的形成。该学者使用lenti-miR-30c干预高脂喂饲的糖尿病模型小鼠发现PAI-1表达受到显著抑制,小鼠动脉血栓形成所需闭塞时间有所延长。
2.3PAI-1与癌症 作为纤维蛋白溶解系统的重要成员,PAI-1对急性血栓形成起着关键作用。虽然以往的研究主要集中于PAI-1在血栓形成中的作用,实际上越来越多的证据表明PAI-1在癌症中的作用仍不可忽视[26]。研究表明,PAI-1通过参与肿瘤细胞入侵和转移、血管新生,推动肿瘤的进展[27]。如在HCV肝硬化细胞中PAI-1基因表达上调,参与调控EGFR-ERK通路,使其下游MAPK激活炎症因子和血管新生蛋白,促进肝癌的发展[28-29]。Pavon等[30]通过免疫组织化学分析发现PAI-1表达过高可增加头颈癌转移的风险,可能的机制为PAI-1诱导纤维蛋白沉积,在癌细胞周围形成临时细胞外基质,为细胞迁移提供支架,同时介导PI3K/Akt通路干预头颈癌细胞的迁移。Takayama等[31]从血管新生角度出发,用PAI-1抑制剂SK-126反向研究恶性胸膜间皮瘤细胞,发现ERK1/2通路的活性受到抑制的同时,参与血管新生的相关细胞因子如血管内皮生长因子、碱性成纤维细胞生长因子、血小板衍生生长因子的表达下降。Kang等[32]发现PAI-1除了激活非小细胞肺癌细胞ERK1/2通路活性外,Caspase-3的活性受到抑制,缺氧诱导因子1β和Smad3的分泌与表达也相应增加(图3)。
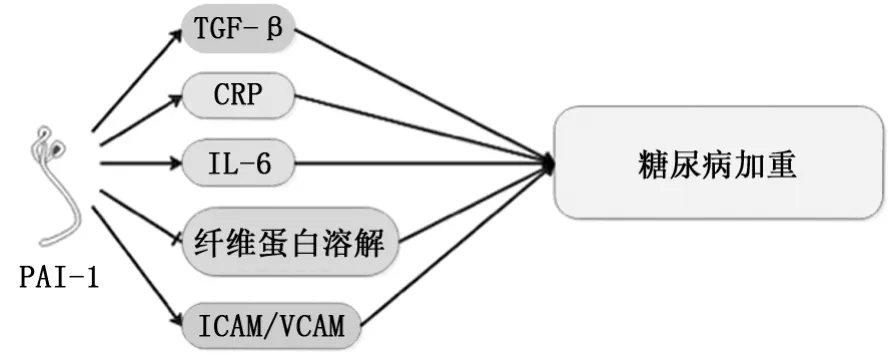
图2 PAI-1对糖尿病的影响
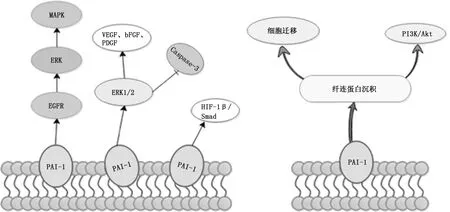
图3 PAI-1对癌症的影响
2.4PAI-1与呼吸系统疾病
2.4.1PAI-1与哮喘 哮喘是气道的慢性炎性疾病,反复发作可引起气道重塑。其特征在于可逆的气流阻塞和支气管的高反应性[33]。长期的慢性炎症导致气道损伤,凝血酶局部转化纤维蛋白原为纤维蛋白,为正常气道上皮修复所必需[34]。然而,在严重的哮喘中出现纤维蛋白含量的大幅增加可危及生命[35]。
报道指出,在过敏性哮喘患者痰液中PAI-1的含量明显升高,且PAI-1水平的升高与肺功能不良有关[36];携带多态等位PAI-1基因的哮喘患者(4G/4G)则表现出比5G/5G机体更为严重的哮喘症状,表明PAI-1可能通过相关途径参与哮喘的气道重塑[37-38]。当小鼠PAI-1表达缺陷时,胶原和纤维蛋白在肺组织的沉积显著减少,可降解细胞外基质的基质金属蛋白酶(matrix metalloproteinase,MMP)在肺组织和支气管肺泡灌洗液中的含量有所提高[39]。Cho等[40]以肥大细胞作为切入点进行研究发现,肥大细胞借由衍生的活性TGF-β1诱导IgE受体相交联,增强支气管上皮细胞产生更多的PAI-1加重气道重塑。通过给哮喘模型小鼠喂饲PAI-1抑制剂TM5275发现小鼠支气管肺泡灌洗液内嗜酸粒细胞数量和OVA-Ig E含量显著减少。随着OVA-Ig E水平的减少,受其调控分泌的IL-4、IL-5也相应减少。由于PAI-1可通过与细胞外基质蛋白玻连蛋白结合,使得其无法与u-PA受体作用,促进细胞迁移,加重气道重塑[41]。随后有学者进一步检测认为PAI-1抑制剂改善哮喘气道病变的潜在机制为阻断PAI-1介导的炎性细胞迁移,具有较好的抗炎作用[42]。Tezuka等[43]运用屋尘螨对小鼠进行哮喘造模的同时予以新型PAI-1抑制剂IMD-4690干预。实验结果表明IMD-4690可通过抑制tPA和PAI-1的结合来加速PAI-1的活性形式向非活性形式的转化,减少肺中Th2细胞因子(包括IL-4、IL-5和IL-13等)和TGF-β的产生,通过提升MMP-9/TIMP-1的比率来抑制小鼠的气道重塑而无明显的不良反应。
2.4.2PAI-1与肺纤维化 肺纤维化是一种病因不明确,临床以进行性呼吸困难和低氧血症为主要特征的慢性、进行性间质性疾病。其病变表现早期为弥漫性肺泡炎,最终肺组织多为大量凋亡的上皮细胞、成纤维细胞、细胞外基质[44-45]。以往研究认为肺纤维化大多与TGF-β、TNF-α、MMP等有关,而纤溶酶和MMP可通过降解细胞外基质缓解病变进展[46]。
早在1996年已有研究发现肺纤维化与升高的PAI-1相关[47]。紧接着PAI-1被报道参与受辐射诱导的组织损伤和纤维化的过程如肾小球病变(血栓、肾小球硬化)[48]。随着研究的不断深入,PAI-1与肺纤维化的关系也渐渐清晰。如Ghosh和Vaughan[49]、Omori等[50]先后分别发现PAI-1通过促进细胞外基质沉积和上皮-间质转化参与肺纤维化的发展,同时与TGF-β存在某种联系。机体由于吸收放射治疗的辐射常诱发肺炎并极易进一步发展为肺纤维化。Shioya等[51]对小鼠行胸部放疗肺纤维化造模后发现支气管肺泡灌洗液中PAI-1和TGF-β的含量显著升高。而接受了抗TGF-β抗体干预的小鼠体内的辐射诱导的PAI-1水平减少,表明PAI-1可能作为TGF-β的下游效应器参与辐射诱导的组织纤维化的过程。
Shetty等[52]使用博来霉素干预小鼠进行肺纤维化造模发现,PAI-1和p53在肺泡上皮细胞中的表达均有提高,同时Sirt1表达减少伴随p53的去乙酰化的增强以及miR-34a表达的升高,而这些变化在给予窖蛋白1结构域肽治疗后可明显改善。当小鼠敲除PAI-1基因后,miR-34a几乎不表达。当miR-34a前体过表达时,即使未予以博来霉素,仍发现p53、PAI-1以及肺泡上皮细胞凋亡的提升。
2.4.3PAI-1与COPD COPD是一类以不完全可逆气流受限和气道重塑为特点的常见慢性炎症性疾病。COPD气道炎症的发病机制尚未阐明,主要为吸烟或感染激活气道炎症细胞释放炎症介质,促进炎症细胞在气道的聚集、活化,病变可涉及全部气道、肺实质及血管。
PAI-1调节细胞迁移,诱导细胞外基质降解引发炎症参与肺纤维化的进展上文已详述。早期有学者发现COPD患者痰中PAI-1的水平显著升高,与肺功能呈负相关,与IL-8水平呈正相关[53]。随后Renckens等[54]发现在健康小鼠肺中过表达PAI-1可导致肺中TNF-α、IL-6、干扰素γ及KC表达的增加。IL-8和LTB4是COPD较为重要的炎症标志物,它们在痰中的浓度可在一定程度上反映疾病进展[55-56]。PAI-1被报道可直接体外调节IL-8、LTB4的表达,在暴露于香烟提取物或脂多糖后,siRNA靶向转染PAI-1后,与未转染的受暴露肺泡上皮细胞相比,其IL-8水平仍增加。虽相关机制尚不清楚,实验结果表明抑制PAI-1的合成可在一定程度上减弱炎症因子的表达[57]。Waschki等[58]对COPD患者检测甘油三酯、高密度脂蛋白胆固醇、血压、超敏C反应蛋白等代谢和心血管指标后,发现患者表达高水平PAI-1的同时,在不同程度上均具有高甘油三酯血症和全身炎症,由于甘油三酯和超敏C反应蛋白的升高对心血管疾病的发展起着重要作用,故认为PAI-1的升高不仅参与气道重塑,还有可能增加潜在诱发心血管疾病的风险。
组蛋白去乙酰酶2(histone deacetylase 2,HDAC2)作为调节致炎基因表达以预防过量炎症应激的蛋白,其过表达可抑制脂多糖诱导的大鼠肺支气管发育不良[59]。其也能通过c-Jun/PAI-1途径减弱脂多糖诱导的PAI-1、TNF、人巨噬细胞炎性蛋白2的表达调节炎症[60]。To等[61]在COPD患者痰液检测到升高的PAI-1和NF-κB DNA结合活性,但是二者无明显的关联性。接着作者将siRNA HDAC2转染至A549细胞中并予以TNF-α诱导发现,PAI-1的表达水平与未转染的细胞相比显著升高。当A549细胞给予HDAC2抑制剂SC514时得出与转染同样的实验结果。NF-κB的活性被报道随COPD发展而升高,NF-κB p65作为HDAC2的潜在去乙酰化靶点,作者用TNF-α处理敲除HDAC2的A549细胞后,检测乙酰化NF-κB与总NF-κB的比值。敲除了HDAC2的A549细胞乙酰化NF-κB显著升高,即比值大于对照组。以上结果表明HDAC2可调控受PAI-1激活NF-κB而诱发的COPD,PAI-1可作为调控NF-κB相关炎症的生物标记物参与COPD的病程发展(图4)。

图4 PAI-1对呼吸疾病的影响
3 展望
PAI-1通过调控细胞迁移、血管新生、抑制纤溶酶参与多类炎症性疾病,但相关研究多聚焦于心血管、肿瘤、糖尿病类疾病,而对于呼吸系统疾病的研究仍有待进一步深入突破。以气道炎症和重塑为主要特征的COPD,其炎症反应的特点为NF-κB的活化和HDAC2活性受损,有学者发现中药相关提取物可通过调控NF-κB和HDAC2的活性以干预COPD的进展。PAI-1也被报道在参与COPD的进展中,与HDAC2存在负相关的活性关系。因此,从中药复方或相关提取物角度切入,选择性地敲减PAI-1或HDAC2进行病理造模,观察二者的联系;或运用激动剂或抑制剂进行干预检测,对调节COPD进展和研究COPD发展的作用机制具有深远意义。
利益冲突所有作者均声明不存在利益冲突
