草莓枯萎病菌拮抗细菌JX.13的鉴定及生防效果评价
2019-09-10吉沐祥王晓琳黄洁雪吴祥陈宏州杨敬辉庄义庆
吉沐祥 王晓琳 黄洁雪 吴祥 陈宏州 杨敬辉 庄义庆


摘要:为明确生防菌株JX-13的分类地位,评价其对草莓枯萎病的生防效果,依据JX-13菌株形态、生理生化特性、16S rRNA和gyrB基因碱基序列同源性对其进行分析鉴定,采用菌丝生长速率法和田間试验评价其对草莓的促生作用和枯萎病生防效果。结果表明,JX-13菌株的形态特征和生理生化特性均与芽孢杆菌很接近,16S rRNA和gyrB基因碱基序列分析发现,JX-13菌株在系统发育树中与Paenibacillus polymyxa strain IIF5SW-B3属于一个类群,相似性高达99.00%。发酵加工的lxl0CFU/g JX-13可湿性粉剂(WP)和lxl0CFU/g枯草芽孢杆菌WP对草莓枯萎病菌菌丝生长的抑制中质量浓度(EC50)分别为19. 977μg/ml和41. 409μg/ml。对草莓繁苗田进行2次灌根处理,JX-13 WP 500倍液处理对草莓植株有明显促生作用,对草莓枯萎病的防治效果达96.03%。定植当天和第7d对定植田进行2次灌根处理,药后50 d、80 d分别进行田间调查,JX-13 WP 500倍液对草莓枯萎病防治效果分别为100.00%和68.94%。菌株JX-13被鉴定为多黏类芽孢杆菌Paenibacillus polymyxa,其发酵液加工的lx 10CFU/g WP在草莓繁苗田和定植田中具有防治枯萎病和促生的作用。
关键词:草莓枯萎病;拮抗细菌JX-13菌株;促生作用;生防效果
中图分类号:S668.4
文献标识码:A
文章编号: 1000-4440(2019)03-0586-08
草莓(Fragaria ananassa Duch.)是一种高价值经济作物,在中国种植广泛[1-2],已成为许多地区的支柱产业。2017年,中国的草莓种植总面积达到1.5x10 hm2,总产量约4.Ox10 t,总产值已超过6.Ox10元。在草莓生产中,由于耕地有限,通常采取连年种植的栽培方式,但随着种植茬口的增加,土壤出现盐渍化、酸化和土壤微生态失衡等问题[3]。草莓对土生真菌,如疫霉菌属(Phytophthora spp.)、腐霉属(Pythium spp.)、丝核菌属(Rhizoctonia spp.)、镰刀菌属(Fusarium spp.)、轮枝菌属(Verticillium spp.)等多种病原菌敏感[4],而连作会使病害加重,造成草莓生长发育迟缓,匍匐茎减少,结果减少,果实膨大受阻,品质下降,甚至全株枯死等危害[5]。有研究结果表明,草莓连作种植时,第二年重茬草莓发病率达55.0% - 91. 6%[6],草莓的连年种植模式严重制约了草莓产业的健康发展[7]。
草莓枯萎病是由半知菌亚门瘤座菌科尖孢镰刀菌草莓专化型Fusarium oxysporum±.sp. fragariae引起的重要土传病害,病原菌从根部侵染引起维管束病变,导致草莓品质降低,甚至全株枯死[8]。目前,对该病害的防治仍以化学防治为主,常在根部施用恶霉灵、代森锰锌、多菌灵和甲基托布津等杀菌剂[9]。杨焕青等[10]的研究结果表明,草莓枯萎病菌对三唑类杀菌剂烯唑醇、戊唑醇、腈菌唑和苯醚甲环唑十分敏感。单一化学药剂长期使用导致病原菌抗药性增强,农药残留超标,环境污染[11-12]。由于生防菌具有成本低和对环境友好的特点[13-19],利用生防菌防治植物的土传病害已成为国内外科研工作者的研究热点。项目组前期从句容地区石楠根部筛选了1株具有广谱抑菌效果的生防株菌JX-13,本研究拟根据其菌体形态特征、生理生化特征、16S rRNA和gyrB基因序列对其进行鉴定,并对菌液进行加工,以期为草莓枯萎病的防治提供理论参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株 草莓枯萎病菌(Fusariumoxysporum f.sp. fragariae)由江苏丘陵地区镇江农业科学研究所提供。生防菌株JX-13从句容地区石楠根部分离获得。
1.1.2 培养基Luria-Bertani培养基用于生防菌株JX-13的分离、鉴定、保存和培养‘20],马铃薯培养基(PDA)用于草莓枯萎病菌的培养和毒力测定[21]。
1.2 方法
1.2.1 生防菌株JX-13的形态学鉴定 革兰氏染色、菌体形态和菌落形态的观察参照杜秉海[22]的方法进行。菌株生理生化反应参照《常见细菌系统鉴定手册》[23]进行。
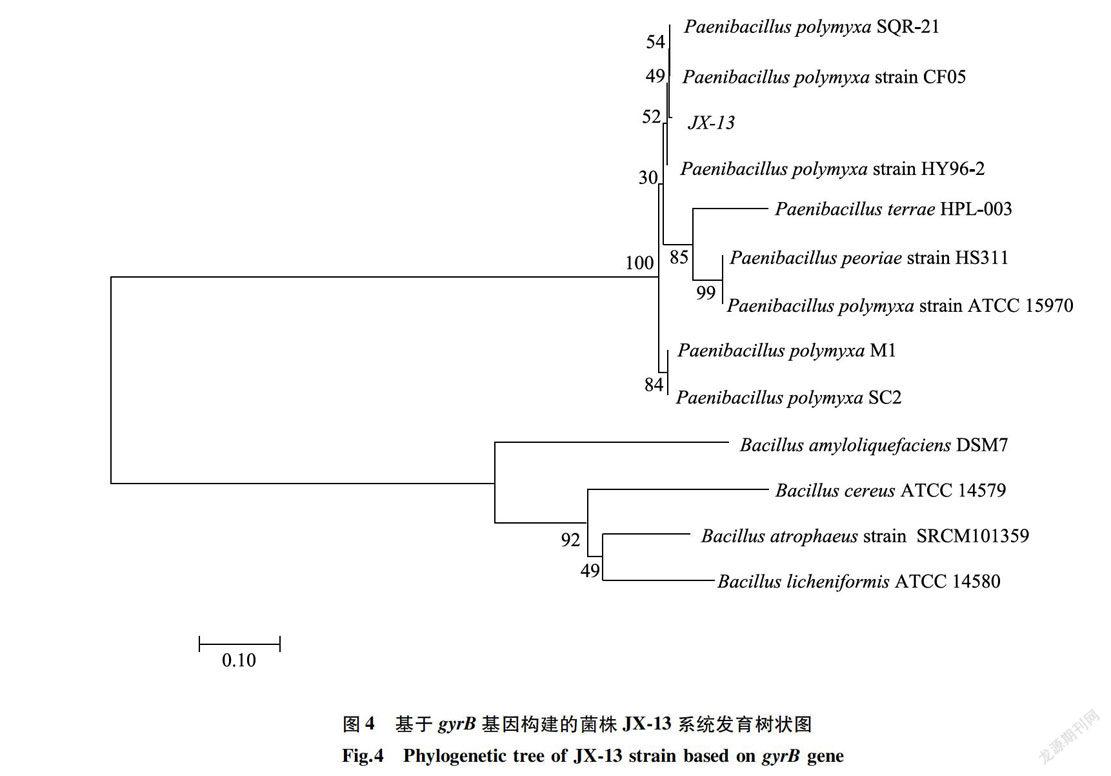
1.2.2 生防菌株JX-13的分子鉴定在液体马铃薯培养基中,30℃下振荡培养JX-13菌株至对数生长期,10 000 r/min离心10 min,收集菌体。细菌基因组DNA提取参照Ausubel等[24]的方法,采用细菌通用引物(27F:5 '-AGAGTTI'GATCCTGGCTCAG-3’;1492R:5 '_GGrITACCTTGrITACGACTT_3')进行PCR扩增。以细菌基因组DNA为模板,对gyrB基因碱基序列进行PCR扩增,引物序列为UP-1S:5’一GAAGTCATCATGACCGrITCTGCA_3', UP-2Sr:5 '-AG-CAGGGTACGGATGTGCGAGCC-3’,PCR产物由生工生物工程(上海)股份有限公司进行测序。将16SrRNA基因碱基序列和gyrB基因碱基序列结果提交至美国国立生物技术信息中心(NCBI),通过BLAST进行同源性比对,利用MEGA 7.0软件构建JX-13菌株系统进化树( Bootstrap=1 000)。
1.2.3 JX-13茵剂的加工
1.2.3.1 菌液的获得用无菌牙签挑取事先在PDA固体培养基上划线培养好的JX-13菌株单菌落,接种于装有5 ml PDA液体培养基的容积为20 ml的三角瓶中,于30℃、200 r/min条件下振荡培养16h,将所得5 ml培养液全部接种于装有400 ml PDA培养液的容积为1 000 ml的三角瓶中,200 r/min、30 cC条件下振荡培养16 h。将所得的400 ml培养液接种于装有20 L培养液的容积为30 L的发酵罐(产品型号:GUS-30,镇江东方生物工程设备技术有
限责任公司产品)中,20 L发酵培养液中固容物含量为:豆粕100 g、马铃薯淀粉200g、蔗糖25 g、酵母粉25g、CaC03 20g、MnS041g,设置发酵条件为:溶氧100%,攪拌速度350 r/min,发酵温度30℃,发酵时间36 h,pH 7.0-7.2。
1.2.3.2 菌剂加工工艺 将方法1.2.3.1中的菌液离心(8 000 r/min),用玉米淀粉吸干,测定活芽孢含量,根据测定结果用白炭黑和高岭土(1:1,质量比)调节活芽孢含量,调节至多黏类芽孢杆菌芽孢含量为1.OXlOCFU/g。将上述调节好的粉剂搅拌均匀,然后经气流粉碎机粉碎,获得成品可湿性粉剂(WP)含量为l.Oxl0 CFU/g。
1.2.4 JX-13 WP对草莓枯萎病菌抑菌活性的测定
分别称取1g JX-13 WP(1.OXlOCFU/g,自配)和枯草芽孢杆菌WP(l.Oxl010 CFU/g,武汉科诺生物科技股份有限公司产品)菌粉,用无菌水稀释1 000倍,配制成1 000 μg/ml母液(l.Oxl0 CFU/ml)备用。各药剂单剂在含药PDA中的质量浓度设计为400.000μg/ml、200.000μg/ml、100.000 μg/ml,50.000μg/ml、25.000 μg/ml、12.500μg/ml、6.250μg/ml和3.125 μg/ml。药剂母液和所有试验药剂系列质量浓度的药液均为现配现用。
采用菌丝生长速率法进行毒力测定,将草莓枯萎病菌转接到PDA平皿中,在25℃下活化96 h,然后在近菌落边缘用打孔器制取直径为5 mm的菌饼,并转接到含药PDA系列平皿中,设空白对照,各处理重复4次。25℃培养120 h,待对照中菌落长至约平皿直径的4/5时,采用十字交叉法量取菌落直径。
计算菌落直径均值,并按照下列公式计算菌丝生长平均抑制率:菌丝生长平均抑制率=[(对照菌落直径均值一处理菌落直径均值)/(对照菌落直径均值一接种菌饼直径)] xl00%。采用DPS 13.0专业版数据处理系统,计算药剂对草莓枯萎病菌菌丝生长抑制的回归方程、抑制中质量浓度( EC50)及其95%置信区间。
1.2.5 JX-13 WP草莓繁苗田灌根处理的促生作用和预防效果试验在句容市华阳镇一农户草莓繁苗田进行,品种为红颊,上茬为水稻田,4月13日母株苗定植,1 hm21.8x104株,除试验药剂处理不同外,其他管理措施均一致。
试验设3个处理,处理1采用l.Oxl0CFU/gJX-13 WP 500倍液(江苏丘陵地区镇江农业科学研究所植保研究室配制),处理2采用l.Oxl0CFU/g枯草芽孢杆菌WP 500倍液(武汉科诺生物科技股份有限公司产品),处理3采用每1g含有I.OX10个孢子的寡雄腐霉WP 2 500倍液(捷克生物制剂有限公司产品),另设清水对照。每个处理20株,3次重复,每株灌根200 ml,于定植当天和第15 d灌根处理2次,第2次用药后50 d调查草莓植株性状、匍匐茎数以及对枯萎病的预防效果。
1.2.6 JX-13 WP药剂灌根处理对草莓定植田的防病效果和促生作用 试验设在句容市石狮镇邬平章草莓3号棚,此棚连作6年以上,棚内枯萎病发病较重。草莓品种为红颊,除试验药剂不同外,其他管理措施均一致。
试验设3个处理,处理1采用1.0XlOCFU/g JX-13 WP 500倍液,处理2采用l.Oxl010 CFU/g枯草芽孢杆菌WP 500倍液,处理3采用每lg含l.Ox106个孢子的寡雄腐霉WP 2 500倍液,另设清水对照。每个处理20株,3次重复,2014年9月16日移栽,9月17日灌根,每株200 ml,隔7d再灌1次,共计2次。第2次用药后50 d和80 d调查各处理对草莓植株土传病害枯萎病的防治效果,第2次用药后50 d调查各处理草莓植株性状。
2 结果与分析
2.1 JX-13菌株的鉴定
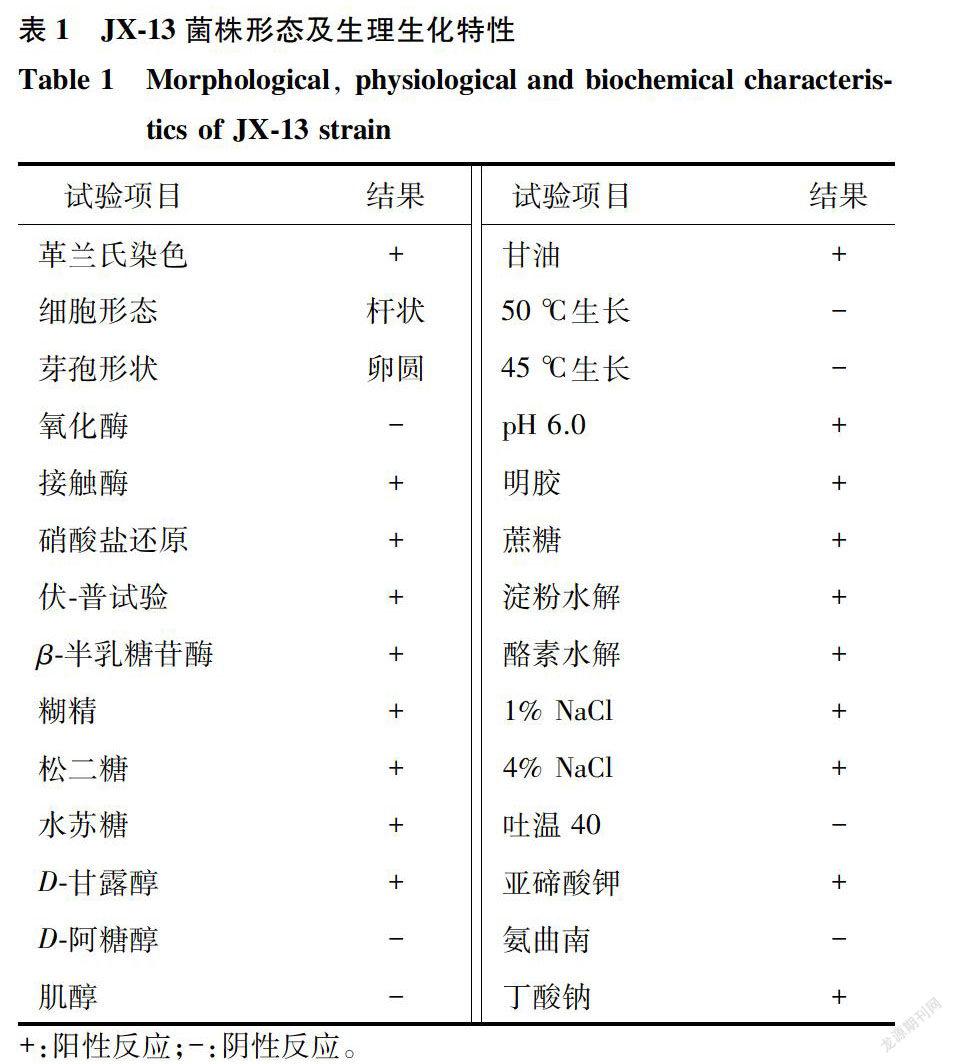
2.1.1 形态特征及生理生化特性 PDA上的菌落呈灰白色,半球状隆起,黏稠状,表面湿润且光滑,边缘整齐,革兰氏染色阳性,菌体为杆状,有圆形芽孢,菌体大小为[( 2.2-9.4)μmX( 0.8-2.4) νm](图1、图2)。菌株的生理生化特性如表1显示。根据以上的形态特征及生理生化特性,初步鉴定菌株JX-13为芽孢杆菌。
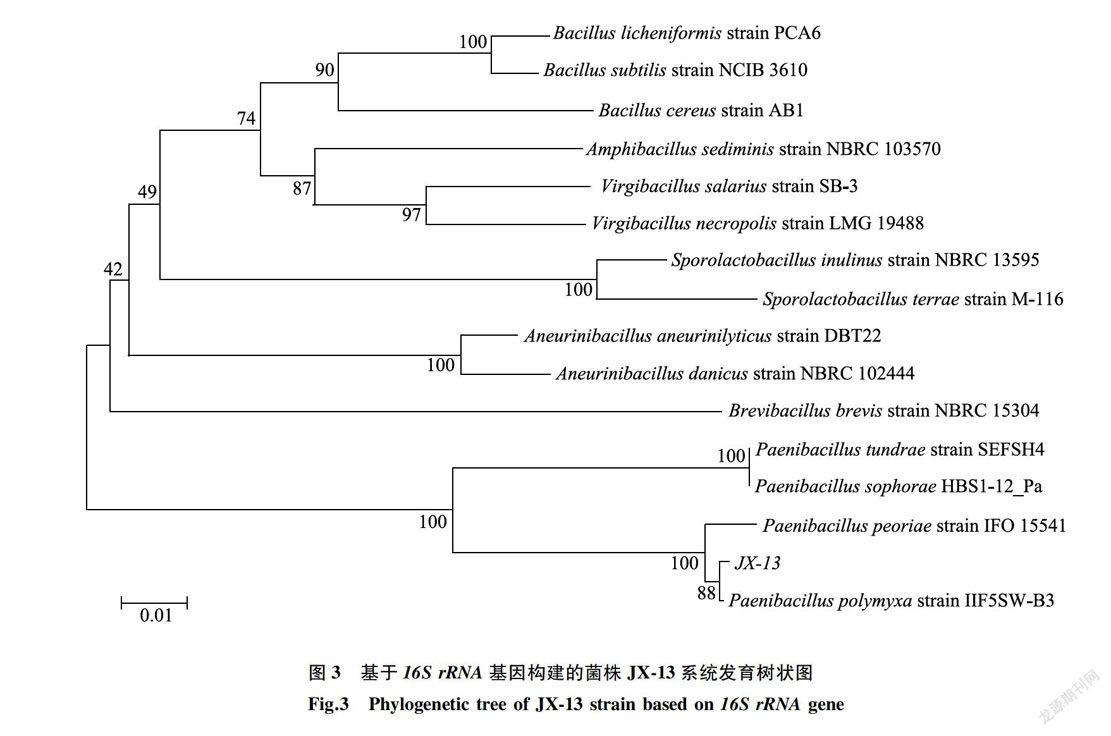
2.1.2 /6S rRNA和gyrB基因碱基序列分析菌株JX-13经PCR扩增的16S rRNA基因片段序列长度为655 bp(GenBank登录号MH603871.1)。将测序结果提交至NCBI进行序列相似性比对,采用邻近归并法构建菌株JX-13系统进化树。结果(图3)显示,JX-13菌株与多黏类芽孢杆菌Paenibacillus poly-myxa strain IIF5SW-B3(GenBank登录号KY218873.1)处在同一个分支,且相似性高达99%。
菌株JX-13经PCR扩增的gyrB基因碱基序列长度为1 062 bp(GenBank登录号CP009909.1)。将测序结果提交至NCBI进行序列相似性比对,构建JX-13菌株gyrB基因碱基序列系统进化树,结果(图4)显示,JX-13菌株与多黏类芽孢杆菌Paenibacilluspolymyxa SQR-21(GenBank登录号CP006872.1)和Paenibacillus polymyxa strain CF05(GenBank登录号CP009909.1)处在同一个分支,且相似性均高达99%。结合JX-13菌株的菌体形态、生理生化特性、16S rRNA和gyrB基因的鉴定结果,将JX-13菌株鉴定为多黏类芽孢杆菌。
2.2 JX-13 WP对草莓枯萎病菌的抑菌活性
室内生物活性测定结果(表2)表明,l.Ox 1010CFU/g JX-13 WP和l.Oxl010 CFU/g枯草芽孢杆菌WP对草莓枯萎病菌菌丝生长的ECso分别为19. 977μg/ml和41. 409μg/ml,EC90分别为228. 981μg/ml和355. 461 μg/ml。l.Oxl0 CFU/g JX-13 WP对草莓枯萎病菌的毒力高于l.Oxl010 CFU/g枯草芽孢杆菌WP,可见JX-13抑菌活性高于枯草芽孢杆菌。
2.3 JX-13 WP对草莓繁苗田植株的促生作用和防病效果
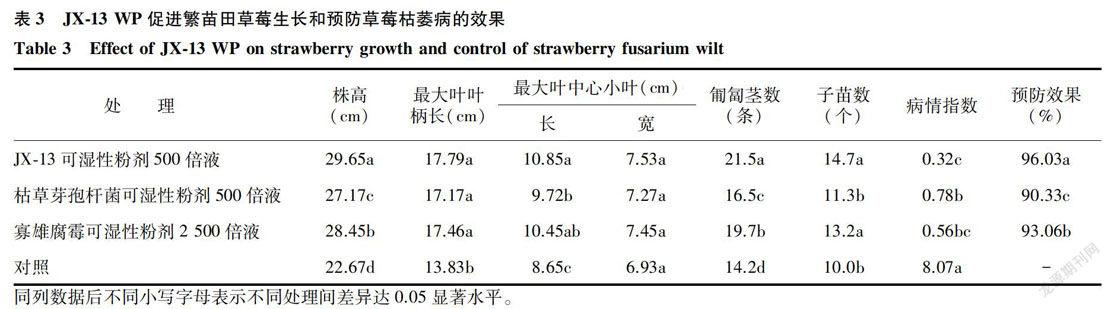
草莓繁苗田2次灌根处理,药后50 d调查结果(表3)表明,参试药剂对草莓植株生长均有促进作用,株高增加,匍匐茎数增加,长势较好,其中JX-13 WP 500倍液处理的效果最好,其次为寡雄腐霉WP 2 500倍液处理,枯草芽孢杆菌WP 500倍液处理也有一定促生作用,3种微生物菌剂对枯萎病的预防效果均在90%以上。
2.4 JX-13 WP对草莓定植田枯萎病的田间防治效果和促生作用
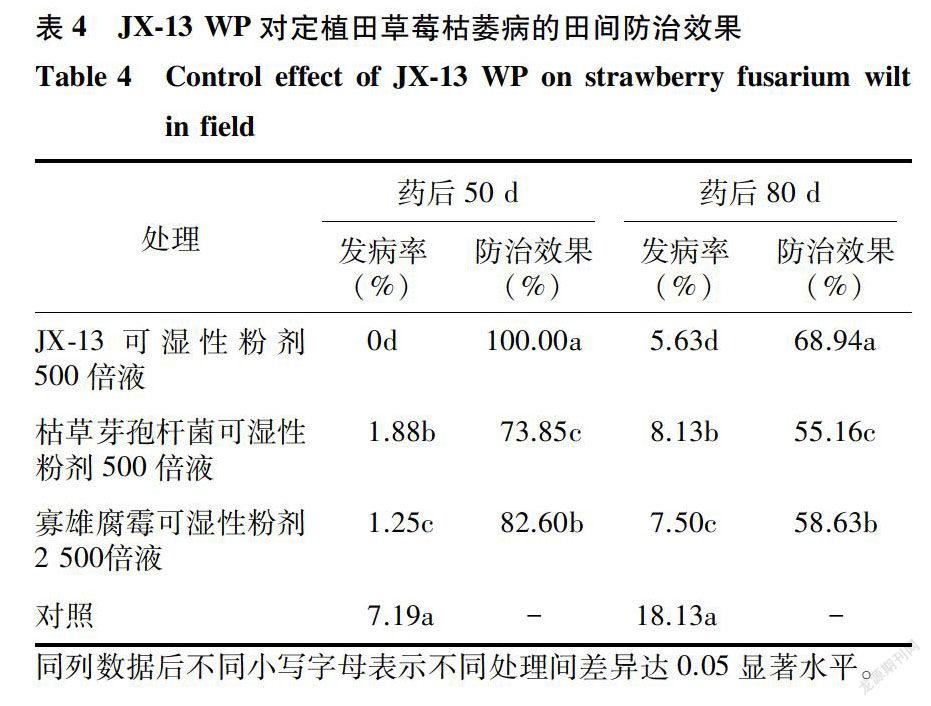
JX-13 WP 500倍液定植后灌根处理,药后50d、80 d分别进行田间调查,对照组发病率为7.19%和18. 13%,不同药剂处理均有较好防治效果,其中JX-13 WP 500倍液处理的2次调查结果分别为100. 00%和68. 94%,均显著高于其他处理(表4)。
药后50 d调查各处理区草莓的生长情况,结果(表5)表明,与对照相比,JX-13 WP 500倍液、枯草芽孢杆菌WP 500倍液、寡雄腐霉WP 2 500倍液均有促进生长的作用,表现为株高增加,最大叶增大,其中,JX-13 WP 500倍液处理促进生长的效果与寡雄腐霉WP 2 500倍液处理相当,均较高,明显高于枯草芽孢杆菌WP 500倍液处理。
3 讨论
同源性很高的一些细菌种群很难通过形态特性和生理生化特性进行鉴定,近年来发现以编码蛋白质的基因gyrA和gyrB作为系统发育鉴定标记,可以弥补16S rRNA序列的不足[25-26]。有研究发现,从健康番茄植株的根际土中筛选出拮抗菌株WXC-DD105,经形态特性、16S DNA和gyrB鉴定为枯草芽孢杆菌[27]。本研究采用的生防菌株JX-13,分离自江苏句容地区石楠的根部,经形态特征、生理生化特性、16S rRNA和gyrB基因鉴定为多黏类芽孢杆菌Paenibacillus polymyxa。许彦等[28]测定了杀菌剂对西瓜枯萎病菌的室内毒力,结果表明,多黏类芽孢杆菌和低毒化学药剂甲基托布津的抑制效果最好且相当。Rybakova等[29]研究发现,多黏类芽孢杆菌Sb3-l可以抑制长孢轮枝菌生长,能够促进被黄萎病菌侵染的油菜幼苗生长。本研究将菌株JX-13配制加工成l.Oxl0 CFU/g JX-13 WP,该菌剂对草莓枯萎病菌的毒力高于l.Oxl0CFU/g枯草芽孢杆菌WP。
随着化学药物防治局限性的显现,引入有益微生物对连作障碍进行修复已逐步成为生物防治领域研究的热点[30]。生物防治的防治时间较长,不会造成环境污染,安全性较高,且不易产生抗性[31]。多黏类芽孢杆菌是一种能防治多种病原真菌病害的生物防治细菌,其生物防治机制多样,既能通过分泌抗菌多肽、蛋白质等起作用,又可以通过菌体与病原菌在生态位进行营养和空间位点竞争起作用,也可以通过与植物相互作用引起植物体内的生理生化变化,从而使植物对病原菌产生抗性等起作用[32]。多黏类芽孢杆菌可以产生多种生物活性物质,如植物激素、抗菌物质、絮凝剂抗生素等[33]。有研究发现,多黏类芽孢杆菌A26通过Sfp-型磷酸泛酰巯基乙胺基转移酶形成的脂肽类抗生素以及形成生物膜的能力是其对镰刀菌产生拮抗作用的关键[34]。从商用多黏类芽孢杆菌HY96-2中分离到一种抗真菌活性组分,即环状缩酚酞类化合物6B,经鉴定为镰刀菌素A,对包括尖孢镰刀菌的15株植物病原真菌和1株革兰氏阳性植物病原细菌均具有较强的抑制作用[35]。多黏类芽孢杆菌CF05拮抗尖孢镰刀菌,能有效防治番茄枯萎病,并促进番茄生长,这可能是因为CF05产生生长素(吲哚-3-乙酸)从而刺激作物生长,并诱导植物产生防御酶,积累H202、苯酚等防御物质,增强作物防御能力[36]。马夙静[37]发现,多黏类芽孢杆菌ZYPP18对小麦有促生作用,这可能是因为它可以产生植物激素吲哚乙酸。从醋糟基质中分离到的多黏类芽孢杆菌NSY50能够拮抗黄瓜根际镰刀菌的生长,使枯萎病发病率降低至对照的56.4%,这是通过改变土壤理化性质并调节根际微生物群落,诱导黄瓜对镰刀菌进行防御实现的[38-39]。本研究中,多黏类芽孢杆菌JX-13防治草莓枯萎病的效果与多黏类芽孢杆菌NSY50防治黄瓜枯萎病的效果类似。陈雪丽等40]研究发现,多黏类芽孢杆菌BRF-I生防细菌菌液及其无菌代谢物对番茄和黄瓜枯萎病不仅有较好的防治效果,而且具有明显的促生作用。通过分根水培和液相色谱一质谱( LC-MS)分析西瓜接种促生抗病多黏菌SQR-21后根系蛋白质的差异,发现SQR-21能够促进植物生长是因为它能够诱导西瓜中参与生长、光合作用等代谢生理活动的多种蛋白质表达[41]。多黏类芽孢杆菌用于防治植物土傳病害的例子很多,一些芽孢杆菌不仅有防病作用,而且有明显的促生作用[42-44]。本研究对草莓繁苗田进行2次灌根处理,药后50 d的调查结果表明,参试药剂对草莓植株生长均有促进作用,其中多黏类芽孢杆菌JX-13可湿性粉剂500倍液处理的效果最好,其次为寡雄腐霉可湿性粉剂2 500倍液处理,枯草芽孢杆菌可湿性粉剂500倍液也有一定促生作用。植物根际中不仅存在大量对植物病原菌具有抑制作用的拮抗细菌,还有许多促进植物生长的根际促生细菌( PGPR) [45-46]。本试验选用自主筛选出的JX-13菌株及其菌液加工的制剂,能有效抑制草莓枯萎病菌,在田间试验中也表现出较好的促生防病作用,值得进一步研究并加快开发,其防治病害和促生的机理有待深入研究。
参考文献:
[l]吉沐祥,杨勇,彭燕琼,等,江苏草莓生产现状与消费需求调查分析及其发展建议[J].江苏农业科学,2017,45( 16):336-340.
[2] 周游,李海梅,赵金山,等,乳酸菌对草莓生长和品质性状的影响[J].江苏农业学报,2017,33(5):1124-1128.
[3] 闵红,陈磊,呼世斌,等,大棚果蔬连作土壤肥力限制性因子研究[J].西北农林科技大学学报(自然科学版),2010,38(8):160-166.
[4]吉沐祥,陈宏州,庄义庆,等,设施草莓土传病害无害化综合防治技术[J].江苏农业科学,2015.43(2):126-127.
[5]刘奇志,李星月,刘艳斌,等,国内外草莓连作障碍与综合治理研究进展[J].中国果树,2012 (6):58-62.
[6]刘喜更.草莓重茬土壤病害防治技术研究取得新突破[J].北京农业,1998(8):33.
[7] 申光辉.草莓连作根腐病发生机制与微生物及化学修复研究[D].杨凌:西北农林科技大学,2012.
[8]顾春波,姜莉莉,王开运,等,抗戊唑醇草莓枯萎病菌ZY-W的诱导及其生物学特性[J].中国农业科学,2010,43( 14):2897-2904.
[9]伊海靜,陈艳,刘正坪,等,草莓枯萎病菌的分离鉴定及防治药剂筛选[J].西北农业学报,2016,25(4):626-635.
[10]杨焕青,王开运,范昆,等,草莓枯萎病的生物学特性及7种杀菌剂及其抑制作用[J].植物保护学报,2008,35(2): 169-174.
[11]顾春波,史晓斌,姜莉莉,等,草莓枯萎病菌对多菌灵的抗性及其抗性菌株生物学特性[J].植物保护学报,2010,37(3): 266-272.
[12]LIU S,CHE Z,CHEN G. Multiple-fungicide resistance to carben-dazim, diethofencarb, procymidone, and pyrimethanil in field iso-lates of BotrYtis cinerea from tomato in Henan province, China[J].Crop Protection, 2016, 84: 56-61.
[13]段海明,余利,黄伟东,等,不同温度下6种化学杀菌剂对玉米茎腐病菌的抑制活性及与生防菌发酵上清液的混配[J].江苏农业学报,2018,34(1):41-49.
[14]高旭利,李永腾,刘文宝,等,利用生防细菌防治黄瓜根结线虫病研究[J].山东农业科学,2018,50(8):116-119.
[15] LUO Y, CHENC Y. YI J, et al- Complete genome sequence of in-dustrial biocontrol strain Paenibacillus polymyxa HY96-2 andfurther analvsis of its biocontrol mechanism[J].Frontiers in Micro-biology, 2018,9:1-14.
[16] WESELOWSKI B. NATHOO N. EASTMAN A W, et al.Isolation. identification and characterization of Paenibacillus poly-myxa CRI with potentials for biopesticide, biofertilization,biomass degradation and biofuel production [J]. BMCMicrobiology. 2016, 16(1):244.
[17]余小兰,邹立飞,邹雨坤,等.甜瓜枯萎病拮抗菌的筛选及鉴定[J].南方农业学报,2018 .49(6):1118-1124.
[18]王 波,周涧楠,黄忠勤,等.一株多牯类芽孢杆菌Paenibacillus polymyxa对甘薯黑斑病的生物防治效果及作用机理初探[J].江西农业学报,2017,29(10):40-43.
[19]曹远银,王婉琳,申璐岚,等.小麦白粉病生防菌拟诺卡氏菌属TMG-8菌株的筛选研究[J].江苏农业科学,2017,45(1): 95-99.
[20]周京龙.一株棉花内生蜡状芽孢杆菌对棉花黄、枯萎病的防治作用及机理[D].荆州:长江大学,2017.
[21]吴祥,姚克兵,吉沐祥,等.句容地区草莓枯萎病病原菌的分离鉴定及田间防治[J].江苏农业学报,2015. 31(4): 764-770.
[22]杜秉海.微生物学实验[M].北京:北京农业大学出版社.1994.
[23]东秀珠,蔡妙英,常见细菌系统鉴定手册[M].北京:科学m版社,2001.
[24] AUSUBEL F M. BRENT R, KINGSTON R E, et al-Short proto-cols in molecular biology[M]. 3rd ed. Chichester: JohnWiley&Sons, 1995.
[25] LA DUCM T,SATOMI M, AGATA N. et al-gyrB as a phyloge-netic discriminator for members of the Bacillus anthracis-cereus-thuringiensis group[J].Journal of Microbiological Methods, 2004,56(3):383-394.
[26]KUPFER M, KUHNERT P,KORCZAK B M. et aI-Cenetic rela-tionships of Aeromorzas strains inferred from /65 rRNA,gyrB andrpoB gene sequences-J].International Journal of Systematic andEvolutionary Microbiology. 2006, 56( 12): 2743-2751.
[27]WANC H. SHI Y, WANG D. et al-A biocontrol strain of Bacillussubtilis WXCDD105 used to control tomato Botrytis cinerea andCladosporiumfulvum Cooke and promote the growth of seedlings[J]. International Joumal of Molecular Sciences. 2018. 19(5):1371.
[28]许彦,罗丰,杨礼哲,等.几种杀菌剂对西瓜枯萎病的室内毒力测定[J].热带农业科学,2010, 30( 10):18-19, 26.
[29] RYBAKOVA D. RACK-WETZLINGER U. CERNAVA T,et aI.Aerial warfare:a volatile dialogue between the plant pathogen Ver-ticillium longisporum and its antagonist Paenibacillus polymyxa[J]Frontiers in Plant Science, 2017,8:1294.
[30]郑雪芳,刘波,朱育菁,等,设施番茄连作障碍土壤修复及其对青枯病害的防治效果[J].中国生物防治学报,2018, 34(1):117-123.
[31]乔俊卿,陈志谊,梁雪杰,等.枯草芽孢杆菌Bs916防治番茄青枯病[J].中国生物防治学报,2016, 32(2):229-234.
[32]王刘庆,王秋影,廖美德,多粘类芽孢杆菌生物特性及其机理研究进展[J]。中国农学通报,2013,29(11):158-163.
[33] DUKSTERHUIS J, SANDERS M. CORRIS L G M. et al.Antibi-osis plays a role in the context of direct interaction during antago-nism of Paenibacillus polymyxa towards Fusarium oxysporum[J].Joumal of Applied Microbiology. 1999, 86(1):13-21.
[34]ABD EL DAIM I A. HACGBLOM P,KARLSSON M. et al. Paeni-bacillus polyrnyxa A26 Sfp-type PPTase inactivation limits bacterialantagonism against Fusarium grarrunearum but not of F culmorumin kernel assay[J].Frontiers in Plant Science. 2015,6:368.
[35]范磊,张道敬,刘振华,等.多粘类芽孢杆菌HY96-2产脂肽类抗真菌物质的研究[J].天然产物研究与开发,2012( 24): 729-735.
[36] MEI L,LIANC Y, ZHANC L,et al.Induced svstemic resistanceand growth promotion in tomato bv an indole-3-acetic acid- producing strain of Paenibacillus polymyxa[J].Annals of AppliedBiology. 2014, 165(2):270-279.
[37]马夙静.多粘类芽孢杆菌ZYPP18的分离鉴定与促生防病效果鉴定[D].济南:山东农业大学,2018.
[38] SHI L,DU N. SHU S,et al.Paenibacillus polymyxa NSY50 sup-presses Fusarium wilt in cucumbers by regulating the thizosphericmicrobial community[J].Scientific Reporrs, 2017,7:41234.
[39] DU N, SHI L,YUAN Y, et al-Isolation of a potential biocontrolagent Paenibacillus polymyxa NSY50 from vinegar waste compostand its induction of host defense responses against Fusarium wilt ofcucumber[J].Microbiological Research, 2017, 202, 1-10.
[40]陳雪丽,王光华,金剑,等.多粘类芽孢杆菌BRF-I和枯草芽孢杆菌BRF-2对黄瓜和番茄枯萎病的防治效果[J].中国生态农业学报,2008, 16(2):446-450.
[41] YAO Y E,YUAN J, YANG F,et al-PC.PR strain Paenibacilluspolymyxa SQR-21 potentially benefits watermelon growth by re-sha-ping root protein expression[J].AMB Express, 2017,7:104.
[42]朱金英.微生物菌剂在设施黄瓜和番茄上的应用效果研究[D].济南:山东农业大学,2014.
[43]PADDA K P,PURI A. CHANWAY C P.Effect of GFP tagging ofPaenibacillus polymyxa P2b-2R on its ability to promote growth ofcanola and tomato seedlings[J].Biology and Ferlility of Soils,2016, 52(3):377-387.
[44]LI J,LIU W,LUO L,et al-Expression of Paenibacillus polymyxaβ-l. 3-1, 4-glucanase in Streptomyces lydicus AOI improves itsbiocontrol effect against Botrytis cinerea[J].Biological Control,2015. 90:141-147.
[45]刘丹丹,李敏,刘润进,我国植物根围促生细菌研究进展[J].生态学杂志,2016. 35(3):815-824.
[46] ABBASI M K. SHARIF S,KAZMI M, et aI.Isolation of plantgrowth promoting thizobacteria from wheat thizosphere and theireffect on improving growth, yield and nutrient uptake of plants[J].Plant Biosvstems, 2011, 145(1):159-168.
(责任编辑:王妮)
