基于SIRT1/NF-κB炎性通路探讨加味脑泰方对血管性痴呆大鼠学习记忆及海马组织病理形态的影响
2019-09-10易亚乔何清湖刘检刘林成绍武廖君王国佐谭琥刘吉勇陈俊炜郭艳幸葛金文
易亚乔 何清湖 刘检 刘林 成绍武 廖君 王国佐 谭琥 刘吉勇 陈俊炜 郭艳幸 葛金文
〔摘要〕 目的 探討加味脑泰方(以下简称JWF)对血管性痴呆(vascular dementia, VD)大鼠SIRT1/NF-κB p56炎性通路的调控作用。方法 采用双侧颈总动脉结扎法(two-vessel occlusion, 2-VO)复制VD大鼠模型。实验设正常组,假手术组,模型组,JWF高、中、低剂量组和奥拉西坦组,其中JWF高、中、低剂量组和奥拉西坦组分别灌胃给予JWF17.0、34.0、51.0 g/kg和奥拉西坦0.216 g/kg,其余3组灌服等容量蒸馏水,连续干预30 d。采用Morris水迷宫、HE染色分别检测大鼠学习记忆能力和海马组织病理形态变化;采用免疫组化检测沉默信息调节因子-1(silent informatio regulator-1, SIRT1)、核因子κB抑制蛋白d亚基(The nuclear factorκB inhibits theprotein subunit, IκBα)、核因子-κB(nuclear factor-kappa B, NF-κB)蛋白表达情况。结果 与正常组比较,模型组大鼠学习记忆能力显著降低(P<0.05),海马神经元变性、坏死,炎性细胞浸润增加,且SIRT1、IκBα表达下调,NF-κB p56表达上调(P<0.05);与模型组比较,奥拉西坦组和JWF高、中剂量组大鼠学习记忆能力显著增强(P<0.05),海马组织中神经元锥体细胞排列较整齐,轮廓清晰,炎性细胞浸润显著减少,且海马组织内SIRT1、IκBα表达上调,NF-κB p56表达下调(P<0.05)。结论 JWF对血管性痴呆大鼠炎性相关信号通路SIRT1/NF-κB p56具有明显的调控作用,这可能是其保护VD大鼠海马神经元继而改善学习记忆能力的重要机制之一。
〔关键词〕 加味脑泰方;血管性痴呆;海马组织;沉默信息调节因子-1;核因子κB抑制蛋白d亚基;核因子-κB
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.06.002
〔Abstract〕 Objective To investigate the regulatory effects of Jiawei Naotai Formula (JWF) on inflammatory pathway of SIRT1/NF-κB p56 in rats with vascular dementia (VD). Methods The model of VD rats was established by bilateral common carotid artery ligation assay (two-vessel occlusion, 2-VO). There were normal group, sham operation group, model group, JWF groups of high, moderate and low dose, as well as oxiracetam group in this experiment. The JWF groups of high, moderate and low dose, and the oxiracetam group were given 17.0, 34.0 and 51.0 g/kg Jiawei Naotai Formula and 0.216 g/kg oxiracetam respectively, while the other 3 groups were given the same amount of distilled water, for 30 d of consecutive intervention. The learning and memory ability and the pathological morphology changes of hippocampal tissue of rats were detected by Morris water maze and HE staining, respectively. The protein expressions of SIRT1, IκBα and NF-κB were detected by immunohistochemistry. Results Compared with the normal group, the learning and memory ability of rats in the model group was obviously decreased (P<0.05); degeneration and necrosis of hippocampal neurons was detected and inflammatory cell infiltration was increased; the expressions of SIRT1 and IκBα were decreased, while that of NF-κB p56 was increased (P<0.05). Compared with the model group, the learning and memory ability of rats in the oxiracetam group and the JWF groups of high, moderate and low dose were notably improved (P<0.05); the neuron pyramidal cells in the hippocampal tissue were more orderly arranged with clear outlines, and inflammatory cell infiltration was obviously decreased; the expressions of SIRT1 and IκBα was increased, while that of NF-κB p56 was decreased (P<0.05). Conclusion There are significant regulatory effects of JWF on inflammatory pathway of SIRT1/NF-κB p56 in rats with vascular dementia, which may be one of the important mechanisms for protecting hippocampal neurons of VD rats and subsequently improving the learning and memory ability.
〔Keywords〕 Jiawei Naotai Formula; vascular dementia; hippocampal tissue; SIRT1; IκBα; NF-κB
血管性痴呆(vascular dementia,VD)是指各种脑血管疾病所致的严重认知功能障碍综合征[1],且其发病机制依旧未明。目前,临床治疗VD主要从改善认知功能紊乱及保护脑细胞等方面着手[2-3],西药疗效不佳。研究发现沉默信息调节因子-1(silent information regulator-1, SIRT1)在调控细胞衰老、代谢紊乱等方面发挥着重要作用[4],另SIRT1 mRNA在海马神经元具有丰富表达,其能通过抗炎效应而减轻缺血缺氧性脑损伤,而炎症反应在血管痴呆等慢性脑缺血后的继发性神经损伤疾病发生、发展过程中起着重要作用,由此推测SIRT1可能是VD的重要防治靶点。加味脑泰方(以下简称JWF)由黄芪、川芎、远志等七味药组成。我们前期研究发现,JWF能有效改善VD大鼠学习记忆能力,并显著抑制炎性因子(nuclear factor-kappa B, NF-κB)的表达[5-6]。因此,本文拟采用双侧颈总动脉结扎法(two-vessel occlusion, 2-VO)复制大鼠血管性痴呆模型,同时基于SIRT1/NF-κB p56炎性通路进一步探讨JWF对VD大鼠的保护作用及潜在作用机制。
1 材料与方法
1.1 实验动物
SPF級雄性SD大鼠50只,5~6周龄,体质量220~240 g,购自湖南斯莱克景达实验动物有限公司,许可证号为SCXK(湘)2013-0004。
1.2 药物与试剂
JWF由黄芪、当归、地龙、川芎、三七、石菖蒲、远志组成,中药饮片均购自湖南中医药大学第一附属医院。JWF大鼠等效剂量为17.01 g/kg。奥拉西坦胶囊,购自石药集团,大鼠临床等效剂量为0.216 g/kg。兔抗大鼠多克隆抗体SIRT1、核因子κB抑制蛋白d亚基(The nuclear factorκB inhibits theprotein subunit, IκBα)、NF-κB p56均购自Proteintech公司(其货号分别为10268-1-AP、10268-1-AP及10745-1-AP)。
1.3 主要仪器
MT-200型Morris水迷宫(成都泰盟科技有限公司);Motic B5型图像分析系统(麦克奥迪公司)。
1.4 动物造模、分组及干预
50只大鼠适应性饲养3 d后,随机选取44只,其中6只大鼠仅游离双侧颈总动脉而不结扎,作为假手术组大鼠,其余38只参照文献方法[7]采用2-VO法复制VD大鼠模型,术后24 h合计3只大鼠死亡。采用Morris水迷宫试验剔除造模后不合格大鼠(即逃避潜伏期小于5 s或大于120 s),经筛选后有5只大鼠不符合模型标准,最后将6只正常大鼠、6只假手术大鼠及造模成功的30只模型大鼠分为正常组,假手术组,模型组,JWF高、中、低剂量组和阳性药组,其中JWF高、中、低剂量组和阳性药组大鼠分别灌胃给予17.0、34.0、51.0 g/kg JWF和0.216 g/kg奥拉西坦,其余3组灌服等容量蒸馏水,连续干预30 d。
1.5 学习记忆能力检测
采用Morris水迷宫检测大鼠学习记忆能力,主要步骤如下:连续训练大鼠5 d,于第6天撤走水面平台,将大鼠分别从4个象限放入水中,采用Motic B5型图像分析系统记录120 s内大鼠穿越平台的次数,并将其作为学习记忆能力的体现指标。
1.6 海马组织病理学检测
采用HE染色检测大鼠海马组织病理学变化,各组大鼠海马组织样本经4%多聚甲醛固定、乙醇梯度脱水等操作后,切片,染色,最后在显微镜下观察海马神经元形态变化。
1.7 SIRT1、IκBα、NF-κB p56蛋白检测
采用免疫组化检测大鼠海马组织中SIRT1、NF-κB p56、IκBα蛋白表达情况。各组大鼠海马组织经4%多聚甲醛固定、切片脱蜡、3%双氧水处理、修复抗原等操作后,加入一抗(1∶200)4 °C过夜,然后加入HRP-IgG二抗(1∶400),最后经显色、脱水、封片等操作后,于光镜下随机取5个视野,采用Motic图像分析系统测定其平均灰度值,其中灰度值越小,提示蛋白阳性表达量越高。
1.8 统计学处理
实验数据以“x±s”表示,采用SPFF 16.0软件,通过One-Way ANOVA检验,比较各组间的显著性差异,P<0.05代表差异有统计学意义。
2 结果
2.1 JWF对VD大鼠学习记忆能力的影响
Morris水迷宫实验,模型组大鼠跨越平台次数明显减少(P<0.05);与模型组比较,奥拉西坦组及JWF高、中剂量组大鼠跨越平台次数显著增加(P<0.05),经药物干预后大鼠记忆能力均有一定改善。见表1。
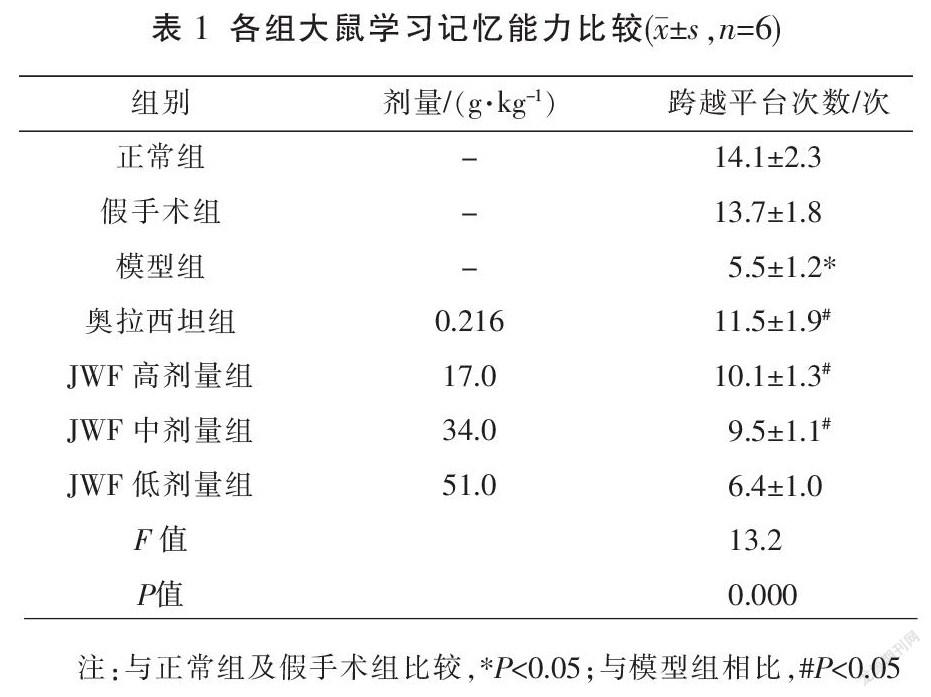
2.2 JWF对VD大鼠海马组织病理形态的影响
HE染色结果显示,模型组大鼠海马神经元变性、坏死(如箭头所示),炎性细胞浸润增加;与模型组比较,奥拉西坦组及JWF各剂量组大鼠海马神经元锥体细胞排列较整齐,轮廓清晰,炎性细胞浸润显著减少。见图1。
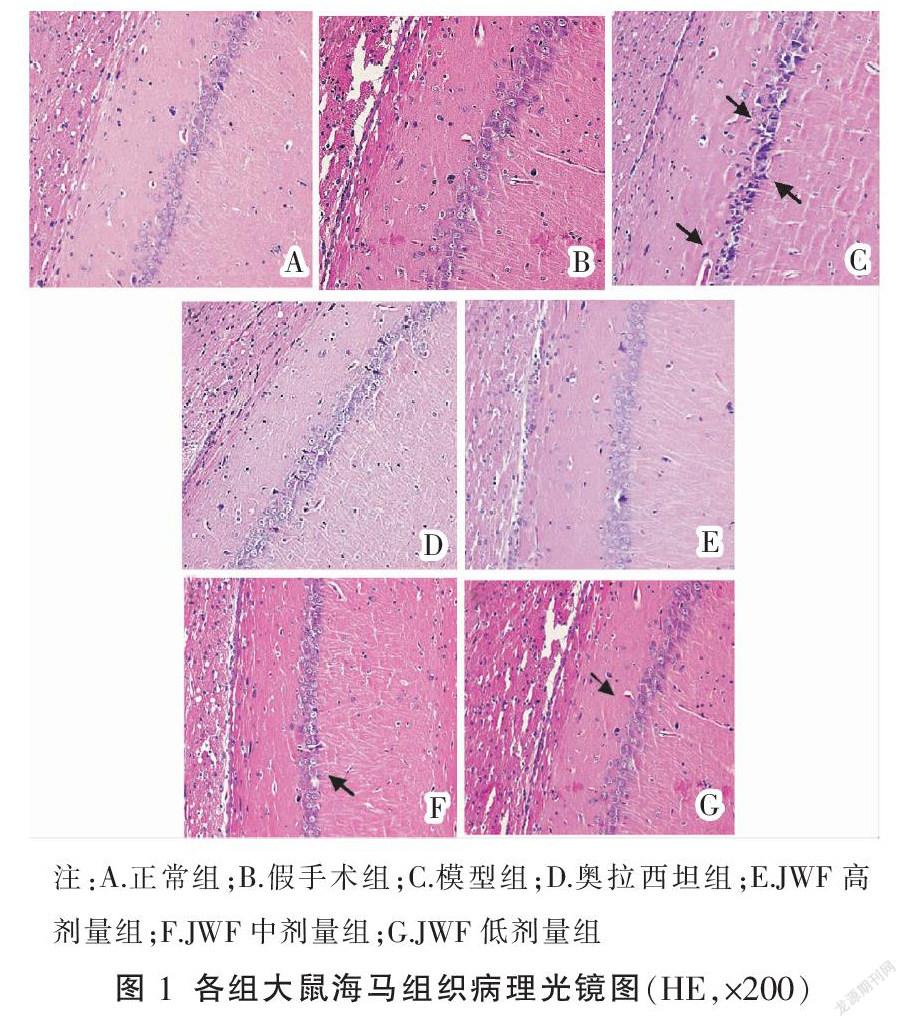
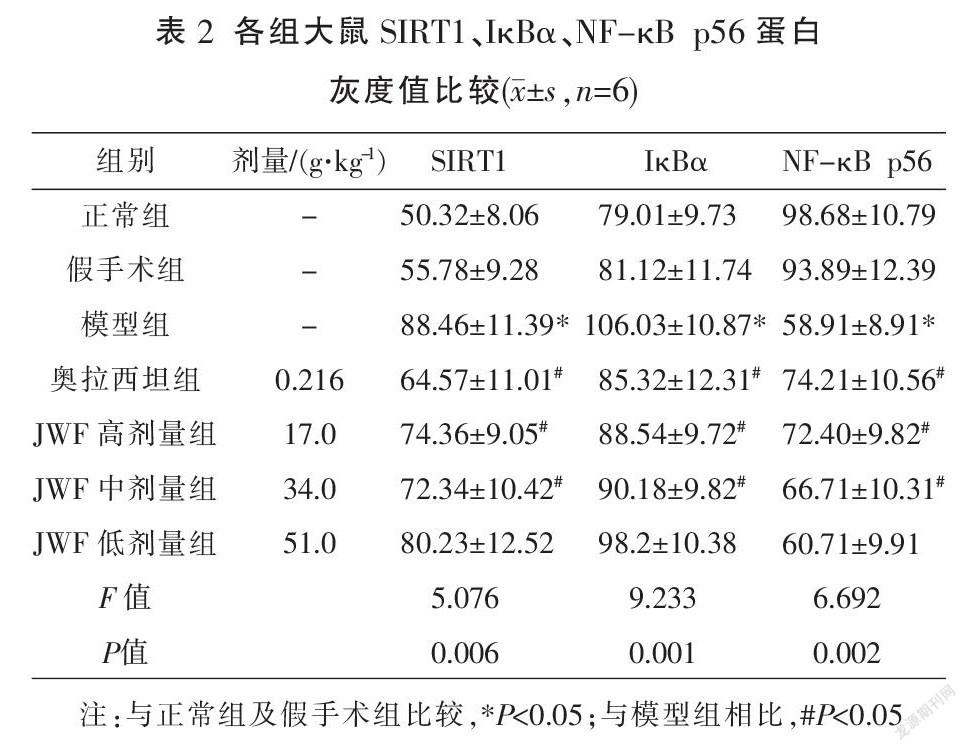
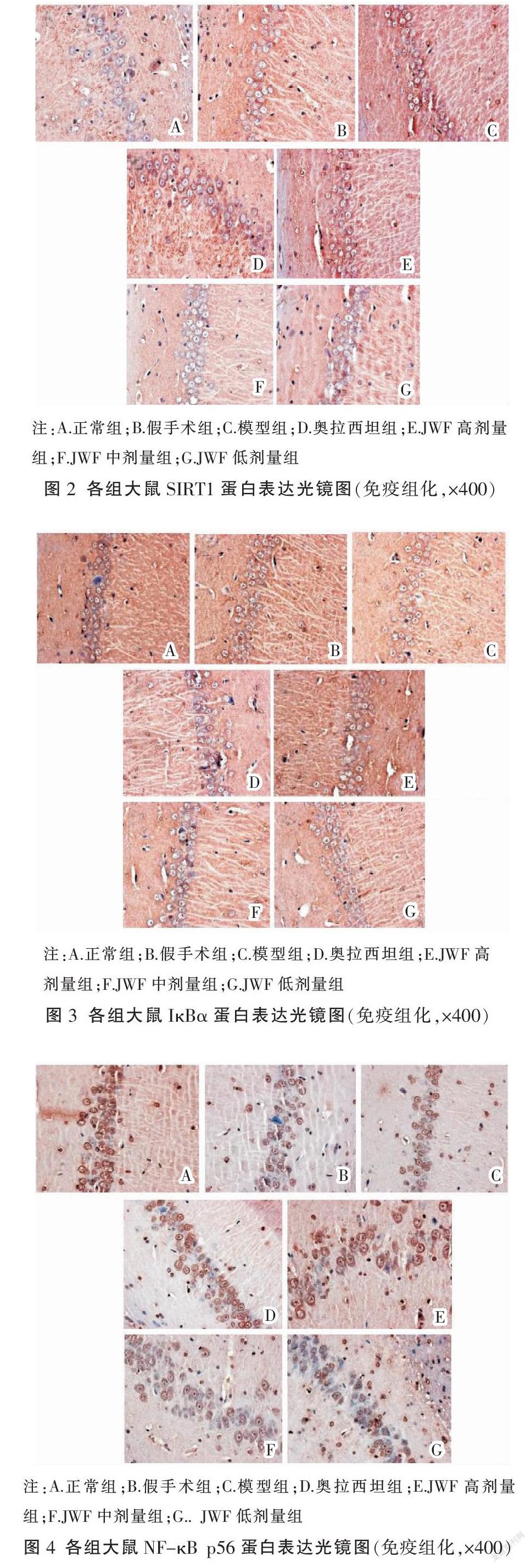
2.3 JWF对VD大鼠炎性通路SIRT1、IκBα、NF-κB p56蛋白表达的影响
免疫组化结果显示,SIRT1、NF-κB p56、IκBα蛋白阳性表达呈棕黄色或棕褐色。结果显示,模型组大鼠海马组织中SIRT1、IκBα阳性表达降低,NF-kB p56阳性表达明显升高(P<0.05);与模型组比较,奥拉西坦组及JWF高、中剂量组大鼠海马组织中SIRT1、IκBα阳性表达增加,NF-kB p56阳性表达显著减少(P<0.05),见表2、图2-4。
3 讨论
VD是指各种脑血管疾病所致的学习记忆、认知功能紊乱综合征,临床特点为遇事易忘、情绪失调、理解错误等。目前VD发病机制不明,研究发现其与脑缺血缺氧,继而引起的特定神经组织损害息息相关,因此慢性脑缺血缺氧可能是探究VD发病机制的有效途径。既往研究表明,双侧颈总动脉永久性结扎法(2-VO法)能促使海马、皮层等脑组织产生缺血缺氧性损伤,继而诱发VD[8],且该法操作简便、重现性佳,现已被广泛用于VD研究[9]。
SIRT1是一種烟酰胺腺嘌呤二核苷酸依赖性去乙酰化酶,其涉及机体DNA损伤修复、氧化应激、炎性反应等生理过程。研究发现,敲除SIRT1后,海马神经元突触可塑性明显降低,小鼠学习记忆、认知能力显著下降[10-12]。SIRT1/NF-κB信号通路参与了VD病理机制的炎症过程,当VD发生时,SIRT1促进下游信号NF-κB亚基RelA/p65去乙酰化,抑制其转录活性而调控炎症。IκBα是NF-κB抑制因子,炎症发生时前者磷酸化,并促使后者转位至细胞核,进而激活炎症反应[13]。此外,SIRTl还可直接乙酰化NF-κB p65,同时抑制IκBα磷酸化,进而减少炎症因子和趋化因子的产生,防止炎症引起的神经元损伤[14]。本文采用2-VO法复制VD大鼠模型,并予以JWF干预后,结果发现模型大鼠学习记忆能力明显下降,海马锥体细胞明显受损,炎性细胞浸润增加,炎性通路相关蛋白SIRT1、IκBα表达明显降低、NF-κB p56表达明显增加,而给予JWF干预后,大鼠学习记忆能力显著改善,海马神经元锥体细胞排列较整体,轮廓清晰,炎性细胞浸润显著减少,SIRT1、NF-kB和IκBα蛋白表达异常被明显逆转,这提示JWF可能是通过调控SIRT1/NF-κB p56信号通路保护海马神经元继而改善VD大鼠学习记忆能力。
VD属于中医学“呆病”“善忘”等范畴[15],其为本虚标实之病,本虚为气血亏虚,标实为痰瘀阻络,年老气衰,气虚行血无力,瘀阻脑络则发为痴呆,基本病机特点可用“虚、瘀、痰”来概括。加味脑泰方经补阳还五汤加减而成,由黄芪、川芎、当归、石菖蒲、远志、地龙、三七组成,方中黄芪为君、当归为臣,佐以川芎、地龙等,全方共奏益气活血、化痰祛瘀之功效。我们前期发现脑泰方具有抗血栓、抗炎等作用,能明显保护缺血缺氧脑组织[16]。现代药理学研究亦发现,当归多糖、三七皂苷等具有明显的抗炎、抗氧化、改善脑缺血及VD大鼠学习记忆功能[17]。本文结果亦再次佐证了调控炎性通路可有效保护海马神经元继而改善VD大鼠学习记忆能力。
综上所述,JWF对VD大鼠SIRT1/NF-κB p56炎性通路具有明显的调控作用,这可能是其保护海马神经元继而抗血管性痴呆的重要机制之一,后续实验我们将以SIRT1上下游的关键靶点为核心,并辅以受体阻断剂与激动剂,进一步阐明加味脑泰方对血管性痴呆大鼠的深层保护机制。
参考文献
[1] BENISTY S. Current concepts in vascular dementia[J]. Geriatr Psychol Neuropsychiatr Vieil, 2013, 11(2):171-180.
[2] MORI E. How treatable is vascular dementia?[J]. Brain Nerve, 2016, 68(4):441-450.
[3] JELLINGER K A. Pathogenesis and treatment of vascular cognitive impairment[J]. Neurodegener Dis Manag, 2014,4(6):471-490.
[4] GOMES B A Q, SILVA J P B, ROMEIRO C F R, et al. Neuroprotective Mechanisms of Resveratrol in Alzheimer's Disease: Role of SIRT1[J]. Oxidative Medicine and Cellular Longevity,2008:8152373.
[5] 易亚乔,肖碧跃,刘英飞,等.加味脑泰方对血管性痴呆大鼠学习记忆和海马区NR2A及NR2B表达的影响[J].中南医学科学杂志, 2014,42(1):17-20.
[6] 廖 君,张 薇,夏 兴,等.脑泰方对局灶性脑缺血大鼠脑组织核因子-κB、基质金属蛋白酶9及其抑制剂表达的影响[J].中国中医药信息杂志, 2013,20(9):28-30.
[7] 任晨斌,伍大华,郭 晨,等.滋肾活血方对血管性痴呆大鼠NR2A 表达的影响[J].湖南中医药大学学报,2018,38(2):141-144.
[8] BANG J, JEON W K, LEE I S, et al. Biphasic functional regulation in hippocampus of rat with chronic cerebral hypoperfusion induced by permanent occlusion of bilateral common carotid artery[J]. PLoS ONE, 2013, 8(7):e70093.
[9] LIU J M, WU P F, RAO J, et al. ST09, a Novel thioester derivative of tacrine, alleviates cognitive deficits and enhances glucose metabolism in vascular dementia rats[J]. Central Nervous System Neuroscience Therapentics, 2016, 22(3):220-229.
[10] TIAN F, YUAN C, YUE H. MiR-138/SIRT1 axis is implicated in impaired learning and memory abilities of cerebral ischemia/reperfusion injured rats[J]. Experimevtal Cell Research, 2018, 367(2):232-240.
[11] RAMADORI G, LEE C E, BOOKOUT A L, et al. Brain SIRT 1:Anatomical Distribution and Regulation by Energy Availability[J]. Jeurosci, 2008, 28(40):9989-9996.
[12] MICHAN S, LI Y, CHOU M M, et al. SIRT1 is essential for normal cognitive function and synaptic plasticity[J]. The Journal of Neuroscience, 2010, 30(29):9695-9707.
[13] YANG H, ZHANG W, PAN H, et a1. SIRT1 activators suppress inflanrmtory responses through promotion of p65 deacctylation and inhibition of NF-KB activity[J]. PLoS ONE, 2012, 7:e46364.
[14] KAUPPINEN A, SUURONEN T, OJALA J, et a1. Antagonistic crosstalk between NF-κB and SIRT1 in the regulation of inflammation and metabolic disorders[J]. Cell Signal, 2013, 25(10):1939-1948.
[15] 郭 清,宮洪涛.从中医五脏论血管性痴呆的病机[J].中国中医药现代远程教育,2018,16(1):71-72.
[16] 石咏梅,马英民,廖 君,等.内质网应激PERK通路在脑泰方提取物保护局灶性脑缺血大鼠海马神经元中的作用[J].中国老年学杂志,2017,37(22):5512-5515.
[17] 曾 晖,胡 洁.当归小分子多糖对血管性痴呆大鼠学习与记忆功能的影响[J].中国临床药理学杂志,2015,31(11):954-956.
