糖络宁对糖尿病周围神经病变大鼠坐骨神经功能及内质网应激IRE1α-XBP-1-CHOP通路的影响
2019-09-10李潇姚伟洁杨鑫伟史浩田高变娥朱笳悦许利平
李潇 姚伟洁 杨鑫伟 史浩田 高变娥 朱笳悦 许利平


〔摘要〕 目的 探讨糖络宁对糖尿病周围神经病变(diabetic peripheral neuropathy, DPN)大鼠内质网应激(endoplasmic reticulum stress, ER stress)IRE1α-XBP-1-CHOP通路的影响。方法 建立DPN大鼠模型,设置空白对照组(Control)、模型对照组(Model)、氧化三甲胺组(TMAO)、糖络宁低剂量组(LTLN)和糖络宁高剂量组(HTLN),分别灌胃给药12周。采用放射免疫试剂盒测定稳态胰岛素抵抗指数;采用透射电镜和劳克坚劳蓝染色观察坐骨神经结构;测定鼠尾热痛阈值、神经传导速度和蛋白基因产物9.5(protein gene product 9.5, PGP 9.5)蛋白的表达并检测周围神经功能;采用Western blot法检测葡萄糖调节蛋白78(glucose-regulated protein 78, GRP 78)、X盒结合蛋白1(X-box binding protein1, XBP-1)、凋亡蛋白C/EBP同源蛋白(CCAAT/enhancer binding protein Homologous protein, CHOP)、B细胞淋巴瘤-2(B cell lymphoma-2, Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)和磷酸化真核翻译起始因子2α (phospho-ukaryotic translation initiation factor 2α, P-eIF 2α)的蛋白表达;通过免疫荧光组织化学法检测肌醇激酶1 (inositol requiring enzyme1α, IRE 1α)、生長停滞及 DNA损伤基因34 (growth-arrest and DNA damage-inducible gene 34, GADD 34)和内质网氧化蛋白(endoplasmic oxidoreductin-1-like, Ero1α)指标。结果 与模型组比,糖络宁高、低剂量组能够有效改善坐骨神经的结构和功能,并能够影响内质网应激IRE1α-XBP-1-CHOP凋亡通路提高GRP 78、Bcl-2和P-eIF 2α的表达(P<0.05),降低P-IRE1α、XBP-1、CHOPGADD 34、Bax和Ero1α的表达(P<0.05)。结论 糖络宁能够通过抑制ER stress中IRE1α-XBP-1-CHOP凋亡途径相关蛋白的表达,从而减轻ER stress诱导的细胞凋亡,改善坐骨神经的结构和功能从而防治DPN。
〔关键词〕 糖络宁;糖尿病周围神经病变;内质网应激;X盒结合蛋白1;凋亡蛋白C/EBP同源蛋白
〔中图分类号〕R285.5;R587.1 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.07.011
〔Abstract〕 Objective To explore the effects of Tangluoning (TLN) on the IRE1α-XBP-1-CHOP pathway under endoplasmic reticulum (ER) stress in diabetic peripheral neuropathy (DPN) rats. Methods DPN rat model was established, with Control group, Model group, Trimethylamine oxide (TMAO) group, Low-dose Tangluoning (LTLN) group and High-dose Tangluoning (HTLN) group, and they were treated with intragastric administration for 12 weeks. Homeostasis model of assessment for insulin resistance index(HOMA-IR)was determined by a radioimmune outfit. The sciatic nerve structure was observed by transmission electron microscope (TEM) and luxol fast blue (LFB). Thermal perception threshold (TPT) of the rat tail, motor nerve conduction velocity (MNCV) and sensor nerve conduction velocity (SNCV), and the expression of protein gene product 9.5 (PGP 9.5) were measured. And the peripheral neurological function was determined. Western blot analysis was used to assess the expressions of glucose-regulated protein 78 (GRP 78), X-box binding protein 1 (XBP-1), CCAAT/enhancer binding protein Homologous protein (CHOP), B cell lymphoma-2 (Bcl-2), Bcl-2 Associated X Protein (Bax) and phospho-ukaryotic translation initiation factor 2α (P-eIF2α). Immunohistochemistry was used to detect the expressions of inositol requiring enzyme 1 (IRE1α), growth-arrest and DNA damage-inducible gene 34 (GADD34) and endoplasmic oxidoreductin-1-like (Ero1α). Results Compared with the Model group, TLN could significantly improve the morphological structure and neurological function of the sciatic nerve. TLN had an impact on the IRE1α-XBP-1-CHOP pathway under ER stress by enhancing the expressions of GRP78, Bcl-2 and P-eIF 2α (P<0.01), and reducing the expressions of P-IRE 1α, XBP-1, CHOP, GADD 34, Bax and Ero1α (P<0.01). Conclusion TLN can inhibit the expressions of correlative proteins in the IRE1α-XBP-1-CHOP pathway under ER stress to alleviate the cell apoptosis induced by ER stress, and improve the structure and function of the sciatic nerve, in order to prevent the DPN.
〔Keywords〕 Tangluoning; diabetic peripheral neuropathy; endoplasmic reticulum stress; XBP-1; CHOP
根据国际糖尿病联合会报告,2015年有4.15亿人患有糖尿病[1],超50%会发展成为糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)[2],DPN会导致慢性疼痛,足溃疡,甚至截肢[3]。DPN的发病机制很复杂,近期研究表明内质网应激(endoplasmic reticulum stress,ER stress)参与了DPN的发生发展[4-5]。
糖络宁由高彦彬教授长期临床实践总结而来的经验方,是在中医理论指导下,结合络病学说,根据肝肾亏虚,络气虚滞,络脉瘀阻病机,以益气养阴、滋补肝肾、活血通络为治则的基础上辨证处方。在临床上能够有效治疗DPN,如提高神经传导速度(nerve conduction velocity, NCV)和糖尿病神经积分[6]。前期研究中已证明糖络宁能够改善氧化应激[7]。近期有研究表明,氧化应激并不是引起DPN发生的直接因素,由ER stress引起的细胞凋亡要早于氧化应激的发生[8]。因此,本实验从ER stress诱导的细胞凋亡途径探讨糖络宁的作用机制。
高血糖,脂代谢异常是诱发内质网应激的重要因素之一[5]。我们选择高脂饲料饲养联合链脲佐菌素(streptozocin, STZ)的方法模拟临床高糖高脂,胰岛素抵抗(insulin resistance, IR)的情况复制DPN大鼠模型。通过观察糖络宁对DPN大鼠稳态胰岛素抵抗指数(homeostasis model of assessment for insulin resistance index, HOMA-IR),神经形态和功能,以及ER伴侣蛋白(glucose-regulated protein 78, GRP 78)的影响,确定DPN的发生存在ER stress的参与。并通过观察糖络宁对ER stress凋亡途径相关蛋白葡萄糖调节蛋白78(glucose-regulated protein 78, GRP 78)、X盒结合蛋白1(X-box binding protein1, XBP-1)、凋亡蛋白C/EBP同源蛋白(CCAAT/enhancer binding protein Homologous protein, CHOP)、B细胞淋巴瘤-2(B cell lymphoma-2, Bcl-2)、Bcl-2 相关 X 蛋白(Bcl-2 associated X protein, Bax)和磷酸化真核翻译起始因子2α(phospho-ukaryotic translation initiation factor 2α,P-eIF 2α)蛋白的影响,探讨糖络宁是否能够通过干预ER stress凋亡途径相关蛋白的表达减轻ER stress诱导的细胞凋亡。
1 材料
1.1 药物
糖络宁由黄芪、丹参、川牛膝、鸡血藤、狗脊、赤芍、木瓜、延胡索组成,饮片均购自北京市中医院同仁堂,经首都医科大学中医药学院罗容副教授鉴定符合《中华人民共和国药典》2015年版标准。糖络宁复方按处方剂量加入10倍量蒸馏水室温浸泡1 h后,沸水煎煮2次,每次1 h。过滤后合并两次药液,浓缩制成一定浓度水煎液,4 ℃冷藏备用。
1.2 动物
SPF级雄性SD大鼠(200±20)g来自首都医科大学实验动物中心,购自维通利华实验动物技术有限公司,动物许可证编号:SCXK(京)2012-0001。所有实验过程均经首都医科大学实验动物伦理委员会(伦理编号:AEEI-2014-086)审核,大鼠在SPF环境中饲养,自由进水进食。
1.3 主要试剂和抗体
链脲佐菌素(S0130)、氧化三甲胺(317594),Mouse anti-GRP 78抗体(sc-376768)、Mouse anti-CHOP抗体(sc-7351)、Mouse anti-Ero1α抗体(sc-100805)、Mouse anti- Bax抗体(sc-7480)、Rabbit anti-GADD34抗体(sc-8327)、Rabbit anti-P-eIF2α抗体(sc-293100)、Rabbit anti-IRE1α抗体(sc-20790)均来自Santa Cruz;Rabbit anti-P-IRE1α抗体(ab48187)、Rabbit anti-XBP-1抗体(ab37152)、Rabbit anti-PGP 9.5抗体(ab108986)均来自Abcam;辣根酶标记山羊抗小鼠IgG(H+L)(ZB-2305)、辣根酶标记山羊抗兔IgG(H+L)(ZB-2301)、FITC标记山羊抗小鼠IgG(H+L)(ZF-0312)、FITC标记山羊抗兔IgG(H+L)(ZF-0311)、Mouse anti-β-actin抗体(TA-09)均来自中杉金桥。
1.4 主要仪器
3K15低温离心机(Sigma);SpectraMax Plus 384全波长酶标仪(Molecular Devices);DV215CD电子天平(OHAUS)ECLIPSE 80i高级研究型显微镜(Nikon);
LWD300-38LTI三目倒置相差显微镜(上海测维光电);YLS-12A光照鼠尾测痛仪;JEM-1400高衬度透射电子显微镜(日本电子株式会社)。
2 方法
2.1 DPN模型的建立[9]及分组干预
大鼠适应性喂养1周后,随机分成5组,空白对照組(Control)、模型对照组(Model)、氧化三甲胺组(TMAO)、糖络宁低剂量组(LTLN)和糖络宁高剂量组(HTLN),其中,Model、TMAO、LTLN组和HTLN组大鼠给予高脂饲料(配方:10%猪油,20%蔗糖,2.5%胆固醇,0.5%胆酸盐,67%基础饲料)喂养4周,Control组大鼠给予普通饲料喂养。定期测定血脂,待高血脂形成后禁食12 h造高血糖模型,Model、 TMAO、LTLN组和HTLN组大鼠腹腔注射35 mg/kg STZ,Control组注射相同容积的枸橼酸缓冲液。一周后测大鼠空腹血糖。大鼠空腹血糖(fasting blood glucose,FBG)≥16.7 mmol/L被认定高血糖模型成立复制DPN模型,除Control组外,各组继续给予高脂饲料喂养。TMAO组110 mg/(kg·d),LTLN组5.45 g/(kg·d)和HTLN组10.9 g/(kg·d)大鼠分别灌胃给药12周。
2.2 DPN模型和内质网应激 IRE1α-XBP-1-CHOP通路的相关指标检测
2.2.1 HOMA-IR的测定[10] 大鼠给药12周后禁食12 h,尾静脉取血并离心(4 ℃、 3 000 r/min、 15 min),测定空腹血糖(fasting blood glucose, FBG)和空腹胰岛素水平(fasting insulin, FINS)。
HOMA-IR= (FBG×FINS)/22.5
2.2.2 鼠尾热痛阈值(thermal perception threshold,TPT)的测定 TPT的测定采用杨鑫伟等[11]的实验方法。使用鼠尾热痛仪热源刺激大鼠尾尖,测定时间阈设定为16 s以防伤害鼠尾。
2.2.3 坐骨神经神经传导速度(nerve conduction velocity,NCV)的测定 大鼠处死前麻醉,坐骨神经NCV的测定采用杨鑫伟等[11]的实验方法。将左侧坐骨神经暴露,刺激电极和记录电极置于坐骨神经下面,用单方波脉冲刺激测定NCV。
2.2.4 坐骨神经的处理 测完NCV以后的坐骨神经分离出来并转移到-80 ℃冰箱中保存。另一侧坐骨神经分离出来后分成两部分,一部分固定在10%中性甲醛中,并进行包埋处理,横切成厚度为5 μm的切片,用于劳克坚蓝染色和免疫荧光检测。另一部分用于透射电镜超微结构的观察。
2.2.5 坐骨神经的超微结构观察 坐骨神经用电镜液4 ℃固定保存,然后将样本送至首都医科大学电镜中心进行透射电镜超微结构观察。
2.2.6 劳克坚蓝染色(Luxol fast blue, LFB)分析坐骨神经脱髓鞘现象 坐骨神经经过脱蜡水化处理后,使用劳克坚蓝染液37 ℃孵育过夜。使用95%乙醇漂洗,并浸泡在碳酸锂中反应5 s,继续使用70%乙醇浸泡10 s。脱水透明后,使用中性树胶封片,每样本随机选取6个不同区域,使用NIS-Elements BR 3.0 system进行拍片(40×),并对坐骨神经髓鞘区域进行积分密度测定,在分析时采用积分光密度(integral optical density, IOD)一栏数据反应坐骨神经髓鞘积分密度,输入SPSS统计软件进行统计。髓鞘积分密度低时,产生脱髓鞘现象。
2.3 Western blot法分析坐骨神经中相关蛋白
将坐骨神经置于RIPA裂解液(含蛋白酶抑制剂和磷酸酶抑制剂)中匀浆,离心10 min(4 ℃, 12 000 r/min),吸取上清液,使用bicinchoninic acid (BCA)试剂盒测定蛋白浓度后制备样本。在12% SDS-PAGE凝胶孔中加入等量(30 μL)蛋白进行电泳分离,并使用半干转系统将蛋白转移到0.45 μm的PVDF膜上,使用5%脱脂奶粉将PVDF膜室温孵育2 h并使用相应一抗4 ℃孵育过夜,TBS-T浸洗后,继续室温孵育山羊抗小鼠或山羊抗兔抗体1 h,使用TBS-T浸洗后,加入超敏发光液后进行暗室曝光,在胶片上形成图像。使用β-actin抗体作为内参。用image J软件对图像进行定量分析。使用一抗如下:小鼠单克隆抗体GRP 78(1∶1 000),CHOP (1∶500),Bcl-2(1∶1 000)和Bax (1∶1 000),兔多克隆抗体PGP 9.5(1∶2 000),XBP-1(1∶2 000)和P-eIF2α (1∶1 000)。
2.4 统计学分析
使用SPSS 17.0对数据进行处理,数据采用“x±s”描述,多组独立样本比较采用单因素方差分析(One-Way ANOVA),方差齐性选择LSD分析,方差不齐性选择Tambane's T2分析。各种检验的显著性水平均设定为P<0.05。
3 结果
3.1 糖络宁对糖尿病周围神经病变模型的影响
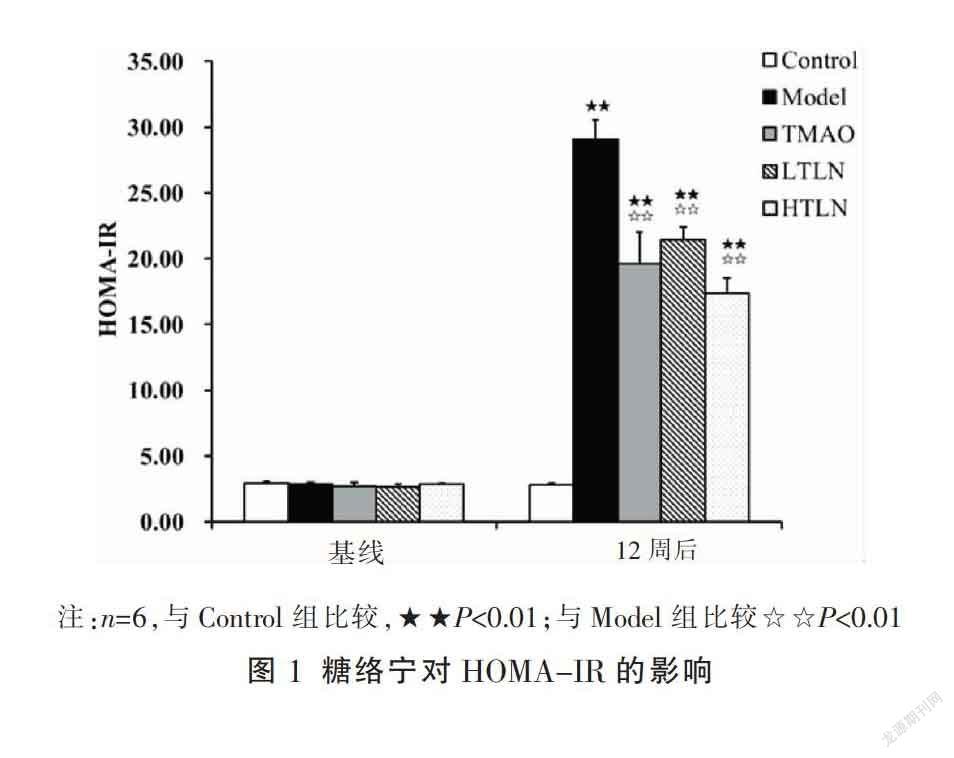
3.1.1 糖络宁对DPN大鼠HOMA-IR的影响 HOMA-IR升高表明发生了胰岛素抵抗,是DPN发生的主要诱导因素[11]。大鼠经诱导高血糖成模12周后,Model组HOMA-IR与Control组相比显著升高(P<0.01), LTLN组和HTLN组HOMA-IR与Model组相比显著降低(P<0.01),表明糖络宁能够降低HOMA-IR。见图1。
3.1.2 糖络宁对DPN大鼠坐骨神经髓鞘结构的影响 如图2A,Control组坐骨神经纤维排列整齐,密度均一且无泡沫细胞。Model组中,髓鞘纤维松弛,出现部分脱髓鞘且有大量泡沫细胞。LTLN组和HTLN组与Model组相比,髓鞘纤维松弛和髓鞘脱失现象均有所减轻。在坐骨神经劳克坚蓝染色结果中,Control组髓鞘排列紧密,分布均匀,无脱髓鞘现象。Model组中,髓鞘排列松散,分布不均,并有严重的脱髓鞘现象。如图2B,LTLN组和HTLN组髓鞘排列趋于整齐,分布趋于均匀,脱髓鞘现象也有所减轻。如图2D,与Control组相比,Model组髓鞘积分密度显著下降,LTLN组和HTLN组与Model組相比显著升高(P<0.05)。PGP 9.5蛋白能够特异性的标记神经元和神经纤维,与Control组相比,Model组PGP 9.5蛋白表达降低,与Model组相比,LTLN组和HTLN组PGP 9.5蛋白表达显著升高(P<0.01),见图2E。
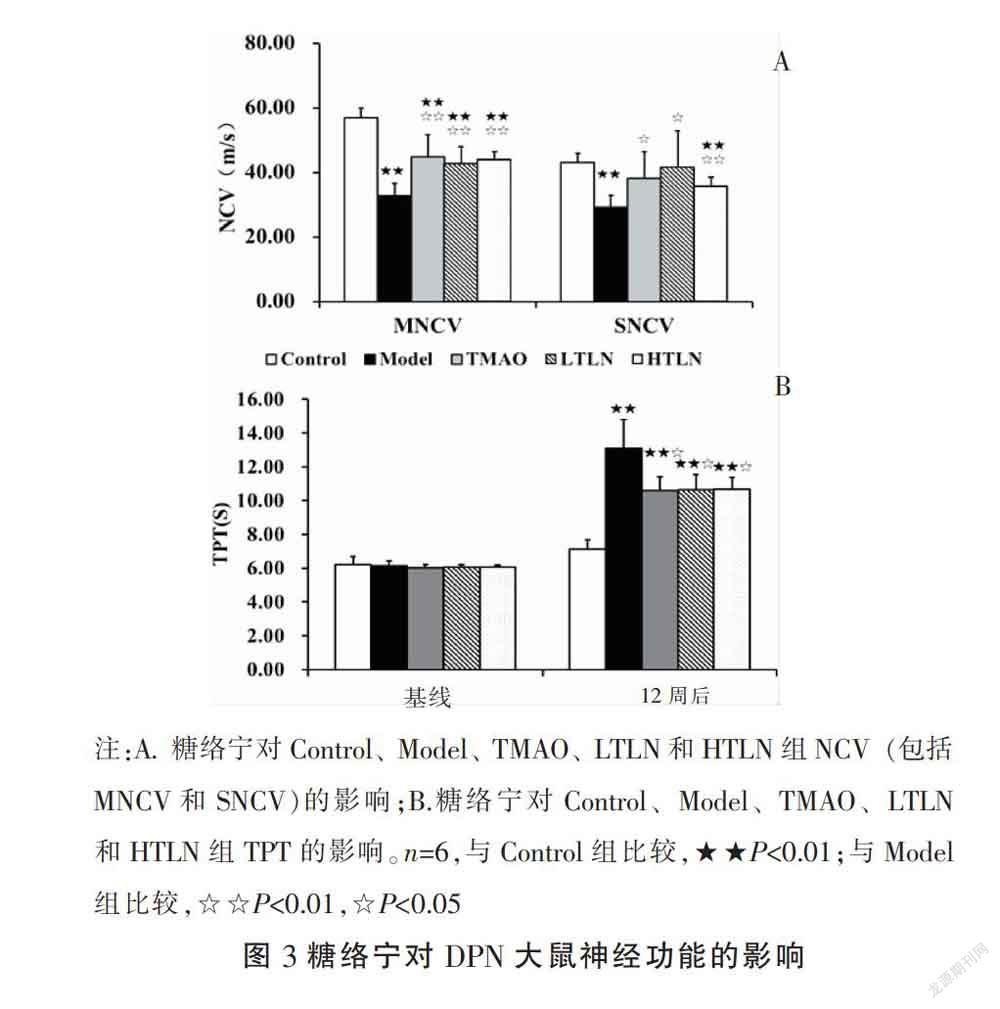
3.1.3 糖络宁对DPN大鼠坐骨神经功能的影响 NCV的降低和TPT的升高是DPN的病理特征[12]。与Control组相比,高血糖模型成立12周后Model组NCV(包括MNCV和SNCV)显著降低(P<0.01)。与Model组相比,LTLN组和HTLN组NCV显著升高(P<0.01,P<0.05)。诱导高血糖成模12周后,Model组痛阈值与Control组相比显著升高(P<0.01)。LTLN组TPT与Model组相比显著降低(P<0.05)。见图3。
3.2 糖络宁对DPN大鼠坐骨神经ER stress诱导的凋亡途径相关蛋白表達的影响
与Control组比较,Model组CHOP、Bcl-2、Bax、 GADD 34和Ero1α的表达显著升高(P<0.05,P<0.01);与Model组比较,LTLN组和HTLN组CHOP、Bax、GADD34和Ero1α表达显著降低(P<0.05,P<0.01),Bcl-2表达显著升高(P<0.01)。见图4C-E。
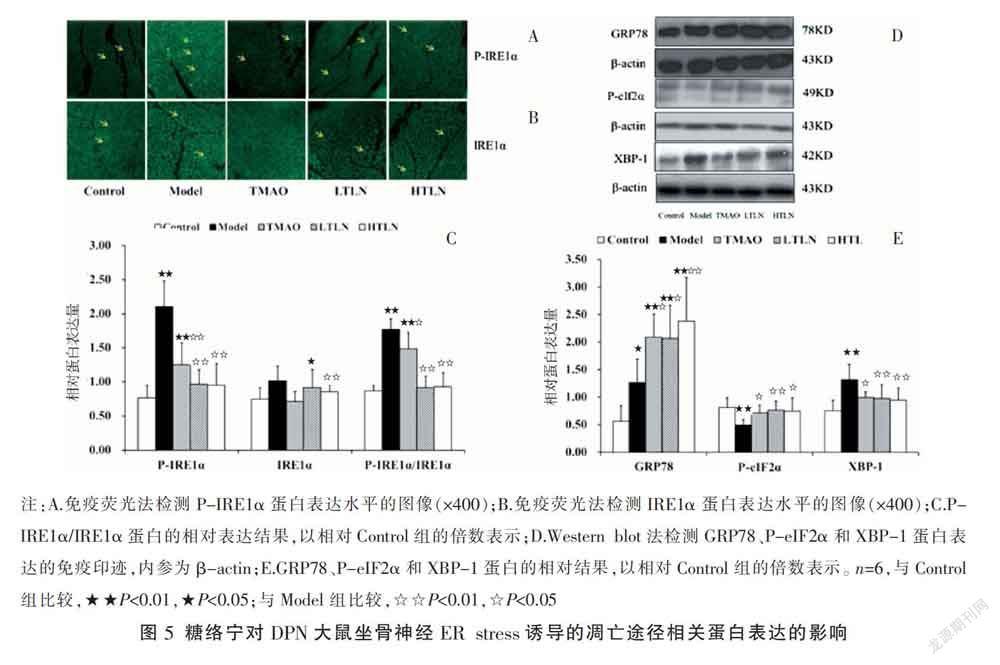
与Control组相比,Model组GRP 78、IRE1α/P-IRE1α和XBP-1显著升高(P<0.05,P<0.01),表明ER stress已经发生。Model组P-eIF 2α与Control组相比显著降低(P<0.01)。与模型组相比,LTLN组和HTLN组GRP 78和P-eIF 2α表达显著升高(P<0.05,P<0.01),IRE1α/P-IRE1α和XBP-1表达显著降低(P<0.05,P<0.01)。见图5C-E。
4 讨论
糖尿病周围神经病变是糖尿病最常见的慢性并发症之一,具有高发病率与高致残率的特点。高血糖是DPN发病的始动因素,经典的DPN发病途径包括多元醇途径、氧化应激、己糖胺途径等。近年来,内质网应激介导的细胞凋亡被认为是DPN发病的重要发病机制。
内质网(endoplasmic reticulum,ER)是调控蛋白合成和聚集的场所[13]。蛋白质在ER中经折叠修饰成为具有活性的功能蛋白质。只有正确折叠的蛋白质才能被转运到高尔基体,而错误折叠或未折叠的蛋白质留在ER中继续完成折叠过程。高血糖导致未折叠蛋白或错误折叠蛋白蓄积在ER中,引发ER stress。ER stress通过未折叠蛋白反应(unfolded protein response,UPR)使ER恢复稳态。但当ER stress持续时间过长时,UPR则不能减轻ER stress,ER stress诱导的细胞凋亡途径会被激活[14]。TMAO是天然化学伴侣[15],能够吸引伴侣蛋白治疗蛋白质折叠类疾病,清除错误蛋白在ER异常积累,防止细胞凋亡,是减轻ER stress的常用实验研究药物[16]。
GRP 78作为UPR伴侣蛋白,能够促进错折叠蛋白质进行正确折叠[17],也有维持内质网内钙稳态,延长不利因素刺激下的细胞生存期的作用。ER stress发生时,未折叠蛋白的堆积使GRP 78从膜蛋白上解离,与结合未折叠蛋白结合。而IRE1α作为内质网上的跨膜蛋白,游离状态时会形成二聚体并产生自身磷酸化作用,磷酸化的IRE1α能够剪接转录因子X盒结合蛋白1(X-box binding protein1,XBP1)前体mRNA分子中的内含子[18]。XBP1的持续表达激活位于细胞核中的ERS凋亡转录因子CHOP。CHOP是ER stress诱导细胞凋亡中最重要的标志性蛋白[19]。过表达的CHOP能够上调Bcl-2家族中促凋亡因子Bax并下调抗凋亡因子Bcl-2[20]。研究表明,促凋亡蛋白如Bax和抗凋亡蛋白Bcl-2是细胞凋亡重要的调节器[21],抑制Bcl-2会破坏ER膜的完整性和Ca2+的平衡,诱导细胞凋亡。CHOP还可以诱导Ero1α表达引起细胞凋亡[22]。此外,CHOP能够激活GADD 34的表达,磷酸化的eIF2α能够减缓甚至暂停错误蛋白的合成,但是GADD 34的表达会使eIF2α去磷酸化,从而使得错误蛋白继续合成,加重ER stress[23]。
本实验中,糖络宁能够促进GRP 78的表达,这与Gu J等人[24]的发现是相同的,同时也证明DPN发生时ER stress参与其病变过程。我们发现糖络宁能抑制IRE1α和XBP-1的表达,从而抑制CHOP的表达,表明糖络宁能够抑制内质网应激诱导的IRE1α-XBP-1-CHOP通路。同时糖络宁通过增强Bcl-2的表达,降低Bax的表达,显示糖络宁能够调节IRE1α-XBP-1-CHOP通路引起细胞凋亡的两个重要蛋白因子而减轻内质网介导的细胞凋亡。此外糖络宁能够抑制GADD 34、Ero1α的表达,增强eIF 2α的磷酸化,再次表明糖络宁能够抑制ER stress诱导IRE1α-XBP-1-CHOP通路的细胞凋亡。
脂质代谢调节蛋白分布在ER上,高脂饲料喂养会使脂质代谢异常,导致蛋白合成异常,从而使得错误或未折叠蛋白在ER腔内堆积,诱发ER stress的发生[25]。前期实验结果[26]表明,糖络宁能够减轻血糖和血脂水平,从而减轻ER stress。ER stress的发生还会诱导IR的发生,本实验结果显示糖络宁能够降低HOMA-IR,也表明糖络宁有助于减轻ER stress。神经传导速度和痛阈值的改变能够反映DPN神经功能损伤的严重程度,本试验结果表明,糖络宁能够通过增加坐骨神经传导速度,降低鼠尾热痛阈值来改善DPN大鼠神经功能的障碍。PGP 9.5蛋白广泛存在于中枢和周围神经系统中,能够特异性的标记神经元和神经纤维,PGP 9.5蛋白表达下降表明神经纤维受到损伤,本试验结果表明,糖络宁能够增加PGP 9.5蛋白的表达,改善神经纤维损伤。脱髓鞘是DPN的典型病理改变[27],我们的实验结果表明糖络宁能够改善坐骨神经的脱髓鞘。ER stress是髓鞘损伤的一个重要的病理机制,因此,糖络宁能够改善DPN与影响ER stress凋亡途径中IRE1α-XBP-1-CHOP通路密切相关。
实验结果表明,糖络宁能够降低HOMA-IR,改善DPN大鼠的结构和功能,糖络宁防治DPN的作用机理与改善ER stress诱导的IRE1α-XBP-1-CHOP凋亡途径有关,主要为抑制ER stressIRE1α-XBP-1-CHOP凋亡途径相关蛋白CHOP、GADD 34、Ero1α和Bax的表达,增强GRP 78、P-eIF 2α和Bcl-2的表达。
参考文献
[1] VINCENT A M CBC, SMITH A L, FELDMAN E L. Diabetic neuropathy: cellular mechanisms astherapeutic targets[J]. Nature Reviews Neurology, 2011, 7(11):573-583.
[2] GUARIGUATA L, WHITING D R, HAMBLETON I, et al. Global estimates of diabetes prevalence for 2013 and projections for 2035[J]. Diabetes Research and Clinical Practice, 2014, 103(2):137-149.
[3] FORBES J M, COOPER M E. Mechanisms of diabetic complications[J]. Physiological Reviews, 2013, 93(1):137-188.
[4] BACK S H, KAOFMAN R J. Endoplasmic reticulum stress and type 2 diabetes[J]. Annual Review of Biochemistry, 2012, 81:767-793.
[5] 陳 聪,喻 嵘,吴勇军,等.葡萄糖调节蛋白78在糖尿病常见慢性并发症中的作用研究[J]. 湖南中医药大学学报,2014,34(1):53-56.
[6] 高彦彬,周 晖,张涛静,等.糖络宁治疗糖尿病周围神经病变临床研究[J].中华中医药杂志,2013,28(6):1673-1677.
[7] 姚伟洁,杨鑫伟,李情琴,等.糖络宁对STZ诱导DPN大鼠氧化应激的影响[J].中国中医急症,2015,24(12):2087-2089.
[8] SERGEY P W, ROMAN S, HANNA S, et al. Endoplasmic reticulum stress plays a key role in the pathogenesis of diabetic peripheral neuropathy[J]. Diabetes, 2013, 623(3):944-952.
[9] YANG X, YAO W, LI Q, et al. Mechanism of Tang Luo Ning effect on attenuating of oxidative stress in sciatic nerve of STZ-induced diabetic rats [J]. Journal of Ethnopharmacology, 2015, 174 (11):1-10.
[10] DING Y, DAI X, ZHANG Z, et al. Proanthocyanidins protect against early diabetic peripheral neuropathy by modulating endoplasmic reticulum stress[J]. The Journal of Nutritional Biochemistry, 2014, 25(7):765-772.
[11] 杨鑫伟,姚伟洁,史浩田,等.糖痹康对DPN大鼠山梨醇通路的影响[J].北京中医药,2016,35(1):45-48
[12] ZHOU L, DING S, LI Y, et al. Endoplasmic Reticulum Stress May Play a Pivotal Role in Lipid Metabolic Disorders in a Novel Mouse Model of Subclinical Hypothyroidism[J]. Scientific Reports, 2016, 6:31381.
[13] BAO L, CAI X, DAI X, et al. Grape seed proanthocyanidin extracts ameliorate podocyte injury by activating peroxisome proliferator-activated receptor-gamma coactivator 1alpha in low-dose streptozotocin-and high-carbohydrate/high-fat diet-induced diabetic rats[J]. Food & Function, 2014, 5(8):1872-1880.
[14] YANG X, YAO W, LI Q, et al. Mechanism of Tang Luo Ning effect on attenuating of oxidative stress in sciatic nerve of STZ-induced diabetic rats[J]. Journal of Ethnopharmacology, 2015, 174(11):1-10.
[15] YANG X W, LIU F Q, GUO J J, et al. Antioxidation and anti-inflammatory activity of Tang Bi Kang in rats with diabetic peripheral neuropathy[J]. BMC Complementary and Alternative Medicine, 2015, 15:66.
[16] CHEN W J, CAI B, CHEN H T, et al: The Role of ADIPOQ Methylation in Experimental Non-alcoholic Fatty Liver Disease[J]. Journal of Digestive Diseases, 2016,17(12):829-836.
[17] LIU C, KE X, WANG Y, et al. The level of netrin-1 is decreased in newly diagnosed type 2 diabetes mellitus patients[J]. BMC Endocrine Disorders, 2016, 16(1):319-326.
[18] LIN W, POPKO B. Endoplasmic reticulum stress in disorders of myelinating cells[J]. Nature Neuroscience, 2009,12(4):379-385.
[19] NING B, DENG M, ZHANG Q, et al. beta-Asarone Inhibits IRE1/XBP1 Endoplasmic Reticulum Stress Pathway in 6-OHDA-Induced Parkinsonian Rats[J]. Neurochemical Research, 2016,
41(8):2097-2101.
[20] LIU Q S, PANG Z R, LIU R, et al. Effective compounds group of Mongolian prescriptions BAIMAI-SAN protect against peripheral neuropathy in lower limbs of rats through neuro protective effect[J]. Journal of Ethnopharmacology, 2011,135(3):786-791.
[21] CHOI S K, LIM M, YEON S I, et al. Inhibition of endoplasmic reticulum stress improves coronary artery function in type 2 diabetic mice[J]. Experimental Physiology, 2016,101(6):768-777.
[22] BO YU LW, BING XIAO, FANG HAN, et al. Single Proonged Stress induces ATF6 alpha-dependent Endoplasmic reticulum stress and the apoptotic process in medial Frontal Cortex neurons[J]. BMC Neuroscience, 2014,15(67):119-128.
[23] XIONG Z, JIANG R, LI X, et al. Different Roles of GRP78 on Cell Proliferation and Apoptosis in Cartilage Development[J]. International Journal of Molecular Sciences, 2015,16(9):21153-21176.
[24] GU J, ChEN J, YANG N, et al. Combination of Ligusticum chuanxiong and Radix Paeoniae ameliorats focal cerebral ischemic in MCAO rats via endoplasmic reticulum stress-dependent apoptotic signaling pathway[J]. Journal of Ethnopharmacology, 2016,187(4):313-24.
[25] MARCINIAK J S, RON D. Endoplasmic Reticulum tress Signaling in Disease[J]. Physiological Reviews, 2006, 86(4):340-350.
[26] 史浩田,姚偉洁,杨鑫伟,等.糖络宁对糖尿病周围神经病变大鼠PERK-CHOP-Caspase-12通路的影响.环球中医药2017,10(3):269-274.
[27] LIU Q S, PANG Z R, LIU R, et al. Effective compounds group of Mongolian prescriptions BAIMAI-SAN protect against peripheral neuropathy in lower limbs of rats through neuro protective effect[J]. Journal of Ethnopharmacology, 2011, 135(3):786-791.
