丝瓜离体再生体系的建立
2019-09-10黄丽芳刘建汀王彬
黄丽芳 刘建汀 王彬

摘 要:以丝瓜种子、子叶为试验材料,研究不同消毒处理、不同苗龄期、不同植物生长调节剂种类及浓度对丝瓜子叶再生体系的影响。结果表明:酒精消毒40 s、0.1%升汞消毒10 min组合为最佳的种子消毒组合,种子污染率5.56%,种子出芽率94.44%;选择7 d左右微展、颜色绿色的子叶为最佳外植体,最适宜的诱芽培养基为MS+2.0 mg·L-16BA+30 mg·L-1蔗糖+6 g·L-1琼脂粉,诱导率可达64%以上,最适宜的不定芽增殖培养基为MS+2.0 mg·L-16BA+4 mg·L-1 AgNO3,增殖系数3.27,增殖的植株健壮,长势良好。在丝瓜外植体生根诱导过程中,生根培养基采用1/2MS,生根率可达100%,生根培养3~4周直至主根长到5 cm以上,瓜苗长势好;后期移植,栽培基质以泥炭土∶珍珠岩=5∶1为宜,栽培成功率可达95%以上。
关键词:丝瓜;子叶;组织培养;再生体系
Abstract:By using the seed and cotyledon of loofah as experimental materials, the effects of different disinfection treatments, different seedling ages, different types and concentrations of plant growth regulator on the regeneration system of loofah cotyledon were studied. The results showed that the combination of disinfection with alcohol for 40 s and disinfection with 0.1% mercuric chloride for 10 min was the best combination for seed disinfection, with the seed contamination rate of 5.56% and seed bud ratio of 94.44%. The green cotyledons slightly spread at about 7 days were selected as the best explants, and the most appropriate bud inducing medium was MS+2.0 mg·L-1 6BA+30 mg·L-1 sucrose and 6 g·L-1 agar powder, with an induction rate of over 64%. The optimal culture medium for adventitious bud proliferation was MS+2.0 mg·L-1 6BA+4 mg·L-1 AgNO3, and the proliferation coefficient was 3.27. The proliferating plants were healthy and growing well. During the root induction of loofah explants, 1/2 MS was used as the rooting medium, and the rooting rate was up to 100%. The root was cultured for 3- 4 weeks until the main root grew to more than 5 cm, and the melon seedlings grew well. In the later transplanting, the suitable culture medium was the ratio between peat soil and perlite of 5∶1, and the success rate of cultivation could reach above 95%.
Key words:Loofah; Cotyledon; Tissue culture; Regeneration system
絲瓜Luffa cylindrica原产东印度,主要分布于热带、亚热带的亚洲各地,中国南、北各地栽培较为普遍,是我国主要的瓜类蔬菜。丝瓜风味独特、营养丰富,具有很好的医疗保健功能,有清凉、利尿、活血、通经、解毒之功效。随着人们对饮食营养保健的日益重视,丝瓜作为一种药食兼用的高温季节市场供应的蔬菜,深受人们的喜爱,其需求量不断地增加,栽培面积正呈现日益扩大,并且蕴含着巨大的市场前景。
植物组织培养技术目前已经成功应用于甜瓜[1-2 ]、南瓜[3-5]、黄瓜[6 -7]等瓜类作物,一般都是利用子叶[8-9]与幼胚[10-11]作为外植体。国内对于丝瓜组培上的报道还比较少,本研究以丝瓜子叶为试验外植体,研究了不同消毒方法、不同苗龄、不同植物生长调节剂种类及浓度对丝瓜子叶再生体系的影响,筛选出适宜的植物生长调节剂浓度组合,旨在为今后丝瓜育种深入研究提供理论依据。
1 材料与方法
1.1 试验材料
试材由福建农业科学院蔬菜研究中心蔬菜育种科技创新团队提供。
1.2 试验方法
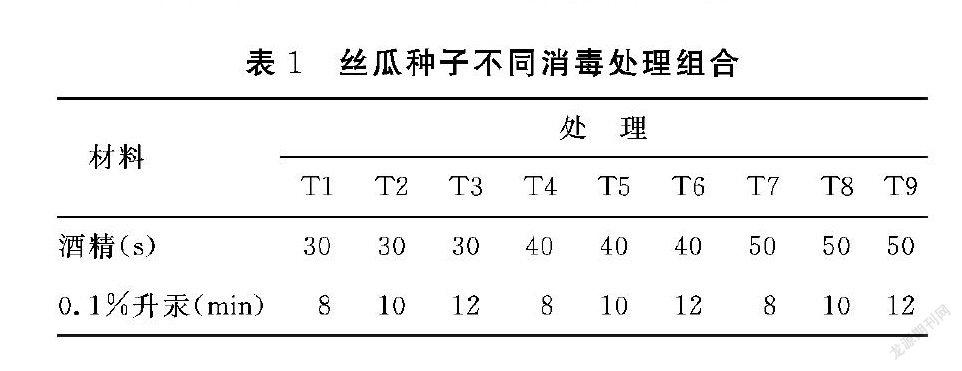
1.2.1 不同消毒处理对丝瓜种子发芽的影响 选籽粒饱满、无病虫害、大小一致的种子,用水连续冲洗0.5 h。然后转入超净工作台上处理,将洗净的种子按照表1的组合方式进行消毒灭菌,每次使用1种灭菌剂处理后均用无菌水冲洗3~4次,再接入到MS培养基上进行播种,光周期16 h·d-1。每个处理的种子数为30粒,每天观察污染以及发芽情况并统计。计算公式如下:
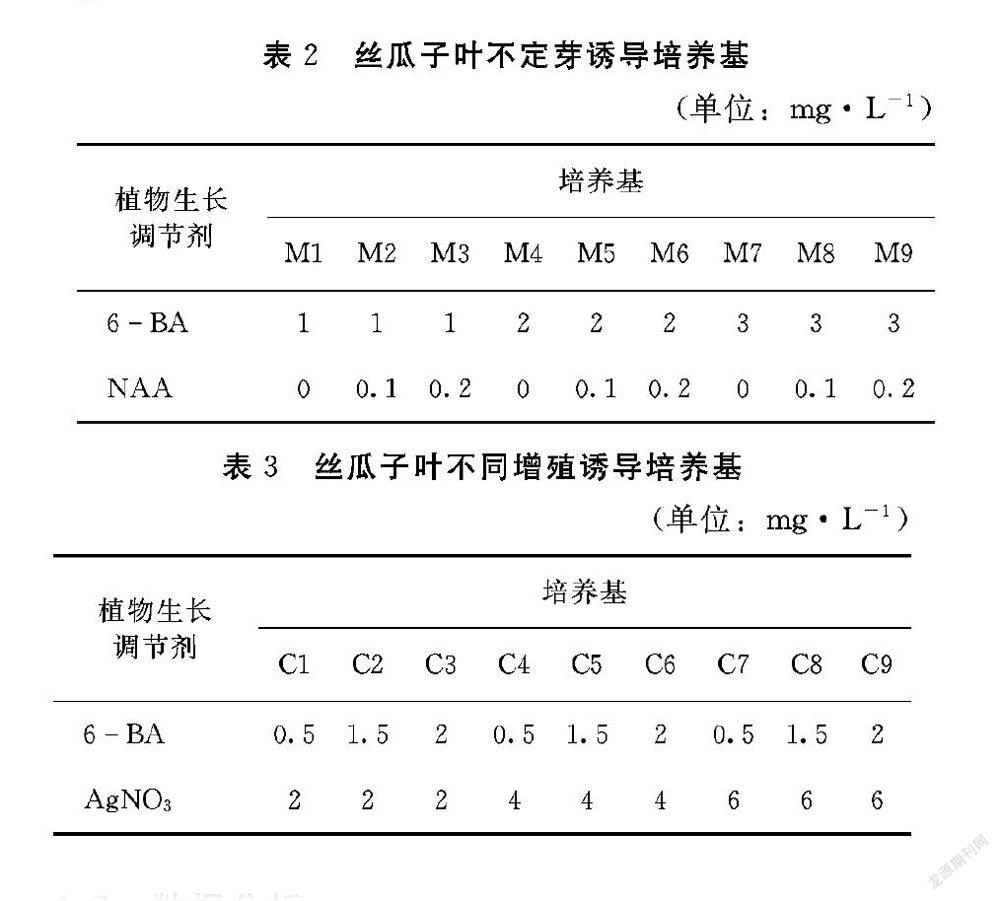
1.2.2 不同植物生长素浓度配比对丝瓜不定芽诱导的影响 催芽播种后长出的无菌苗取3种苗龄期的子叶:子叶闭合期、子叶变绿微展期以及子叶完全展开期。分别取不同时期子叶,切除叶子边缘,横切一分为二,去除远胚轴端,近胚轴端分别取靠近子叶节和胚根的部位,每段约0.5 cm,将制备好的子叶节及子叶按生物学体位平放到不定芽诱导培养基(表2),置于室温(25±2)℃、光周期为16 h·d-1 的光照培养箱内培养。芽诱导率计算公式为:
芽诱导率(%)=子叶萌发的不定芽/接种数×100
1.2.3 不同植物生长素浓度组合对丝瓜不定芽诱导的影响 将子叶节上的不定芽分离切取下来,去除芽基部的愈伤组织,切除不定根,接入含有不同植物生长调节剂种类和浓度的增殖培养基中(表3),每个处理接种量为30株,重复3次。通过后期观察记录,计算增殖系数。增殖系数的计算方法为:增殖系数=新芽数/接种数。
1.3 数据分析
试验数据利用IBM SPSS Stastistic 21软件的SNK多重比较进行双因素方差分析和差异显著性分析(P<0.05)。
2 结果与分析
2.1 不同消毒处理对丝瓜种子发芽的影响
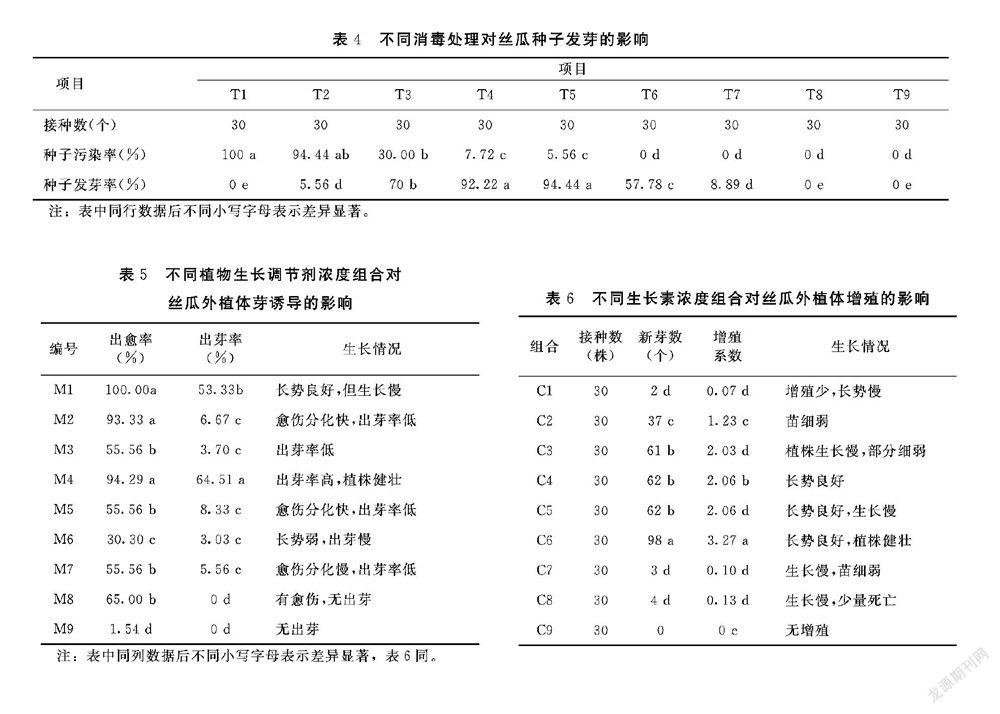
从表4可以看出,T1、T3、T4处理的种子污染率存在显著差异,T6、T7、T8、T9处理的种子污染率没有显著差异,且种子污染率为0。在种子发芽率方面,T3、T5、T6、T7处理存在显著差异,T1、T8、T9处理的种子发芽率为0。种子发芽率最高的是T4和T5处理,二者的发芽率都在90%以上,显著高于其他的几个消毒处理。种子污染率T1和T2处理最高,T1处理直接达到100%,由此表明,丝瓜种子的污染率和成活率与酒精和0.1%升汞的处理时间存在一定相关性。采用酒精消毒30 s的种子污染率最高,虽然随着0.1%升汞消毒时间的延长,种子污染率微微下降,但数值还是偏高,没有起到消毒的目的。酒精消毒时间40 s时,种子污染率显著下降,直至种子污染率为0,而种子发芽率随着升汞消毒时间的延长呈现先上升后下降的趋势。酒精消毒50 s,虽然种子污染率为0,但是种子发芽率也几乎为0。
综上所述,酒精和0.1%升汞的处理时间对芽的诱导成活率影响很大,酒精消毒时间过低,污染率太高,而消毒时间太长,又降低种子的活性,芽成活率太低。酒精消毒40 s、升汞消毒10 min组合为最佳的种子消毒组合。
2.2 不同植物生长素浓度组合对丝瓜不定芽诱导的影响
选取不同苗龄期的子叶接种于诱芽培养基上,发现选择微展期且已经转绿时期的子叶作为外植体,在接种后的第6 d就明显增大变厚,之后开始产生愈伤,1周后在卷起的叶边缘可见绿色或黄色的小突起,即是芽点,诱芽率最高。所以选取这个时期的时期,后续的试验都是选这个时期的子叶作为外植体。
诱芽培养基选择不同浓度的6BA和NAA配比来筛选出最佳诱芽培养基组合。将切除边缘的子叶平放在培养基上,3 d明显膨大,叶片增厚,部分边缘黄化,子叶变形、变脆,易于折断。从表5可以看出不同浓度配比的6BA+NAA组合对外植体的出愈率和出芽率存在显著性差异,M4组合的出愈率和出芽率分别为94.29%和64.51%,出愈率最高,出芽率最高,生长速度快,植株健壮;M9组合的出愈率和出芽率最低,分别为1.54%和0;M1组合的愈伤率达到100%,但出芽率没有M4组合好,且出芽速度太慢。综上所述,M4组合为最佳的芽诱导组合。
2.3 不同植物生长素浓度组合对不定芽增殖的影响
诱导出的不定芽长到4 cm以上就可以进行增殖试验,把芽从愈伤组织上分离,去除根部带出的愈伤组织,转入增殖培养基继续培养。从表6可以看出,C6组合的增殖系数与其他8个组合处理存在显著性差异,C6组合的增殖系数为3.27,增殖的植株长势良好,植株健壮。由此表明,不同的植物生长素浓度组合對增殖培养有影响。因此,2.0 mg·L-16BA+4 mg·L-1 AgNO3 为增殖系数最高,培养的小苗长势健壮。
3 讨论
本试验研究了不同消毒组合对外植体发芽的影响,结果表明75%酒精消毒40 s、0.1%升汞消毒10 min组合为最佳的丝瓜种子消毒处理,污染率5.56%,出芽率94.44%,既保证了外植体的活性,又保证了出芽率。消毒方法在前人的方法上稍微改进[12-14],通过研究得出:外植体的活性受酒精消毒的影响较大,相同酒精消毒时间下,外植体活性随着升汞消毒的时间延长变化不大;但相同的升汞消毒时间下,随着酒精消毒时间的延长,活性断崖下降。75%酒精通过渗透压来杀菌消毒,其渗透压可渗入细菌的细胞内部,同样也对外植体的植物细胞影响巨大,导致植物细胞脱水而死。由此可见,酒精消毒时间的选择更为关键。选择未转绿的子叶做外植体,虽然会膨大,但基本不转绿且不长愈伤,很难分化出苗。原因可能是还未分化出叶绿素,自身修复能力较差,试验处理对其自身的新陈代谢会产生影响。而微展期、刚转绿的苗细胞新陈代谢快,更容易分化出苗[15-17]。
MS培养基被广泛应用于瓜类植物的再生体系中,不同的瓜类品种遗传转化再生体系中生长素浓度的不同决定其愈伤诱导、不定芽诱导、增殖诱导以及生根等各诱导培养基的不同配比组合。张娜[18]研究西瓜子叶高效再生体系,发现MS+1.0 mg·L-1 6BA+0.1 mg·L-1 NAA作为不定芽的诱导培养基诱导率可达88.33%。张若玮等[19]研究不同基因型黄瓜再生体系,发现不同基因型再生频率差异较大,植物生长调节剂的选择基本上都在6BA、NAA、AgNO3及ABA,在MS培养基基础上增加1.5 mg·L-16BA+2 mg·L-1ABA+2 mg·L-1AgNO3诱导率高达97%,增殖系数平均为5.2,6BA为不定芽诱导及促进伸长所需的必备植物生长调节剂。在本试验中,丝瓜的不定芽诱导最佳培养基为MS+2.0 mg·L-1 6BA+30 mg·L-1蔗糖+6 g·L-1琼脂粉,出愈率可达94.29%,诱导率可达80%以上。
适宜的生长调节剂种类及浓度是增殖试验的关键。6BA不仅有利于芽的伸长,也有利于增殖。在增殖试验中,低浓度的6BA有利于增殖,而高浓度对芽增殖有抑制作用,并且在离体培养过程中,外植体会释放出不利于增殖的乙烯,使外植体褐化、玻璃化,这时候添加的低浓度AgNO3可缓解这一现象[20-21]。试验结果表明,最有利于不定芽增殖的培养基为MS+2.0 mg·L-16BA+4 mg·L-1AgNO3,增殖系数3.27,增殖的植株健壮,长势良好。在生根诱导过程中,最佳生根培养基为1/2MS,生根率可达100%,生根培养3~4周直至主根长到5 cm以上,瓜苗长势好;后期移植,栽培基质以泥炭土∶珍珠岩=5∶1为宜,栽培成功率可达95%以上。针对不同基因型的丝瓜,所选取的外植体类型、生长调节剂、接种方式可能会稍有不同,因此寻找合适的植物生长调节剂配比、探索建立高效的遗传转化再生体系,是今后工作的重点。
参考文献:
[1]夏海武,吕柳新,夏天,等.弥河银瓜高效植株再生体系的建立[J].植物生理学报,2016,42(2):235-238.
[2]ROBY D,GADELLE A,TOPPAN A.Chitin oligosaccharides as elicitors of chitinase activity in melon plants[J].Biochemical & Biophysical Research Communications,1987,143(3):885-892.
[3]余义和,李桂荣,王新娟,等.南瓜离体培养及植株再生的研究[J].安徽农业科学,2006,34(20):5180-5181.
[4]李伟,程永安,张恩慧,等.双单倍体南瓜后代子叶离体再生植株研究[J].西北农林科技大学学报(自然科学版),2012,40(3):141-146.
[5]张玉园.南瓜子叶节离体再生体系的构建与耐盐StNHX1基因的转化[D].新乡:河南科技学院,2015.
[6]黄东梅,别蓓蓓,潘俊松,等.黄瓜(Cucumis sativus L.)离体再生和转化体系的优化[J].上海交通大学学报(农业科学版),2012,30(2):41-47.
[7]安亚伟.黄瓜离体再生与遗传转化体系的研究[D].扬州:扬州大学, 2013.
[8]钟辉丽,李玉红,陈雪琳,等.黄瓜离体器官再生体系的优化[J].中国农学通报,2015,31(10):80-86.
[9]崔波,梁芳,程喜梅,等.黄瓜子叶节离体再生体系的建立[J].河南科学,2008,26(3):288-290.
[10]SIVRITEPE N,SIVRITEPE H O,ERIS A.The effects of NaCl priming on salt tolerance in melon seedlings grown under saline conditions[J].Scientia Horticulturae (Amsterdam),2003,97(3-4):230-237.
[11]胡芳芳,刘霞,程永安.西葫芦大孢子离体培养再生植株技术优化研究[J].中国农学通报,2016, 32(31):29-33.
[12]谢晓婷,郭明星,许竹叶,等.‘小白杏’诱导愈伤组织及不定芽体系的优化[J].山东农业科学, 2017(12):6-10.
[13]刘斌,杨远柱,刘选明,等.不同激素组合对丝瓜离体快速繁殖的调控[J].生命科学研究, 2002(S2):38-40.
[14]LEE J H,PIJUT P M.Adventitious shoot regeneration from in vitro leaf explants of Fraxinus nigra[J].Plant Cell Tissue & Organ Culture,2017(2):1-9.
[15]MEHAK GUPTA C A,BANGA S S.Cytogenetic stability and genome size variations in newly developed derived Brassica juncea allopolyploid lines[J].Journal of Oilseed Brassica, 2016,5(2):118-127.
[16]ZHANG J R.An efficient adventitious shoot regeneration system for Zhanhua winter jujube (Zizyphus jujuba Mill.) using leaf explants[J].Plant Cell Reports,2005,23(12):775-779.
[17]MA C,YE X,CHEN Y,et al.Anatomical observations of adventitious bud regeneration from leaf explants of Ziziphus jujube Mill.‘Huizao’[J].Horticulture,Environment,and Biotechnology, 2012, 53(4):316-319.
[18]張娜.西瓜子叶再生机制及高效再生体系应用研究[D].武汉:华中农业大学,2015.
[19]张若纬,顾兴芳,王烨,等.不同黄瓜基因型子叶再生体系的建立[J].华北农学报, 2010, 25(S1):50-54.
[20]王艳蓉, 陈丽梅, 潘俊松,等.黄瓜子叶高效再生体系的建立与遗传转化[J].上海交通大学学报(农业科学版),2006,24(2):152-156,164.
[21]张玉园,鲁晓晓,周俊国,等.南瓜子叶节离体再生体系构建[J].江苏农业科学,2015, 43(12):26-29.
(责任编辑:柯文辉)
