补肾通络方对肺纤维化大鼠结缔组织生长因子表达的影响
2019-09-10苏凤哲刘晓于文涛
苏凤哲 刘晓 于文涛

摘要 目的:观察补肾通络方对肺纤维化大鼠肺组织结缔组织生长因子(CTGF)表达的影响。方法:采用博来霉素诱导建立实验性肺纤维化大鼠模型,以氢化可的松琥珀酸钠为对照,观察补肾通络方对肺纤维化大鼠肺组织病理形态、血清羟脯氨酸(HYP)、透明质酸(HA)、层粘连蛋白(LN)及肺组织CTGF和CTGFmRNA表达的影响。结果:同正常组比较,模型组大鼠肺组织病理纤维化显著,炎性反应明显,同时伴有血清HYP,HA,LN升高(P<0.05或P<0.01),肺组织CTGF和CTGFmRNA表达升高(P<0.05或P<0.01)。同模型组比较,补肾通络高剂量组大鼠血清HYP,HA,LN含量明显下降(P<0.05);补肾通络低剂量组LN含量明显下降(P<0.01),氢化可的松琥铂酸钠对照组HYP、HA、LN含量明显下降(P<0.05或P<0.01),补肾通络方高剂量组和氢化可的松琥珀酸钠对照组大鼠肺组织CTGF和CTGFmRNA表达明显下降(P<0.05或P<0.01),肺组织病理形态的改善。结论:补肾通络方可能通过从蛋白和基因水平调节实验性肺纤维化大鼠肺组织CTGF表达,抑制肺纤维化。
关键词 补肾通络方;肺纤维化;羟脯胺酸;透明质酸;层粘连蛋白;结缔组织生长因子;基因调节;实验研究
Effect of Bushen Tongluo Prescription on the Expression of Connective Tissue Growth Factor in Pulmonary Fibrosis Rats
Su Fengzhe1,Liu Xiao2,Yu Wentao2
(1 Beijing Tongzhou District of Beijing Combine Traditional Chinese and Western Medicine Hospital,Beijing 101100,China; 2 Hebei University of Chinese Medicine,Shijiazhuang 050200,China)
Abstract Objective:To observe the effect of Bushen Tongluo prescription on the expression of Connective tissue growth factor(CTGF)in pulmonary tissue in rats with pulmonary fibrosis.Methods:An experimental model of pulmonary fibrosis was made by bleomycin induction,and compared with hydrocortisone sodium pine succinate,the effects of Bushen Tongluo prescription on pulmonary Histopathology,serum hydroxyproline(HYP),hyaluronic acid(HA)and laminin(LN)and the expression of CTGF and CTGFmRNA in lung tissue were observed in pulmonary fibrosis rats.Results:Compared with the normal group,the model group showed significant pathological fibrosis,accompanied by elevating HYP,HA and LN of serum(P<0.05 or P<0.01)and inflammatory response,and accompanied by elevating the expression of CTGF and CTGFmRNA in the lung(P<0.05 or P<0.01).Compared with the model group,the expression of CTGF and CTGFmRNA decreased significantly in the high dose group and the hydrogenated sodium matesartesperate control group(P<0.05 or P<0.01),and pathological morphology of lung tissue were improved.Conclusion:It is possible to inhibit pulmonary fibrosis by regulating the expression of CTGF and CTGFmRNA in experimental pulmonary fibrosis rats.from protein and Gene levels.
Key Words Bushen Tongluo Prescription;Pulmonary fibrosis;Hydroxyprolic acid;Hyaluronic acid;Laminin;CTGF;Gene regulation;Experimental research
中圖分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2019.09.013
肺间质纤维化以大量的成纤维细胞聚集、细胞外基质沉积并伴有炎性损伤为特征的病变,是多种肺损伤性疾病发展到晚期的常见病理结局,其进展快,预后差,中位生存期仅2.8年[1]。由于环境污染、人口老龄化等因素,近年来本病的发病率明显上升。补肾通络方为全国首批中医优秀临床人才苏凤哲教授治疗肺纤维化的临床经验方,经过多年临床应用,疗效显著,并已获得国家发明专利(专利号:201510683592.6)。本研究从分子水平揭示该方药调节肺组织结缔组织生长因子(CTGF)表达,抑制肺纤维的机制。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级SD大鼠48只,雄性,体质重180~200 g、由河北医科大学实验动物中心提供,动物合格证编号:1705308。普通实验室饲养环境,恒温、恒湿,自由饮食。
1.1.2 药物 补肾通络方:西洋参10 g、虫草花12 g、蛤蚧5 g、浙贝母12 g、白僵蚕12 g、全蝎8 g、桃仁10 g、穿山甲8 g,具有补肾化痰、活血通络的作用,饮片购自河北乐仁堂药,使用前加蒸馏水煎至所需浓度,分别装瓶,冰箱储存备用。氢化可的松琥珀酸钠(常州四药制药有限公司,生产批号:201609502)。注射用盐酸博来霉素(海正辉瑞制药有限公司,生产批号:16023511)。
1.1.3 试剂与仪器 试剂:Masson kit(珠海贝索生物技术有限公司,批号:BA-4079A);HYP kit(南京建成生物工程研究所,批号:A030-2);HA kit(天津九鼎医学生物工程有限公司,批号:RHC1711);LN kit(天津九鼎医学生物工程有限公司,批号:RHC1711);CTGF antibody(GeneTex Inc,GTX124232);GAPDH antibody(Santa Cruz Biotechnology,Inc,批号:sc-25778);DEPC(Sigma,批号:D5758);E.Z.N.A.Total RNA kit II(OMEGA bio-tek,批号:R6934),cDNA Synthesis kit(TaKaRa,批号:6210A);SYBR Green荧光定量PCR kit(TIANGEN,批号:FP205);其他国产试剂均为分析纯试剂。仪器:恒温振荡器(常州国华电器有限公司,型号:SHA-B)、高性能无菌实验台(哈尔滨东联,型号:DL-CJ-1N)、紫外透射仪(北京鼎国,型号:UV-254)、高速冷冻离心机(美国Sigma,型号:1-15K)、超低温保存箱(日本三洋,型号:MDF-382E)、紫外可见分光光度计(上海精密科学仪器有限公司,型号:756MC)、凝胶成像系统(美国UVP公司,型号:UVP)、分析软件Quantity one(Bio-Rad Technical Service Department)、复日生物电泳图像分析系统(上海复日科技有限公司,型号:FR-980)、水平电泳仪(北京市六一仪器厂,型号:DYY)、实时荧光定量PCR仪(美国ABI公司,型号:7500 fast)。
1.2 方法
1.2.1 分组与模型制备 适应性喂养一周后,将48只大鼠随机分为正常组8只和模型组、补肾通络高剂量组、补肾通络低剂量组、氢化可的松琥铂酸钠对照组各10只。除正常组外,其余各组大鼠参加造模,造模方法参考文献[2],采用博莱霉素诱导制作肺纤维化大鼠模型。大鼠术前禁食24 h,乙醚麻醉后,小鼠仰卧于固定台上,固定头和四肢,乙醇消毒后,剥离颈部软组织,暴露气管,用1 mL蓝芯针管向气管内缓慢推注0.4%博莱霉素5 mg/kg(0.25 mL/kg),正常组注入生理盐水0.25 mL,注药后立即旋转动物,使药液在肺内均匀分布,逐层缝合。
1.2.2 给药方法 在造模术后第3天,补肾通络高剂量组灌服1.42 g/mL的补肾通络方药液10 mL/kg(相当于14.2 mL/kg体质重),补肾通络低剂量组灌服浓度为0.71 g/mL补肾通络方药液10 mL/kg(相当于7.1 mL/kg体质重),氢化可的松琥铂酸钠对照组腹腔注射浓度为0.458 g/mL的氢化可的松琥珀酸钠10 mL/kg(相当于4.58 mg/kg体质重),正常组、模型组灌胃等体积的生理盐水,共治疗28 d。治疗结束后,剔除死亡大鼠,每组8只纳入统计。
1.2.3 检测指标及方法
1.2.3.1 纤维化指标检测 实验大鼠最后一次灌胃后禁食24 h,将其分别断头取血3 mL,3 500 r/min 4 ℃下離心15 min,分离血清并置于-20 ℃冰箱内保存待测。采用RIA法检测各组大鼠肺组织羟脯氨酸(HYP)、透明质酸(HA)、层粘连蛋白(LN)含量。
1.2.3.2 Western blot检测 采用Western blot检测CTGF表达,每组取5份样本纳入统计。取大约500 mg肺组织加1 mL提取液匀浆提取,4 ℃,12 000 r/min离心5 min,取上清,加入等体积2χSDS上样缓冲液,100 ℃中煮沸5 min。进行聚丙烯酰胺凝胶电泳,每孔上样等量总蛋白。利用水浴式电印迹法将蛋白转移至膜上。室温振荡封闭膜2 h后,加入1∶250(封闭液稀释)的第一抗体,室温缓慢摇动2 h,用PBS-Tween洗膜3次后,再加入1∶5 000(封闭液稀释)的HRP标记的第二抗体,室温振摇1 h,PBS-Tween充分洗膜后,将膜浸入DAB显色液中,室温充分显色后,立即用蒸馏水洗膜,然后将膜转入PBS中观察、照相、分析。
1.2.3.3 RT-qPCR检测 采用RT-qPCR检测CTGFmRNA表达。取肺组织30 mg、研磨并加入1 mL RNA-Solv Reagent混合均匀,加入200 μL氯仿,离心15 min,提取上层RNA溶解物,加入等体积的异丙醇,充分混匀,4 ℃离心10 min。小心弃上清,加入预冷的75%的乙醇。4 ℃反复离心2次,用20 μL RNase DH20溶解沉淀,保存在-80 ℃冰箱中。采用紫外分光光度计测定样本RNA的浓度及RNA量,在1.5 mL tube中用EASY Dilution稀释cDNA标准品,按照组份配制反应液,37 ℃反转录15 min,85 ℃ 5 sec灭活反转录酶。将SYBR Premix EX TaqTM 12.5 μL、上下游引物10 μmol/L各0.5 μL、无菌水9.5 μL、cDNA 1 μL混合均匀,配置成Real-time PCR反应试剂。按照反应条件进行Real-Time PCR反转录反应。引物序列如下:GAPDH:F:5-CAGGAAATGATGACCTCCTGAAC-3、R:5-TGTTTTTGTAAGTATCTTGGTGCC-3;CTGF:F:TAGCTGCCTACCGACTGGAA、R:CTTAGAACAGGCGCTCCACT。
1.2.3.4 肺组织病理形态观察 实验大鼠断头处死后,结扎并分离右肺中叶,一部分肺组织置于4%多聚甲醛固定,乙醇逐级脱水,浸腊包埋,制备腊块,切片机切片,进行Masson染色,光镜下观察肺组织病理形态学改变。
1.3 统计学方法 采用SPSS for Windows 16.0统计软件进行数据处理,计量资料用均数±标准差(±s)表示,统计方法采用单因素方差分析,组间两两比较采用LSD检验,以P<0.05为差异有统计学意义。
2 结果
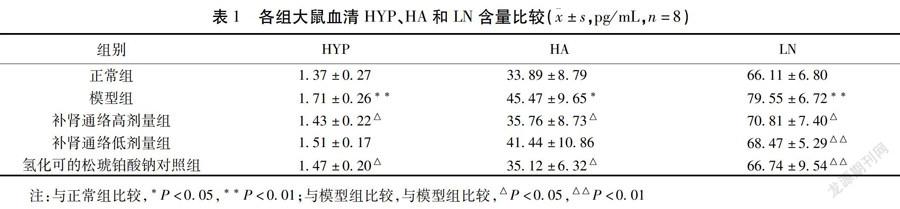
2.1 各组大鼠血清HYP、HA和LN含量比较 与正常组比较,模型组HYP、HA和LN含量明显升高(P<0.05或P<0.01),与模型组比较,补肾通络高剂量组、氢化可的松琥铂酸钠对照组HYP、HA和LN含量显著降低(P<0.05或P<0.01),补肾通络低剂量组LN含量显著降(P<0.01)。见表1。
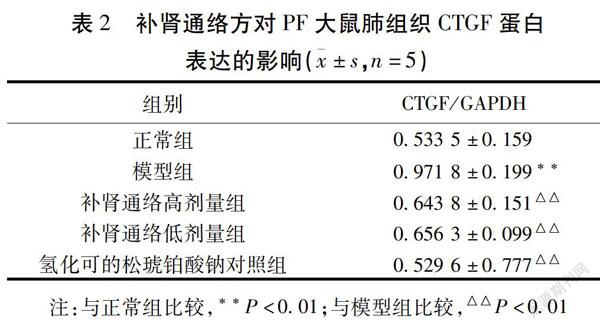
2.2 各组大鼠肺组织CTGF表达比较 与正常组比较,模型组大鼠CTGF表达升高(P<0.01);与模型组比较,补肾通络高剂量组、低剂量组和氢化可的松琥铂酸钠对照组CTGF表达均降低(P<0.01)。见图1,表2。
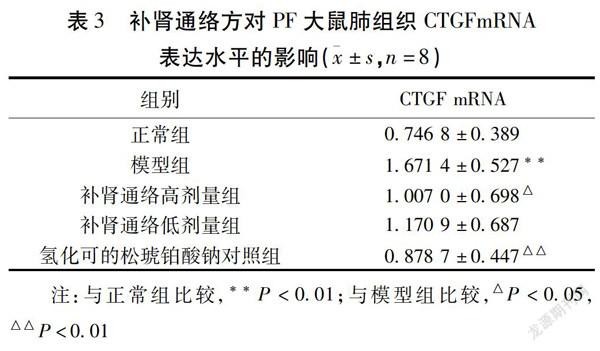
2.3 各组大鼠肺组织CTGFmRNA表达比较 与正常组比较,模型组大鼠CTGFmRNA表达升高(P<0.01);与模型组比较,补肾通络高剂量组大鼠CTGFmRNA表达降低(P<0.05),氢化可的松琥铂酸钠对照组CTGFmRNA表达降低(P<0.01)。见表3。
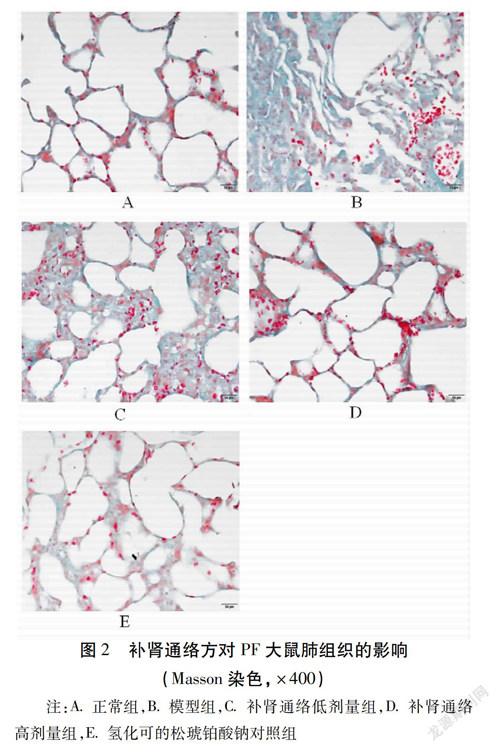
2.4 病理组织观察 肺组织切片经Masson染色后,胶原纤维呈现亮绿色,肌肉、胞质呈现红色,胞核呈现蓝黑色。正常组大鼠肺组织结构清晰,没有纤维化表现。模型组肺泡肺泡结构紊乱,肺泡腔及间质内有炎性反应细胞的渗出,肺间质可见大量的胶原纤维增生、沉积,出现条索状、片状、灶状的纤维化区域。中药高、低剂量组肺纤维化程度与模型组比较均明显减轻,肺间隔略增宽,间质内可见小灶状胶原纤维沉积,病变范围较小。氢化可的松琥铂酸钠对照组肺组织结构较清晰,肺泡隔增厚,肺泡腔及间质内可见胶原纤维增生及炎性细胞浸润。见图2。
3 讨论
肺纤维化是现代医学的概念,中医学无此名的记载,多数学者将肺纤维化归属于“肺痿”“肺痹”“咳喘”等病证范畴。《素问·痹论》认为肺痹乃“皮痹不已,复感于邪,内舍于肺”,则为肺痹,“肺痹者,烦满喘而呕”。在《素问·痿论》中,指出了肺痿乃“肺热叶焦,则皮毛虚弱急薄,著则生痿躄也”。肺纤维化患者多为年老体弱,肺肾气虚,津液不布,津停为痰,痰瘀阻络而成本证。肾为气之根,纳摄无力,气喘难平;痰瘀为病之源,痰瘀阻络,肺络不通,纤维化难去。故本证“以本虚标实为主要病机,正虚主要是肺脾肾三脏的虚损,标实主要是痰瘀互结[3]。故治疗应补益肺肾治本,化痰通络治标,以补肾通络为大法。在早期的治疗中,不少医家支持此法,如赵晶晶等认为[4],肺气虚弱以及络气不足易致痰瘀交互,阻滞肺络是肺纤维化的基本病机之一。景菲等认为[5]久病肺虚为肺纤维化的主要原因,痰瘀互阻為病机关键,本虚标实为主要特点,提出补益气血,化瘀通络为本病的主要治法。闫玉琴等[6]认为肺肾两虚,痰瘀阻络为其主要病机,虚实夹杂贯穿于疾病的始终。肖娜等[7]认为肺纤维化患者以肺肾气虚,痰瘀互结最为常见。樊茂蓉等[8]则认为宗气虚陷,肺络痹阻是肺纤维化的发病的关键。杨颖溪等[9]则支持肺肾亏虚,微型癥瘕理论,提出补肾益肺消癥方(补肾益肺消癥方组成:当归、熟地黄、陈皮、法半夏、浙贝母、水蛭、炙甘草)治疗该病的方法。李蓉等[10]认为补肾通络法(药物选用南沙参、五味子、蝉蜕、僵蚕、地龙、全蝎等)是治疗肺纤维化的有效方法之一。国医大师晁恩祥[11]则以养阴益气,降气平喘为基本治法,基础方为:太子参,麦冬,五味子,黄精,山茱萸,苏子,地龙,白果。总之众多医家推崇补虚通络的方法,补虚则以肺、肾为主。笔者通过多年临床体会,认为肺纤维化补虚应侧重于肾,活血应以通脉络为主[12],因此选定了补肾通络方。该方以西洋参补气养阴,清热生津;蛤蚧、虫草花补益肺肾,纳气平喘;浙贝母、僵蚕清热化痰散结;三七、桃仁活血化瘀,全蝎、穿山甲、地龙通经活络。全方补肺益肾、化痰通络并行,使补肺肾而不致燥,化痰瘀而不伤正。本研究显示,肺纤维化模型大鼠肺泡结构紊乱,肺泡壁破坏,肺泡腔及间质内有炎性反应细胞渗出,肺泡隔明显增厚,可见大量胶原纤维增生、沉积,说明肺内细胞外基质的合成明显增加,且存在炎性反应。经补肾通络方治疗后,大鼠肺部的炎性反应明显减轻,肺泡结构较完整,间质胶原沉积减少,表明本方能够改善肺纤维化异常的组织病理形态表现。
羟脯氨酸(HYP)是机体胶原纤维所特有的氨基酸,约占正常胶原蛋白的13.4%,通常将HYP含量作为衡量胶原组织代谢的重要指标,由于它在肺组织中的含量与肺间质纤维化程度密切相关,故也常将HYP含量作为判断肺间质纤维化程度的重要指标[13]。层粘连蛋白(LN)是一种大分子非胶原糖蛋白,主要存在于基底膜透明层中,能够诱导细胞黏着、生长与分化等,能吸引、黏附肺上皮细胞、成纤维细胞及炎性细胞,并刺激T淋巴细胞和巨噬细胞分泌淋巴因子而促进成纤维细胞和上皮细胞合成胶原[14]。层粘连蛋白的增加可致炎性细胞积聚于基底部膜,损伤肺组织,直接导致肺纤维化[15]。透明质酸(HA)是一种主要的大分子黏生糖胺聚糖.可由Ⅱ型肺上皮细胞、内皮细胞及肺成纤维细胞分泌,在致病因子(如氧自由基)的刺激下,成纤维细胞可合成大量HA。HA在肺组织主要分布于毛细血管和细支气管周围的间质中,可表达于细胞外基质,也可表达于细胞表面[15]。在肺纤维化发展进程中,HA具有较高的敏感度,随着肺纤维化程度加重,患者血清中HA含量上升,且含量与肺纤维化程度呈正相关[16-17]。研究显示,HA很可能在肺纤维化早期——肺泡炎阶段的肺间质水肿中起重要作用[18]。在中医药的实验研究中显示,具有补肝肾,活血化瘀的药物均能降低羟脯胺酸及层粘连蛋白的含量。如宋占帅等[19]使用具有补气活血作用的补阳还五汤(生黄芪、当归尾、川芎、赤芍、桃仁、红花、地龙)治疗肺纤维化的结果显示,可降低透明质酸、层粘连蛋白水平,从而抑制胶原纤维的增殖以及细胞外基质的沉积。吴晓东等[20]使用具有抗氧化,保肝肾作用的大黄素和具有扩血管、活血化瘀作用的丹参素联合使用试验,证实该药具有降低羟脯胺酸、透明质酸、层粘连蛋白含量的作用。本实验使用具有补肾活血通络的药物组方,试验显示,比较正常大鼠,模型大鼠血清HYP、LN、HA的含量升高,说明肺纤维化加重,造模成功。经补肾通络方干预之后肺纤维化3项指标的含量下降,说明本方可以抑制炎性反应,减少胶原的沉积,有效改善肺纤维化。
肺纤维化是许多慢性肺疾病的共同病理结局,主要表现为成纤维细胞的病理性增生和细胞外基质病理性聚集。CTGF是一种富含半胱氨酸的多肽,广泛存在于人类肝脏、肾脏、心脏、肺和结缔组织等多种组织器官中,是许多促纤维化刺激的共同下游因子,参与细胞增生、分化及创伤修复等病理生理活动。在肺组织中,Ⅱ型肺泡上皮细胞和活化的成纤维细胞通过自分泌或旁分泌的方式产生CTGF,并介导成纤维细胞增殖,促进细胞外基质和胶原沉积,加强组织修复和促进肺纤维化[21]。研究表明,慢性阻塞性肺病患者血清CTGF、透明质酸、层粘连蛋白、Ⅲ型前胶原、Ⅳ型胶原水平均高于健康对照组,且与肺纤维化病程相关,提示CTGF含量与肺组织纤维化关系十分密切[22]。有研究显示[23],CTGF在博莱霉素诱导的肺纤维化动物模型中高度表达,肺纤维化前期纤维化的发生与TGF-β、ICAM-1、CTGF 3种细胞因子均有密切关系,三者可能起协同作用。
本实验中,与正常组比较,肺纤维化模型大鼠肺组织CTGF和CTGFmRNA表达显著升高,同时肺纤维化病理形态表现加重,说明CTGF表达升高在肺纤维化中发挥重要作用,补肾通络方治疗后,肺组织CTGF和CTGFmRNA表达均下降,显示该方药抑制肺纤维化作用可能与调节CTGF表达有关。
参考文献
[1]Tzilas V,Koti A,Papandrinopoulou D,et al.Prognostic factors in idiopathic pulmonary pibrosis[J].Am J Med Sci,2009,338(21):481-485.
[2]黄成亮,李艳艳,范贤明,等.IL-17A促进博来霉素诱导的肺纤维化大鼠肺组织的炎性反应形成[J].细胞与分子免疫学杂志,2014,30(4):366-370.
[3]苏凤哲.治疗老年肺纤维化关键在于补肾[J].中医临床研究杂志,2017,9(3):52-53.
[4]陈金亮,王殿华,张志慧.络病理论与肺纤维化关系探析[J].中医药学刊,2004,(3):407-408.
[5]景菲,张伟.从“久病入络”探讨COPD合并肺纤维化发病机制[J].福建中医药,2018,20(1):76-78.
[6]闫玉琴,贾琦,苏惠萍.中医对肺纤维化病因病机的探讨[J].西部中医药,2018,31(12):23-25.
[7]肖娜,曹爱玲,井梦昕,等.肺间质纤维化中医证候及临床特征分析[J].陕西中医,2017,28(3):289-291.
[8]樊茂蓉,米爽,韩克华,等.基于“痹-虚”病机中药对肺纤维化大鼠TGf-β/Smods信号通路的影响[J].山西中医,2017,31(11):52-56.
[9]杨颖溪,柴立民,吴甜甜.补肾益肺消癥方对特发性肺纤维化大鼠caspase-12信号通路关键分子基因和蛋白表达的影响[J].北京中医药大学学报,2016,39(7):575-579.
[10]李蓉,张勇,陈伊如.补肾通络法治疗38例肺纤维化的临床分析[J].现代临床医学,2014,40(4):285-287.
[11]王春娥,王辛秋.晁恩祥治疗肺间质纤维化经验总结[J].福建中医药,2018,49(4):58-59.
[12]苏凤哲,赵昕,周梦佳.补肾通络治疗老年肺纤维化临床研究[J].中医临床研究,2014,6(3):107-108.
[13]肖洁,张惠丽,徐米清,等.冬虫夏草菌粉对梗阻性肾病大鼠肾组织羟脯氨酸含量及p21表达的影响[J].中华生物医学工程杂志,2015,21(4):156-159.
[14]苏奕亮,翁东,周瑛,等.血清LN、1VC、PⅢNP、HA与特发性肺纤维化严重度和预后的相关性[J].中华急诊医学杂志,2018,27(2):188-193.
[15]杨京津,吴向群,倪春辉.层黏连蛋白与肺纤维化[J].中华劳动卫生职业病杂志,2014,32(9):710-713.
[16]宋占帅,张娟,张蓉,等.补阳还五汤联合汉防己甲素片改善矽肺肺纤维化效果观察[J].山东医药,2017,57(42):51-53.
[17]柳湘洁,姚弘毅,涂艳,等.呼吸康复训练联合百令胶囊对矽肺合并COPD患者炎性反应及肺纤维化的影响[J].海南医学院学报,2018,24(4):480-483.
[18]Mohammad K.Ashfaq,Mohamed Sadek Abdel-Bakky,Mir Tahir Maqbool,et al.A Preliminary Study on Combination Therapy of Artemisinin Dimer Oxime and Topotecan against Nonsmall Cell LungCancer in Mice[J].World J Tradit Chin Med,2018,4(1):8-14..
[19]宋占帥,张娟,张蓉,等.补阳还五汤联合汉防己甲素片改善矽肺肺纤维化效果观察[J].山东医药,2017,57(42):51-53.
[20]吴晓东,张峰,梁瑞峰.大黄素与丹参素合用对四氯化碳诱导大鼠肝纤维化的保护作用[J].天津中医药,2018,35(2)143-146.
[21]孙燕妮,宋娟,陈洁,等.ET-1、TGF-β1对大鼠肺成纤维细胞CTGF表达及细胞增殖的影响[J].山东医药,2014,54(42):29-31.
[22]孟凡静.慢性阻塞性肺疾病患者测定结缔组织生长因子与血清纤维化指标的价值[J].中华实用诊断与治疗杂志,2013,27(9):873-877.
[23]李瑞琴,孙洁,李伟,等.肺纤维化前期肺组织中ICAM-1、TGF-β、CTGF的表达及其镜下形态改变的动态观察[J].临床与实验病理学杂志,2016,32(7):786-791.
(2018-07-25收稿 责任编辑:王明)
