高效液相色谱-气相色谱联用法测定稻谷和大米中的饱和烃矿物油
2019-09-06刘玲玲李冰宁欧阳杰武彦文
刘玲玲,李冰宁,欧阳杰,武彦文,*
(1.北京市科学技术研究院,北京市理化分析测试中心,北京市食品安全分析测试工程技术研究中心,北京 100094;2.北京林业大学生物科学与技术学院,北京 100083)
矿物油是C10~C50的饱和烃(mineral oil saturated hydrocarbons,MOSH)和芳香烃(mineral oil aromatic hydrocarbons,MOAH)的总称[1],其中MOSH包括直链、支链和环状烷烃。MOSH有害人体健康。研究表明:人体的肝脏、脾脏和淋巴结等多个组织和器官均不同程度含有MOSH,特别容易蓄积C16~C35范围的MOSH,导致慢性炎症[2]。近年来,越来越多的研究数据显示:食品中广泛存在矿物油污染,主要污染来源包括环境污染[3-4]、原料采收和生产加工过程污染[5-6]以及包装材料迁移[7-9]等。
矿物油组成复杂,包含数以万计的化合物,其含量无法以其中一个或几个化合物表示,而是需要测定总量。氢火焰离子化检测器(hydrogen flame ionization detector,FID)是分析矿物油的理想检测器,其等碳响应特性规避了缺乏矿物油标准的问题。由于气相色谱(gas chromatography,GC)通常与FID联用。因此,GC-FID成为常用的矿物油分析方法[10]。然而,作为通用检测器,FID的灵敏度低、选择性差,需要通过前处理净化与富集目标物。离线固相萃取结合大体积进样GC系统[11-15]是较为常用的方法。随着仪器联用技术的发展,高效液相色谱-气相色谱(high performance liquid chromatography-gas chromatography,HPLC-GC)联用也逐渐开始普及[16-20],其中HPLC的作用是分离纯化,通过特殊的接口技术,HPLC-GC可以同时实现净化-转移-富集-分析的自动化,简化了实验操作步骤,提高了分析效率,并且避免了实验过程外来污染的引入[10]。
大米是世界各国的主要食粮,我国约有65%的人口日常主食是大米[21]。然而,近十几年来矿物油污染大米的事件时有发生[1,22]。研究表明:大米中MOSH含量约为1.7~160 mg/kg[12,16,23-26],主要来源于:1)环境污染;2)收割过程中的机械油污染;3)装袋过程中的软麻油污染;4)包装材料中的印刷油墨或回收纸板的迁移污染;5)运输和储藏过程中的防尘剂污染;6)人为抛光大米导致的矿物油污染等[1]。针对大米的矿物油污染问题,本实验拟通过HPLC-GC研究稻谷和大米中MOSH的含量情况,建立稻谷和大米中MOSH的定量方法,包括使用氧化铝去除稻谷提取液中烷烃干扰物,确定HPLC自动纯化MOSH的中心切割条件;应用HPLC-GC研究我国稻谷和市售大米的矿物油污染特征,分析大米中矿物油的可能污染来源。
1 材料与方法
1.1 材料与试剂
稻谷和大米样品各12 个(以人工和机器两种方式各采收6 个稻谷样品,将机器采收的稻谷样加工成大米样品6 个,随机采购市售商品大米样品6 个)。
正己烷、二氯甲烷(均为色谱纯) 美国Fisher Scientific公司;氧化铝(100~200 目,使用前在高温炉中400 ℃烘烤60 h,冷却,置于干燥器备用)国药集团化学试剂有限公司;液体石蜡(paraffin oil,PO)、正四十八烷(n-octatetracontane,C48)、联环己烷(cyclohexyl cyclohexane,Cycy)、胆甾烷(5-α-cholestane,Cho)、1,3,5-三叔丁基苯(1,3,5-tritert-butyl-benzene,TBB)、C7~C40正构烷烃混合标准溶液(色谱纯) 美国Sigma-Aldrich公司。
1.2 仪器与设备
自行搭建HPLC-GC联用仪(包括LC-20A高效液相色谱系统(配备紫外检测器)、GC-2010 plus气相色谱仪(配备程序升温蒸发(programmed temperature vaporizer,PTV)进样系统、FID和AOC-5000 Plus自动进样器) 日本岛津公司;N-EVAP氮气吹干仪 美国Organomation公司。
1.3 方法
1.3.1 标准溶液配制
C48、Cho、TBB混合标准溶液:3 mg/L;Cycy内标溶液:300 mg/L;液体石蜡标准工作溶液:0.5、1.0、5.0、25.0、50.0、100.0 mg/L。
1.3.2 样品中MOSH的提取
称取大米样品10.0 g于50 mL锥形瓶中,加入10 μL 300 mg/L的Cycy内标溶液,加入正己烷于60 ℃超声提取2 次(每次10 mL,20 min),吸取上清液;合并2 次提取液,氮吹浓缩至1 mL。为验证提取是否完全,样品经2 次提取后的残渣用正己烷清洗,再加入10 mL正己烷和10 μL内标溶液于残渣中,60 ℃超声提取80 min,吸取上清液,浓缩后检测其中MOSH含量,含量低于前2 次提取的4%,则认为提取完全,可以确定提取次数为2 次。
由于稻谷样品中含有大量的天然正构烷烃,干扰后续MOSH的测定,因而提取液需先用活化的氧化铝去除正构烷烃后再进行浓缩。具体操作方法为:将10 g活化氧化铝装入玻璃层析柱,以正己烷平衡柱床,然后加入提取液,以10 mL正己烷洗脱,收集洗脱液并浓缩、定容至1 mL,注入HPLC-GC分析。
1.3.3 HPLC-GC分析条件
H P L C条件:S u p e l c o L C-S I液相色谱柱(250 mm×2.1 mm,5 μm)。流动相:A为正己烷,B为二氯甲烷;梯度洗脱:0~0.1 min,100% A(流速0.3 mL/min);0.1~9.5 min,70% A(流速0.3 mL/min);9.5~18.5 min,100% B(反向,流速0.5 mL/min);18.5~28.5 min,100% A(流速0.5 mL/min)。进样量:100 μL。
采用AOC-5000 Plus将MOSH馏分(2.5~3.1 min)转移至GC的PTV汽化室,MOSH进入PTV衬管后,设置升温程序除去溶剂,并将目标组分导入GC色谱柱中分析。PTV升温条件:初始温度35 ℃保持1 min(分流比180∶1),以250 ℃/min升温至360 ℃(关闭分流阀2 min,随后以100∶1开启分流阀)。
G C分析条件:A g i l e n t D B-5 H T毛细管柱(15 m×0.25 mm,0.1 μm);升温程序:35 ℃保持4 min,以40 ℃/min升温至370 ℃,保持5 min;载气为高纯氦气;柱内采用恒压模式,压力为60 kPa;FID温度380 ℃。
1.4 数据分析
以Cycy为内标物定量计算MOSH的含量。MOSH的含量通过计算谱图基线与宽峰之间的面积得到,基线取决于样品空白的GC谱图;宽峰上方的尖峰为天然烷烃,定量计算时扣除[10]。
GC谱图采集和分析分别采用5D Solution和LabSolutions软件(日本岛津公司)。数据以表示,采用GraphPad Prism 7统计软件进行数据分析,配对t检验方法进行组间差异显著性比较,P<0.05,差异显著,P<0.01,差异极显著。
2 结果与分析
2.1 天然烷烃的去除
植物的角质层和表面蜡质中含有大量天然烷烃,主要为以C23~C35为主的奇数碳正构烷烃[1]。稻谷没有去除稻壳、皮层和胚,因而含有大量天然烷烃(图1A)。MOSH是由大量的、几乎连续的直链、支链烷烃和环烷烃组成,其GC谱图呈一个无法分离且跨越一定碳数范围的宽峰,MOSH的含量只能通过对基线与宽峰之间的峰面积积分计算;而宽峰上面的尖峰为天然烷烃,不能算作污染物,计算MOSH时需要扣除。也就是说,如果天然烷烃不干扰MOSH宽峰轮廓勾勒计算峰面积,则无需去除天然烷烃[27]。然而,稻谷的GC谱图(图1A)显示:以C27、C29、C31和C33为主的天然烷烃含量过多,已经严重干扰MOSH谱图的积分。因此,必须通过前处理去除稻谷中的天然烷烃。
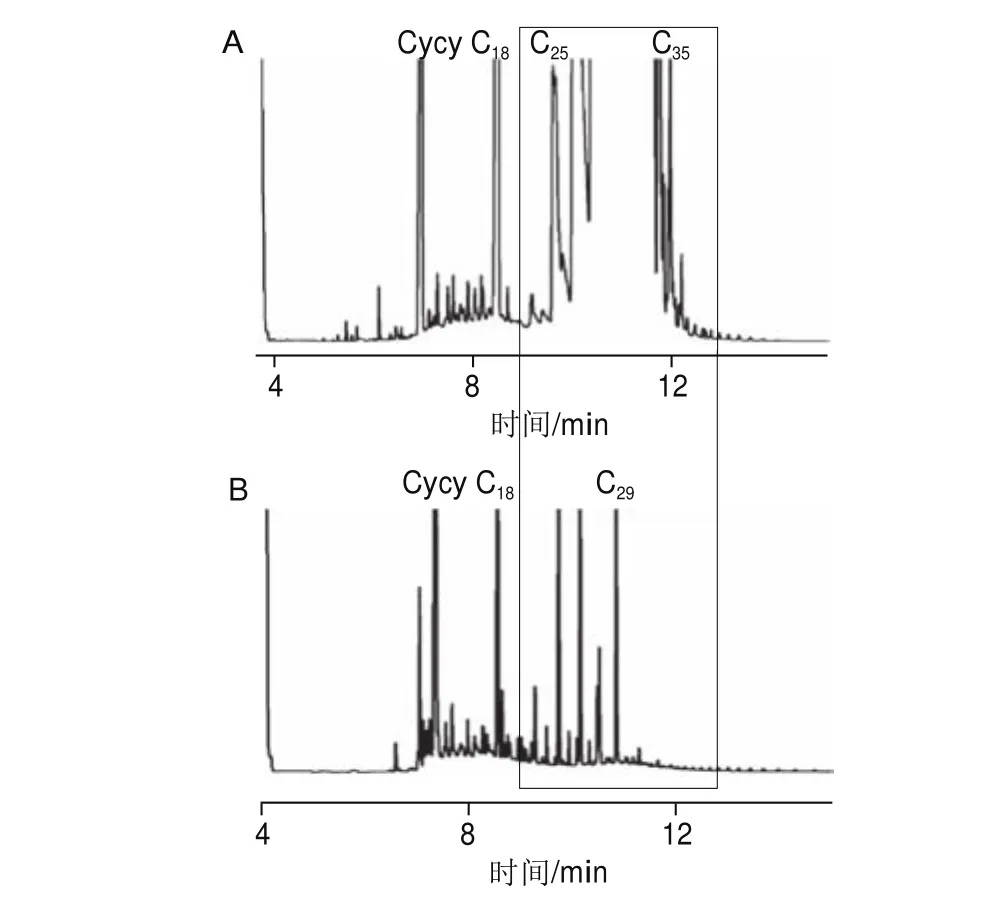
图1 稻谷MOSH提取液经活化氧化铝净化前(A)、净化后(B)的HPLC-GC谱图Fig. 1 HPLC-GC chromatograms of crude (A) and puri fi ed (B)MOSH extracted from paddy
通常,氧化铝有选择性吸附长链正构烷烃的作用,但吸附能力不强。Fiselier等[5,28]研究表明:20 g活化氧化铝根据不同活化温度可吸附1~2 mg碳数高于C20的正构烷烃;同时也会吸附少量的异构烷烃和环烷烃,以及1.8~2.3 μg的液体石蜡,由于矿物油分析的复杂性与特殊性,一般认为该吸附量不影响矿物油的检测。因此,选用400 ℃活化10 g氧化铝净化稻谷提取液既可以去除天然烷烃,又不影响目标物的测定。
由图1A可见,正构烷烃含量过高,无法找到MOSH的轮廓;图1B为去除天然烷烃后的GC谱图。经过氧化铝净化,天然烷烃的C31~C35部分被完全吸附,大部分C25~C29烷烃被除去;剩余的烷烃已经不再干扰MOSH宽峰的轮廓,完全不影响矿物油宽峰面积的积分计算(图1中方框部分)。因此,确定以10 g活化氧化铝去除稻谷提取液中的天然烷烃。
2.2 MOSH的中心切割时间
HPLC-GC中HPLC用于分离除去样品基质(如油脂),同时将MOSH和MOAH分离。由于HPLC色谱柱的颗粒小、分离效率高,一般采用硅胶填料即可达到分离目的[10]。其次,分离后的MOSH流分需要精准地从HPLC转移至到GC,以完成MOSH的准确定量。本实验通过“中心切割”技术[29],将HPLC流出的MOSH转移至GC分析,再结合GC的大体积进样系统,实现净化-转移-富集-分析的自动化过程。
采用硅胶柱分离提取(浓缩)液中的矿物油时,MOSH最先流出,其次是MOAH,最后是样品基质。对于MOSH馏分,根据体积排阻效应,通常高分子质量的直链烷烃先流出,之后为低分子质量的直链烷烃和环烷烃[10,30]。为精准获得MOSH馏分,本实验配制了C48、Cho、TBB混合标准溶液作为MOSH馏分的标记物,其中C48为高分子质量烷烃标记物、Cho为MOSH馏分终止标记物、TBB为MOAH馏分开始的标记物。精准切割MOSH馏分要求C48全部保留在MOSH中,不得出现在死体积中;Cho必须全部留在MOSH馏分中,不得出现在MOAH中;而代表MOAH的TBB则不得出现在MOSH馏分中。本实验通过标记物确定MOSH馏分的中心切割时间为2.5~3.1 min。
2.3 方法学考察结果
2.3.1 仪器精密度和转移性能
由于MOSH是涵盖一定沸程范围(C10~C50)的饱和烃混合物,低沸点物质容易在溶剂排除的过程中产生挥发损失,本实验通过连续6 次直接进样分析C7~C40正构烷烃混合标准溶液(1 mg/L)评估HPLC-GC的精密度和转移性能。考察C11~C40范围,每种正构烷烃的重复性以相对标准偏差(relative standard deviation,RSD)表示,平均值为1.4%,仪器精密度良好。以n-C20峰面积为参照,计算C11~C40正构烷烃相对于C20的响应情况,结果如图2所示。C11响应因子为0.76,C12响应因子为0.89,C13~C40相对于C20响应因子在0.93~0.98范围内。因为低于C13的MOSH污染很少发生[31],具有毒理学意义的C16~C35的响应因子在0.93~1.0范围内,因此,HPLC-GC的转移性能满足食品样品中MOSH的测定。
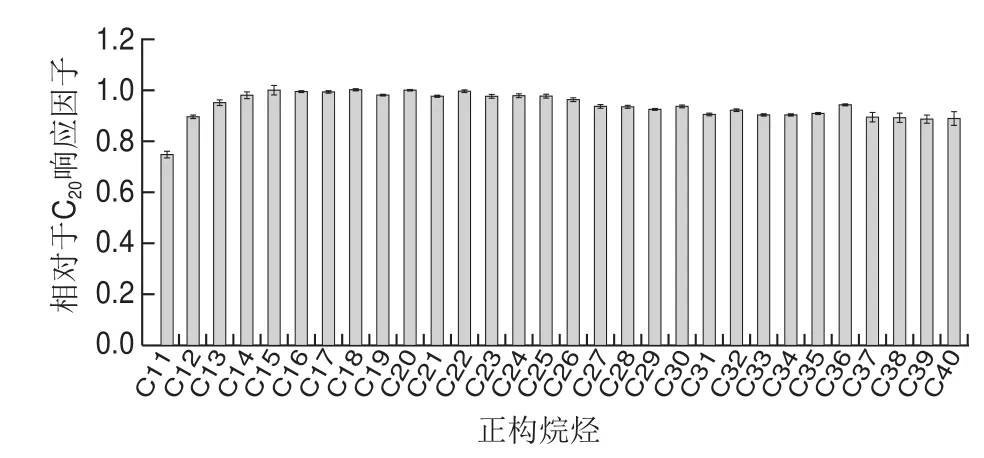
图2 C11~C40相对于C20响应因子分布Fig. 2 Alkane distribution profile within the range of C11–C40
2.3.2 线性范围
液体石蜡常用作MOSH的标准物质。将1.3.1节配制的液体石蜡系列工作溶液,在1.3.3节条件下分析。以GC谱图中的宽峰面积与对应质量浓度绘制曲线,所得标准曲线为Y= 891 483X-216 571,相关系数为0.999 9,说明液体石蜡在0.5~100 mg/L质量浓度范围内线性关系良好。
2.3.3 定量限的测定
定量限根据进入FID的MOSH质量浓度和体积确定。MOSH是饱和烃类化合物的集合(宽峰),其FID的检测灵敏度仅是单个化合物(尖峰)的1%,因此,通常要求进入FID的MOSH量至少达到50 ng才能准确定量分析[10]。本实验将10 g稻谷(或大米)的提取液浓缩至1.0 mL,注入HPLC-GC的体积为100 μL,相当于1.0 g稻谷(或大米)进入FID检测,因此定量限为0.05 mg/kg。
2.3.4 回收率的测定
考虑到稻谷样品经过了氧化铝净化,对分析结果的准确性造成影响[11],为此,本实验选取一个稻谷样品进行方法准确性验证,即向样品中添加液体石蜡溶液进行回收率实验,添加量分别为0.25、0.5、1.0 mg/kg[32]。分析步骤为将提取液先经氧化铝净化,然后浓缩、注入HPLC-GC分析,平行测定6 次后计算加标回收率和RSD。表1表明,加标回收率为89.1%~91.4%,RSD为4.6%~5.5%,说明该方法的准确度满足分析检测要求。
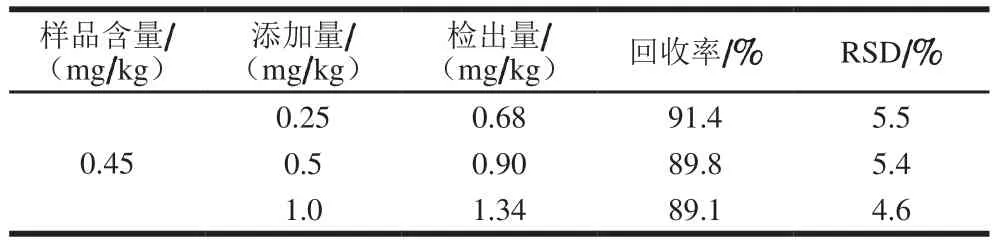
表1 稻谷样品的加标回收率和RSDTable 1 Recoveries and RSDs for spiked samples
2.4 样品检测结果

表2 稻谷和大米样品中的MOSH含量Table 2 Contents of MOSH in paddy and rice samples
任意选取江苏省东南部如东县的6 块稻田,以人工和机器两种方式采收样品,随后将机器采收的稻谷样品送至当地磨坊加工成大米样品,并且随机采购市售商品大米样品6 个,共收集稻谷和大米样品24 个,采用HPLC-GC分析样品的MOSH含量,结果见表2。本方法测定24 个稻谷和大米样品中的MOSH,其含量为0.30~2.30 mg/kg。
2.4.1 比较人工和机器采收的稻谷样品污染情况
人工采收的稻谷样品(A1~A6)中MOSH含量平均值为0.50 mg/kg,污染主要来自于环境[1]。同一块田地的水稻经机器采收(B1~B6)则MOSH含量平均上升至0.60 mg/kg,可能是采收时收割机使用的润滑油或燃料油等机械油污染了稻谷。由表3可知,对同一田地的水稻经人工和机器两种采收方式所得稻谷的MOSH含量配对后进行t检验,P=0.009 9<0.01,进一步说明了两种采收方式对稻谷的MOSH含量有显著差异,机器收割方式引入了新的污染。
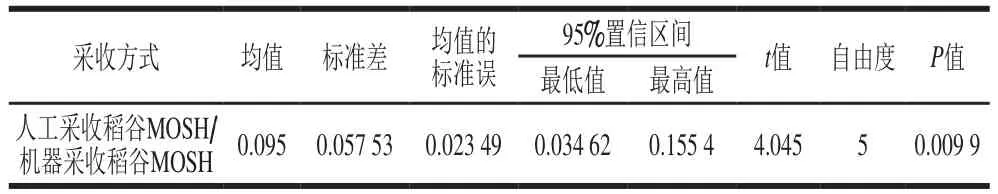
表3 采收方式的配对t检验Table 3 Paired t- test of the effect of harvesting methods on MOSH content of paddy
2.4.2 机采稻谷经磨坊加工后的污染变化
江苏省如东县绝大多数农民都使用当地磨坊加工的自家田地种植的大米,因此将机器采收的稻谷样品(B1~B6)直接在当地磨坊加工成大米样品(C1~C6)。如表4所示,机收稻谷和经过磨坊加工后大米的MOSH含量配对后进行t检验,P=0.001 2<0.01,随着稻谷脱去谷壳,磨坊大米中MOSH含量显著降低(约50%)。由此可见,稻谷中有接近一半的矿物油污染存在于谷壳中,脱壳过程可以去除大部分矿物油污染,并且主要是毒性较大的C16~C35MOSH(表2)。

表4 磨坊加工稻谷前后的配对t检验Table 4 Paired t- test of the effect of mill processing on MOSH content of paddy
2.4.3 比较磨坊大米和市售大米的污染情况
我国市售商品大米样品(7~12)MOSH的污染水平(平均值1.19 mg/kg)远低于德国市场商品大米中MOSH的污染水平(平均值12.1 mg/kg)[24],却是农村磨坊大米样品(平均值0.33 mg/kg)的4 倍。磨坊将稻谷加工成大米取样只经过3 次碾米工序,而商品大米生产过程复杂,碾米工序后还需抛光、色选、包装等工序,因而推断后续的加工及包装环节[25]给大米引入了新的污染。
2 种市售大米的MOSH谱图(图3)呈现出不同的碳数范围分布和谱图特征。其中图3A中MOSH宽峰主要位于低沸点区域,碳数范围以n-C17为中心,是柴油污染的典型特征;图3B中的大部分MOSH处于中心碳为n-C29的高沸点区域,通常被认为是润滑油的典型特征[3]。需要注意的是,这两种污染油的污染程度不同,图3A的柴油污染量为0.35 mg/kg,图3B的润滑油污染为1.81 mg/kg。由此可见,市售大米的矿物油污染很可能是在碾米之后的抛光、色选、包装等加工环节,受到柴油和润滑油迁移污染。
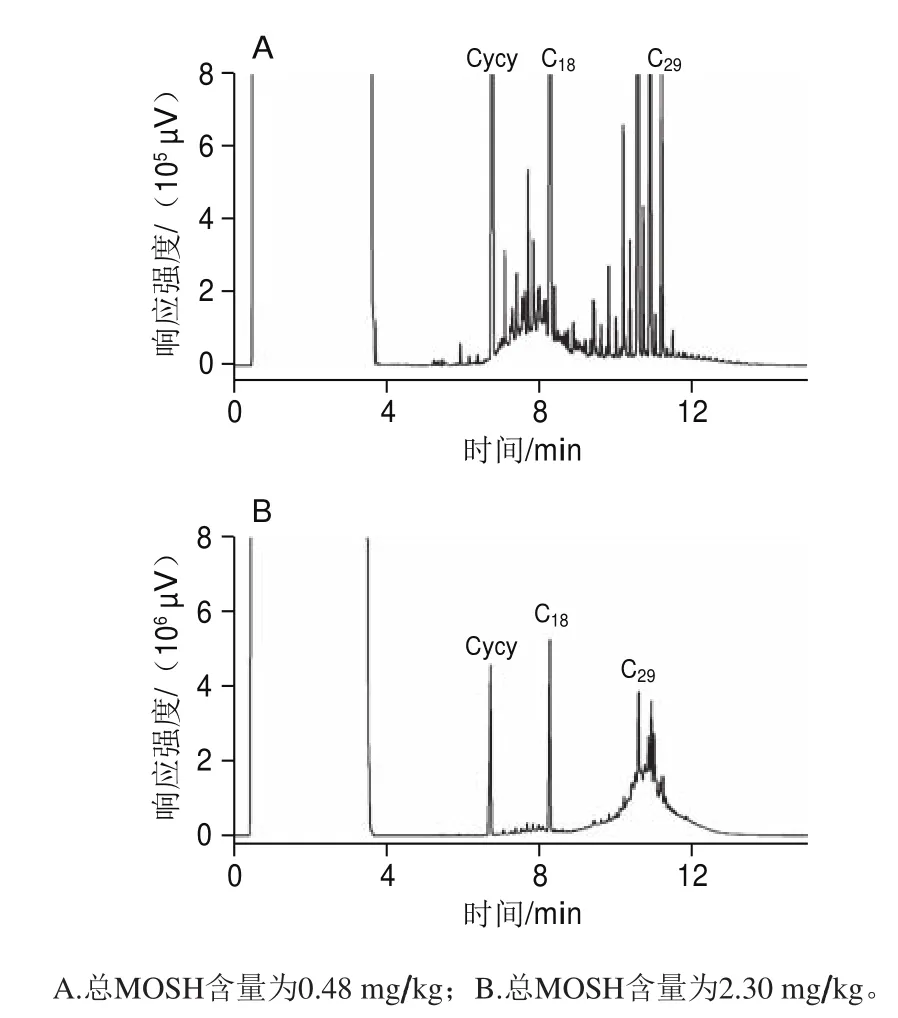
图3 市售大米中MOSH的HPLC-GC谱图Fig. 3 HPLC-GC chromatograms of MOSH contamination in commercial rice samples
3 结 论
本研究建立了HPLC-GC测定稻谷和大米中MOSH的方法,包括确定氧化铝去除天然烷烃干扰的条件,应用中心切割技术精准分离得到MOSH馏分,优化了大体积进样条件与GC分析条件,最终实现了样品前处理与分析过程的自动化。该方法通过精密度、线性范围、回收率等方法学考察,可以用于大米等谷物样品的日常检测。此外,本实验通过比较分析稻谷和大米样品的MOSH含量及其GC谱图特征,推测大米的矿物油污染来源可能来自大米商品化的抛光、色选、包装等加工环节引入的柴油和润滑油污染,建议加强产业链监管,保证大米质量安全。
