硬化性肺细胞瘤的临床及多层螺旋CT表现
2019-08-29王梅曹捍波王和平王兆宇
王梅 曹捍波 王和平 王兆宇
硬化性肺细胞瘤(pulmonary sclerosing pneumocytoma,PSP)是一种少见的肺良性腺瘤,多于体检时偶然发现,因临床表现和影像学表现缺乏特异性而易被误诊。本研究对18例经手术及病理证实的PSP患者资料进行回顾性分析,探讨其MSCT征象,旨在加深对此疾病的认识,为临床诊治提供参考依据。
1 资料和方法
1.1 一般资料 收集我院2012年6月至2017年6月治疗的18例PSP患者临床资料,男3例,女15例,年龄18~73岁,中位年龄52岁。18例均无明显肺部临床表现,健康体检或非肺部其他疾病住院检查发现14例,肺部其他疾病CT检查发现4例。所有患者均经手术病理证实。本研究经本院伦理委员会同意。
1.2 仪器与方法 采用东芝Aquilion 64排螺旋CT机,常规胸部扫描,扫描范围从肺尖至肺底部水平,扫描电压 120kV,电流 110mA,准直 0.625×64,层厚和层距均为3mm作为扫描参数。其中12例行CT增强扫描,CT增强患者使用非离子型碘对比剂(320mgI/ml),经右肘正中静脉取注射速度3.0ml/s,1.5ml/kg计算患者所需对比剂总量,自动团注法追踪技术,双期扫描。以最小层厚 0.5mm,间隔 0.5mm,高分辨率算法(HRCT)及标准法重组,而后传入Vitrea图像后处理工作站,利用重建软件对病灶进行多平面重组(multiplanar reformation,MPR)、最大密度投影(maximum intensity projection,MPR)及容积再现(volume rendering,VR)等后处理,从而显示病灶形态与邻近结构关系。
1.3 图像分析 所有CT图像在肺窗(窗宽1500HU,窗位-500HU)和纵隔窗(窗宽400HU,窗位40HU)下进行观察,由2位高年资胸部放射学诊断医师分别独立阅片,并记录以下内容:(1)病灶形态学表现:包括病变位置、大小、形状、有无分叶、密度(平均CT值)及有无钙化;(2)邻近结构改变:即病变周围组织的继发性改变(包括“血管贴边征”、“晕征”及“空气新月征”);(3)增强表现:主要包括强化类型及程度。增强后无肉眼可辨的密度不均匀区,为均匀强化;增强后病灶内见点、条状及片状强化显著区或不强化区,为不均匀性强化。增强程度按Swensen标准[1],即CT值增加<15HU为无强化,CT值增加15~25HU轻度强化,CT值增加>25~45HU中度强化,CT值增加>45HU明显强化;(4)有无肺门和(或)纵隔淋巴结肿大。
2 结果
病灶形态学改变:18例PSP均为单发,其中左肺6例(上叶2例,下叶4例),右肺12例(上叶2例,中叶4例,下叶6例),病变肺叶分布无明显倾向性,均位于肺野外带靠近胸膜下,呈圆形或类圆形,边界清楚,直径8~31mm,平均 18.9mm,未见分叶,2 例(11.1%)病灶内见斑点状钙化影。邻近结构改变:6例(33.3%)病灶旁见“血管征贴边”(图 1),2 例(11.1%)见“晕征”(图 2),1 例(5.6%)见“空气新月征”(图 3)。增强表现:12 例同时行平扫和增强的病例中,平扫平均CT值约16~48HU,平均35.7HU,动态扫描 CT 值 48~113HU,平均 82.6HU,增强扫描强化净值(47.5±21.2)HU,8 例为不均匀强化,4 例均匀强化。18例PSP均无肺门和(或)纵隔淋巴结肿大。
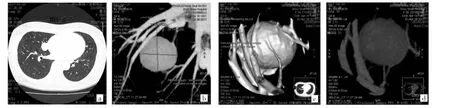
图1 患者,女,56岁。(a:肺窗右肺中叶见一类圆形高密度影,边界清晰;b:MIP示病灶大小21.5×24.3mm,密度均匀;c、d:三维重建见“血管贴边征”)
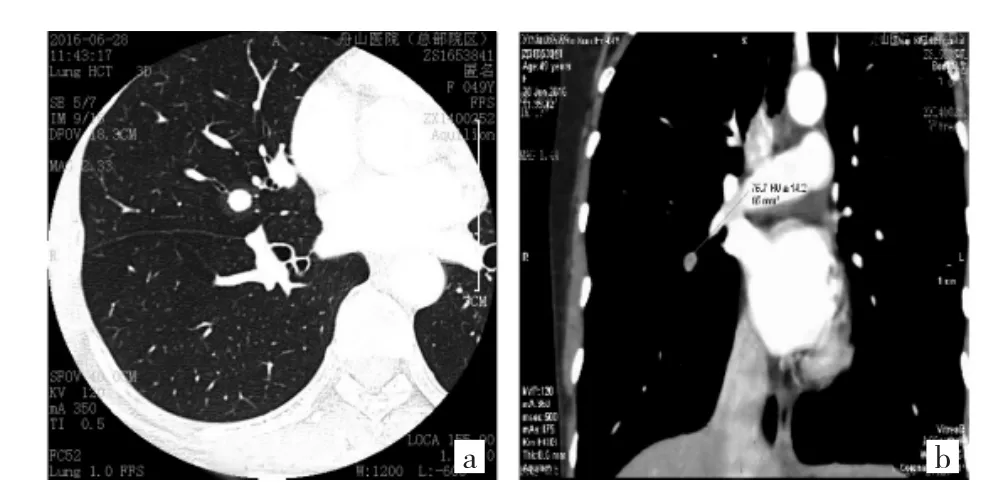
图2 患者,女,49岁。[a:右肺中叶见一类圆形高密度影,边界光整,病灶边缘见“晕征”;b:增强扫描平均CT值约(75.7±14.2)HU]
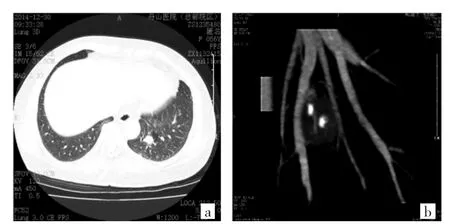
图3 患者,女,56岁。(a:左肺下叶类圆形高密度影,病灶边缘见“空气新月征”;b:MIP重建病灶内见钙化,瘤旁见“血管贴边征”)
3 讨论
3.1 临床及病理特点 PSP是肺泡至终末细支气管的错构,组织来源是原始呼吸系统上皮的肿瘤[2],2015年WHO肺肿瘤分类把它列入肺腺瘤,属于上皮来源良性肿瘤(0类)[3]。光镜下观察肿瘤是由位于上皮下间质中卵圆形细胞和表面立方形细胞构成四种组织形态结构:血管瘤样区、乳头状区、实性区、硬化区(纤维化区)。由于细胞是连续谱系,组织结构有序贯关系,所以PSP内有2种或2种以上结构混合存在,不同组织结构间相互移行。本组患者均有3种以上结构。有研究发现卵圆形细胞的雌激素受体、孕激素受体在该肿瘤中具有高表达性[4-5],这为PSP好发于女性提供了细胞学证据。本组研究18例PSP患者,男3例,女15例,男女比例是1∶5,与文献报道PSP好发于中年女性相符[5]。PSP患者一般无临床不适症状,少数表现为咳嗽、咳痰、胸闷、胸背部痛、咳血及发热等非特异性表现,有学者提出PSP病灶愈大、位置越靠近肺门,引起胸部不适等症状的概率越高,本组病灶平均直径18.9mm,且多位于肺野外带,无肺部症状[6-8]。
3.2 CT表现与病理基础 PSP的典型CT表现为肺内孤立性结节或肿块,圆形或类圆形,边界清晰,很少有分叶。本组研究中12例(66.7%)PSP表现为圆形,6例(33.3%)为类圆形,均为孤立性结节,境界清楚,无分叶。PSP组织细胞来源较为一致,且没有阻挡时(如叶间胸膜限制)生长上具有各向同向性,结果必然是接近圆形或类圆形。由于良性肿瘤属膨胀性生长,细胞数量逐渐增多,肿瘤内上皮间质转换(EMT)缓慢而有限,因此病灶即使位于胸膜下,也无胸膜牵拉。肺肿瘤钙化的发生在纤维化区域、软骨及坏死组织,形成和发展的速度很慢,PSP的硬化区即纤维化组织,持续很久就会出现散在或条状的钙化,多位于病灶边缘。本组患者中有2例(11.1%)见钙化。
本组患者动态增强扫描均为中至显著强化,其中8例为不均匀强化,4例为强化均匀。增强明显强化的区域是血管瘤样区和乳头状区,实性区和纤维硬化区强化程度较低,结合免疫组化分析,血管瘤样区的血管样结构内衬肺泡上皮细胞,甲状腺转录因子阳性,而CD34阴性。史景云等[9]认为PSP强化程度与病灶内微血管密度有关,组织学以血管瘤样及乳头状结构为主的病灶,微血管密度高,增强扫描表现为早期显著强化。而本研究发现单凭肿瘤内微血管密度增高不足以解释其强化幅度常高于肺癌的情况,因为肺癌的微血管密度不低于PSP,再次对照病理切片,看见血管瘤样区内的红细胞是鲜活状态,说明血管瘤样区内有血液灌注,对比剂可以完全可以进入,这些区域面积远大于普通血管截面积之和,所以PSP增强扫描呈中度、显著性及渐进性强化。
邻近结构改变:本研究6例(33.3%)瘤旁见“血管贴边征”,发生机制可能是PSP属于成年后生长和发展的良性肿瘤,病灶虽然膨胀性生长,但它不像早期肺癌沿着肺泡壁贴壁生长,将血管支气管包绕进来,而是随着肿瘤膨胀性生长,压迫、推挤邻近的气管及支气管结构,形成所谓的“血管贴边征”。2例(11.1%)病灶边缘见淡薄的“晕征”,结合病理血管瘤样区有血液灌注,这些区域并没有像血管一样完整的边界,也就是说有缝隙,血液可以向周围肺泡渗出,这样就形成了出血晕征,常常呈很淡的云雾状,边界不清,密度较低,不掩盖肿瘤边缘。部分文献报道“空气新月征”[10],即病灶周围半月形无肺纹理透亮影,多为肿瘤内残存支气管或瘤体内出血破裂与邻近支气管相通,形成单向阀门效应有关,本组病例中仅1例。本组病例均未见肺门及纵隔淋巴结转移,与周永等[11]研究一致。
综上所述,笔者认为硬化性肺细胞瘤具有以下特点:(1)好发于中老年女性、几乎无呼吸道症状;(2)CT表现为肺内孤立性结节,圆形或类圆形,表面光整,大多无分叶,密度均匀;(3)部分病灶可见钙化;(4)增强扫描病灶呈中度至显著强化及渐进性强化;(5)病灶边缘大多有“血管贴边征”,部分病灶边缘见单薄的出血晕征。
