甲状腺微小乳头状癌与结节性甲状腺肿的超声灰阶比值对照研究
2019-08-29徐陈柯俞丽芳韩志江雷志锴方建华
徐陈柯 俞丽芳 韩志江 雷志锴 方建华
回声强度是超声检查评估甲状腺结节良、恶性的重要参数,依据颈部带状肌和甲状腺回声强度,通常把结节回声强度分为无回声、极低回声、低回声、等回声和高回声[1]。近年来,虽然低和极低回声对甲状腺恶性结节的诊断价值已得到许多学者认可[2],但前者的特异度和后者的灵敏度均较低,远不能满足临床需要[3-7],而且两者的判断均存在较大的主观性,如果能够量化甲状腺结节的回声水平,将在很大程度上提高超声检查诊断甲状腺结节的效能。本研究通过对93例PTMC患者共115枚结节与78例MNG患者共92枚结节的超声灰阶比值(ultrasound gray scale ratio,UGSR)进行对比分析,旨在量化超声声像图的回声强度,为PTMC与MNG鉴别诊断提供更客观的依据。
1 对象和方法
1.1 对象 回顾分析2017年1月至2018年10月经病理证实的349例患者(共433枚结节)的超声资料,所有纳入患者均于本院先后进行了门诊甲状腺常规超声检查和术前超声定位检查,通过RADinfo阅片系统,分别对两组中的甲状腺结节及同一增益水平甲状腺组织的灰阶值进行测量并计算UGSR,UGSR=甲状腺结节灰阶值/同一增益水平甲状腺组织灰阶值。将患者门诊常规超声检查结果作为门诊检查组,术前超声定位检查作为术前定位组,并进一步取两组的均值作为均值组。排除标准:(1)结节直径>1.0cm 或<0.4cm,排除 102 例患者共125枚结节;(2)以囊性为主的结节,排除46例患者共60枚结节;(3)钙化显著影响测量的结节,排除12例患者共18枚结节;(4)甲状腺回声改变明显,且病理提示桥本甲状腺炎者,排除18例共23枚结节。最终171例患者207枚结节纳入本研究,包括82例PTMC患者共104枚结节和67例MNG患者共79枚结节,此外另有11例患者同时包含11枚PTMC和13枚MNG结节。结节大小 0.4~1.0(0.71±0.18)cm;患者男 36 例,女135 例,年龄 23~78(46.80±11.82)岁。
1.2 仪器和方法 应用Esaote My Lab Twice、迈瑞Resona 7s及Philips HD 11 XE等超声诊断仪,配备线阵探头,频率为4~13MHz。患者仰卧位,头部后仰,暴露颈前区,对病灶进行纵切面、横切面和斜切面等多切面扫查,观察甲状腺结节的数目、大小、形态、边界、周边声晕、内部回声、钙化、结节内部和周边血供,以及双侧颈部淋巴结情况,并将图像与检查报告保存于PACS系统中。
由2位主治和主治以上职称的超声科医师在不了解病理结果的前提下,共同对入选的超声图像进行分析,协商确定结节和周围正常甲状腺组织感兴趣区域(region of interest,ROI),采用 RADinfo 阅片系统对超声图像进行测量。测量结节ROI时,采用超声纵切图像,避开钙化和坏死液化区。对于回声均匀结节,ROI应>1/2结节面积;对于回声不均匀结节,选取该结节主要回声区域进行测量,同样采取>1/2该回声区面积的ROI;测量结节周围甲状腺组织灰阶值时,尽量选取与测量结节同一横向水平的区域,测量范围与结节ROI大小相同,结果取两次测量结果的平均值,见图1-2。

图1 0.6cm PTMC结节的UGSR测量示意图 [a:PTMC平均灰阶值58.577594;b:同一增益水平甲状腺平均灰阶值122.827338;UGSR 为 0.476910(58.577594/122.827338)]
1.3 统计学处理 采用SPSS 19.0统计软件。计量资料以表示,多组间比较采用方差分析,两组间比较采用t检验。门诊检查组与术前定位组UGSR的一致性检验采用可靠性分析。绘制UGSR分别对3组内PTMC和MNG鉴别诊断的ROC曲线,分析各组ROC曲线AUC及UGSR诊断PTMC的灵敏度、特异度、准确性、阳性预测值及阴性预测值,寻找最佳UGSR。P<0.05为差异有统计学意义。
2 结果
门诊检查组、术前定位组及均值组UGSR分别为0.64±0.22、0.64±0.22 和 0.64±0.20,3 组间比较差异无统计学意义(F=0.00,P=0.99)。门诊检查组 PTMC 和 MNG的 UGSR 分别为 0.53±0.14 和 0.78±0.22,差异有统计学意义(t=13.69,P=0.00);术前定位组 PTMC 和 MNG 的UGSR 分别为 0.54±0.14 和 0.77±0.23,差异有统计学意义(t=20.73,P=0.00);均值组 PTMC 和 MNG 的 UGSR 分别为 0.54±0.12 和 0.77±0.21,差异有统计学意义(t=25.36,P=0.00)。UGSR 在 3组中对 PTMC 和MNG 鉴别的 ROC 曲线 AUC 分别为 0.829、0.805 和 0.833,当 UGSR分别为 0.648、0.646 和 0.657 时约登指数最大,分别为0.592、0.541 和 0.615,诊断 PTMC 的灵敏度和特异度分别为 0.809 和 0.783、0.791 和 0.750 及 0.843 和 0.772,见图3。门诊检查组和术前定位组间UGSR值一致性较好(ICC=0.75,P=0.97)。
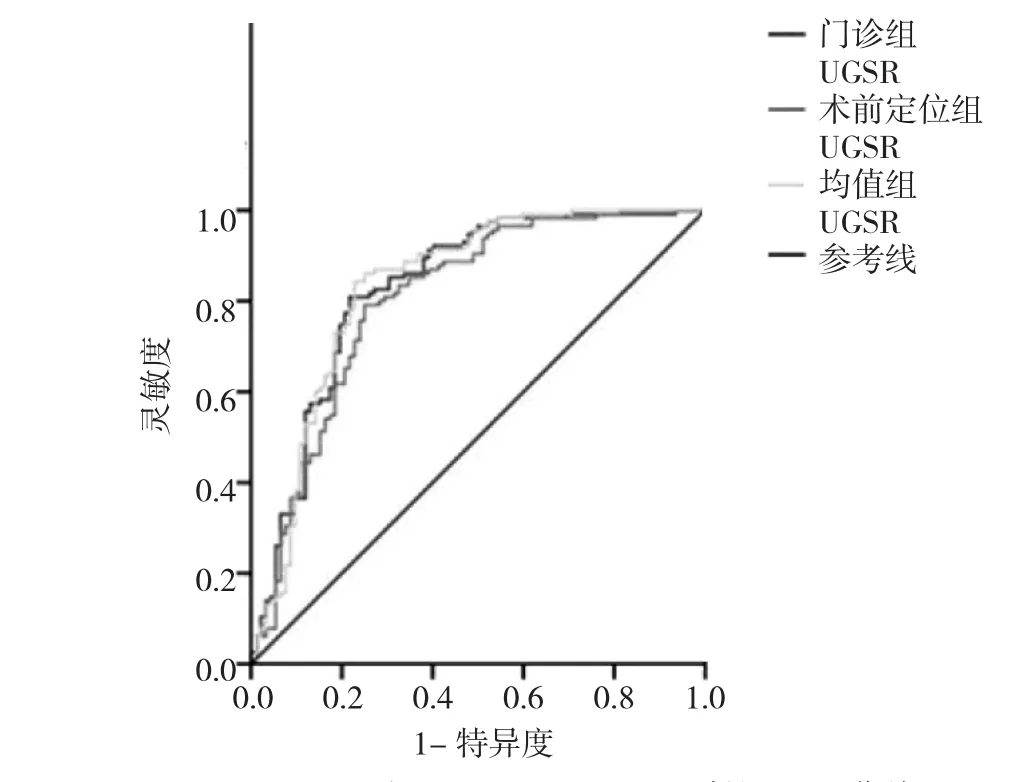
图3UGSR对PTMC和MNG鉴别的ROC曲线
3 讨论
PTMC是45岁以上人群发病率最高的甲状腺恶性肿瘤,且增长速度最快,在所有诊断的甲状腺癌中所占的权重最大[8-9]。PTMC超声图像多表现为低回声和极低回声,以极低回声尤为明显,但两者间的差异肉眼很难判断,易受观察者主观影响。不同研究报道两者在甲状腺恶性病变中的诊断效能差异较大,其中低回声的灵敏度和特异度为 62%~95.3%和 21.8%~67.7%[3-5],极低回声的灵敏度和特异度为 17.1%~41.4%和 90.9%~98.8%[6-9]。显然,低回声的特异度和极低回声的灵敏度已不能满足快速发展的甲状腺癌整体学术水平,有待寻求量化评估甲状腺结节回声强度特征的方法。
2013 年,Erol等[10]提出病变回声强度比值(lesion echogenicity ratios,LER)的概念,即乳腺周围脂肪小叶和病变的UGSR,研究结果显示恶性病变的LER明显高于良性病变。以上研究虽然对乳腺的超声回声水平进行了量化,但其研究未考虑以下3方面因素,包括:(1)月经周期和年龄等生理因素会对LER产生影响;(2)病变邻近的脂肪常散在分布,测量不同的区域获得的结果会存在一定差异;(3)不同机型、增益水平、动态范围、频率和操作者等均可能对LER造成影响。在前期研究中,笔者团队首次提出了UGSR的概念,并用于PTMC和MNG的鉴别诊断,结果显示UGSR在两者的鉴别诊断中具有重要价值[11-12]。显然,采用UGSR对甲状腺病变进行研究,不受患者年龄等生理因素和病变邻近脂肪组织分布的影响,但是否受不同机型、增益水平、操作者等众多因素影响有待进一步研究。此次研究旨在进一步探讨UGSR在不同机型、增益水平、动态范围、频率和操作者等因素综合影响下对PTMC和MNG的鉴别诊断价值。因同一患者术前均至少行2次超声检查,故笔者将同一组PTMC与MNG患者的2次检查结果分别设为门诊检查组和术前定位组,并将2次检查的UGSR均值设为均值组,结果显示3组间UGSR差异无统计学意义,并且门诊检查组和术前定位组测得的UGSR一致性较高(ICC=0.75,P=0.97)。3 组中比较结果均显示 PTMC的UGSR明显低于MNG。进一步建立ROC曲线,结果显示UGSR对PTMC和MNG鉴别的ROC曲线AUC分别为 0.829、0.805 和 0.833。当 UGSR 分别为 0.648、0.646 和 0.657 时约登指数最大,分别为 0.592、0.541 和0.615,诊断PTMC的灵敏度和特异度分别为0.809和0.783、0.791 和 0.750 及 0.843 和0.772,与前期研究结果接近[11-12],且特异度均高于既往文献报道[4-7]。随着UGSR的降低,各组诊断PTMC的灵敏度均不同程度降低,而特异度有所增高,降低了假阳性率,这对减少不必要的手术干预具有重要意义。由此,本研究提示UGSR是PTMC和MNG鉴别诊断中的一个较可靠的量化参数。
综上所述,在不同机型、增益水平、动态范围、频率和操作者等众多因素影响下,测得UGSR一致性较高,且操作简单,用于PTMC和MNG的定量评估和鉴别,值得推广应用。但本研究尚存在以下不足:(1)本文为回顾性分析,不可避免的存在选择偏倚;(2)本研究数据均来源于同一医疗单位,且样本量有限,有待多中心及进一步扩大样本研究;(3)不同患者、操作者及设备等因素各自对UGSR的影响有待后续研究。
