植物酸对烟曲霉菌的抑制作用
2019-08-21张婷徐岩岩李洁
张婷 徐岩岩 李洁

摘要:为研究植物酸对烟曲霉的抑制作用,以烟曲霉菌为试验材料,通过测定植物酸的最小抑菌浓度(MIC),以MIC和1/2MIC的植物酸液体培养烟曲霉,观察烟曲霉菌丝生长和分生孢子顶囊形态变化;并进行转录组测序,初步探讨其抑菌机制。结果表明,植物酸具有抑制烟曲霉生长的作用,最小抑菌浓度为20 μL/mL。在1/2MIC植物酸培养烟曲霉时,菌丝生长受到抑制,菌丝形态及分生孢子顶囊部分发育不完全。转录组测序结果显示,差异基因代谢通路主要集中在代谢过程,其次是遗传信息处理。涉及上调基因数目较多的代谢通路主要包括氨基酸生物合成、核糖体、氧化磷酸化和氨酰tRNA生物合成。涉及下调基因数目较多的代谢通路主要是代谢通路,其次是次级代谢产物的生物合成、抗生素生物合成以及星形孢菌素生物合成。推测植物酸可能是通過干扰烟曲霉生长过程中的多个信号通路及多个相关基因的表达而实现抑制作用。
关键词:植物酸;烟曲霉菌;最小抑菌浓度;转录组测序;抑菌机制
中图分类号: S482.2+92 文献标志码: A 文章编号:1002-1302(2019)12-0287-06
植物酸是制备活性炭过程中产生的烟气经冷凝回流后收集得到的液体,它的主要成分为酚类和有机酸,同时含有少量无机物[1]。近年来,植物酸广泛应用于农业、食品等行业。研究表明,植物酸有较好的抑菌作用。寇成等用精制的植物酸进行抑菌试验,发现它对大肠杆菌、金黄色葡萄球菌等多种病原菌均有一定的抑制作用[2]。徐岩岩等将植物酸用于平菇细菌性褐斑病防治,试验结果表明,一定浓度植物酸既能有效控制细菌病害,又能促进平菇菌丝的生长[3]。易允喻等采用D值计算法得出苦杏壳植物酸对金黄色葡萄球菌和大肠杆菌的最小抑菌浓度[4]。鉴于化学农药对环境和健康的危害,寻找纯天然、安全、绿色的生物农药迫在眉睫,植物酸是一种纯天然杀菌药物,越来越受到人们重视。
烟曲霉菌是一种常见的病原真菌,对人、畜及作物均有严重危害,多采用化学药剂防治[5-8],尚未见关于植物酸的抑烟曲霉菌及其抑制机制的研究报道。随着高通量测序技术的应用,转录组测序技术已经用于抑菌机制研究[9-10]。笔者所在实验室在研究珊瑚状猴头菌新品种雪玉松茸(Hericium erinaceus)时,获得1株内生烟曲霉菌。从保证食品安全,寻找安全、抗真菌活性天然药物的角度出发,本试验研究植物酸对烟曲霉菌菌丝生长和分生孢子顶囊形态的影响,并通过转录组分析,对植物酸抑制烟曲霉菌的机制进行初步探讨。
1 材料与方法
1.1 试验材料
植物酸由河北绿天生物科技有限责任公司提供;烟曲霉菌为笔者所在实验室从雪玉松茸食用真菌中分离获得,经分子鉴定为烟曲霉菌(Aspergillus fumigatus);阳性药物氟康唑,购自药店。
1.2 试验方法
1.2.1 孢子悬液的制备 烟曲霉菌在35 ℃恒温培养箱中培养4 d,用含0.1% 吐温80的生理盐水冲洗培养基表面,经无菌纱布过滤除去菌丝,7 000 r/min 离心2 min,弃上清,经无菌生理盐水洗2次后,离心弃上清,用生理盐水重悬孢子,用血细胞计数板计数后,调整孢子悬液浓度为100万~500万CFU/mL,于4 ℃保存备用。
1.2.2 琼脂稀释培养法测定植物酸对烟曲霉的最小抑菌浓度 在PDA固体培养基中加入不同剂量的植物酸,浓度分别为5、10、15、20 μL/mL,待冷却至室温后倒平板,于平板中央注入5 μL孢子悬液,同时设立阳性对照组(加氟康唑)和空白对照组(加无菌水),均设置3个平行。35 ℃恒温连续培养4 d,观察并记录菌落直径,PDA固体培养基中无菌落生长的植物酸浓度即为最小抑菌浓度(MIC)。
1.2.3 植物酸对烟曲霉菌菌丝质量的影响 采用PDA培养基进行液体培养,加入植物酸,使其终浓度为1/2MIC,加入孢子悬液,以加无菌水的处理为空白对照组,加氟康唑的处理为阳性对照组,均设置3个平行。于35 ℃、130 r/min条件下进行培养,观察并记录菌丝球生长情况及培养液颜色变化,培养4 d后,过滤菌丝用无菌水冲洗后,烘干至恒质量,测量菌丝干质量。
1.2.4 植物酸对烟曲霉菌分生孢子梗形态的影响 用牙签挑取处理组与空白对照组菌丝于载玻片上,用乳酸酚棉蓝染色后,置于普通光学显微镜下观察,比较菌丝形态的变化。
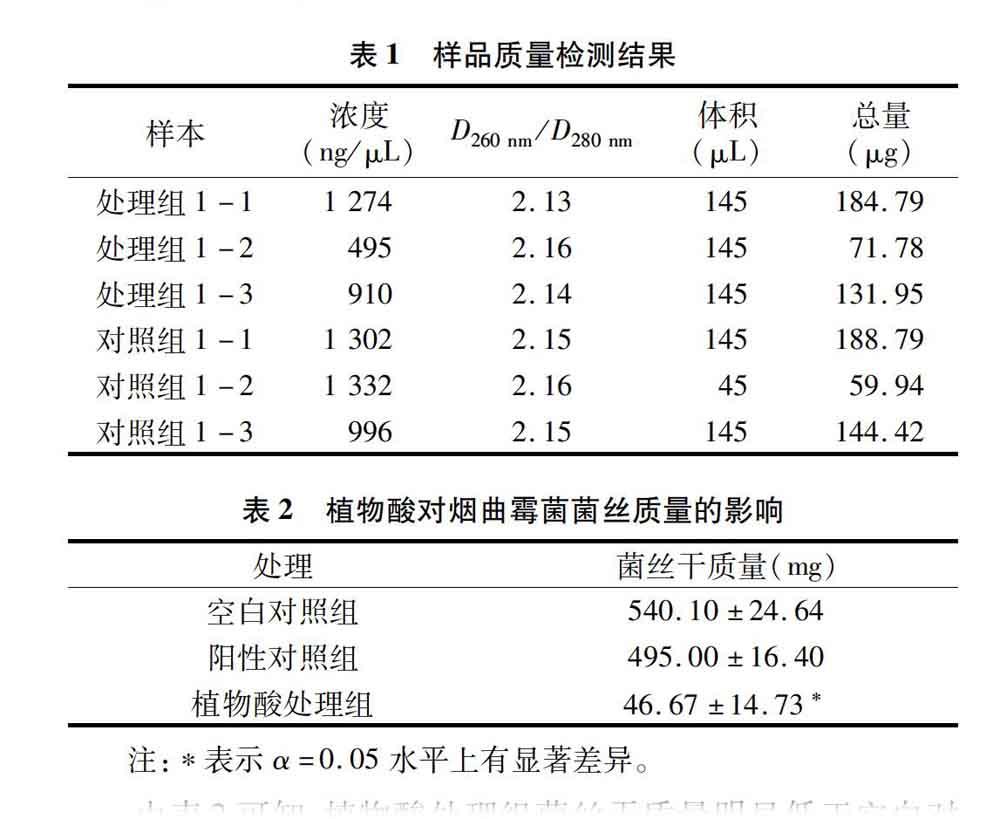
1.2.5 转录组测序 Trizol法提取终浓度为1/2MIC的植物酸处理组及空白对照组烟曲霉菌总RNA,分别标记为处理组1-1、处理组1-2、处理组1-3,对照组1-1、对照组1-2、对照组1-3(表1)。测定样品浓度,质检合格后,送交深圳华大基因科技有限公司进行转录组测序,对差异表达基因(DEG)进行基因的木体论(GO)功能及代谢路径(Pathway)功能分析,分析样品组间基因表达的差异。
1.2.6 数据分析 数据采用SPSS软件进行差异显著性分析,P<0.05表示差异有统计学意义,每组试验重复3次。
2 结果与分析
2.1 不同浓度植物酸对烟曲霉菌的抑制作用
在培养基中分别加入5、10、15、20 μL/mL植物酸,以加氟康唑的处理为阳性对照组,以加无菌水的处理为空白对照组。35 ℃培养4 d后,测定烟曲霉菌菌落直径。发现空白对照组的生长速度显著(P<0.05)高于植物酸处理组,当植物酸浓度为20 μL/mL时,烟曲霉菌生长完全受到抑制,则 20 μL/mL 为最小抑菌浓度(图1)。
2.2 植物酸对烟曲霉菌菌丝质量的影响
在液体培养基中, 加入终浓度为1/2MIC的植物酸,以加无菌水的处理为空白对照组,加氟康唑的处理为阳性对照组。接入孢子悬液,于35 ℃、130 r/min条件下培养4 d,测定菌丝干质量,结果见表2。
由表2可知,植物酸处理组菌丝干质量明显低于空白对照组和阳性对照组,分别为空白对照组和阳性对照组的86%、9.4%,并且与对照组相比,植物酸处理组孢子萌发较晚,且其培养液及菌丝球颜色并未呈现对照组的黑褐色,表明植物酸抑制了烟曲霉菌的生长及色素的合成。
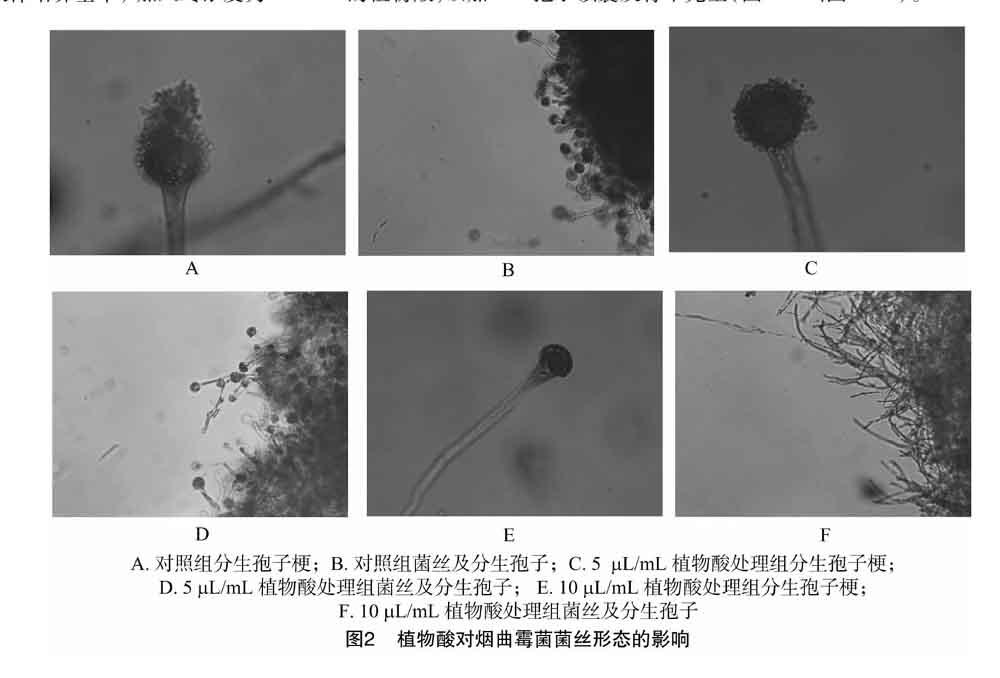
2.3 植物酸对烟曲霉菌菌丝及分生孢子梗形态的影响
由图2可知,将加入5、10 μL/mL植物酸的处理组与对照组的烟曲霉菌用乳酸酚棉蓝染色,显微观察烟曲霉菌的菌丝及孢子形态,结果发现植物酸处理组与对照组存在明显差异。对照组菌丝中分生孢子头数量较多且孢子顶囊呈圆形产孢数量较多(图2-A、图2-B),植物酸处理组中分生孢子头数量随植物酸浓度的增加逐渐减少,10 μL/mL植物酸处理组孢子顶囊发育不完全(图2-E、图2-F)。
2.4 转录组分析
根据差异基因检测结果,对其GO功能进行分类和富集分析。GO分为生物学过程(biological process)、细胞组分(cellular component)和分子功能(molecular function)。结果显示,在生物学过程中代谢过程(metabolic process)、细胞过程(cellular process)和单一生物过程(single-organism process)富集到较多的DEG; 在细胞组分中细胞(cell)、 细胞组分(cell part)、膜(membrane)、细胞器(organelle)、膜组成(membrane part)等富集到的DEG较多;在分子功能中富集到的DEG较多的是催化作用(catalytic activity)和结合作用(binding)(图3)。
进一步对GO功能对应的差异基因上调、下调进行分析。结果(图4)显示,显著上调基因主要集中在细胞组分中的细胞(cell)、细胞组分(cell part)、细胞器(organelle)、细胞器组分(organelle part)和大分子复合物(macromolecular complex);显著下调基因主要集中在生物学过程中的代谢过程(metabolic process)、细胞过程(cellular process)和单一生物过程(single-organism process),以及分子功能中的催化作用(catalytic activity)、结合作用(binding)、转运活性(transporter activity)和核酸结合转录因子活性(nucleic acid binding transcription factor activity)。
根据差异基因检测结果,对其进行KEGG生物通路分类以及富集分析,通路分类结果详见图5,富集通路对应的差异表达基因上调、下调详见图6。差异基因代谢通路主要包括细胞过程(cellular processes)、环境信息处理(environmental information processing)、遗传信息处理(genetic information processing)、代谢(metabolism)、有机系统(organismal systems)。结果显示,差异基因代谢通路主要集中在代谢过程,所涉及到的Unigene数目高达3648条。其次是遗传信息处理,涉及885条Unigene。涉及上调基因数目较多的代谢通路主要包括氨基酸生物合成(biosynthesis of amino acids)、核糖体(ribosome)、氧化磷酸化(oxidative phosphorylation)和氨酰tRNA生物合成(aminoacy-tRNA biosynthesis)。说明植物酸促使蛋白质合成过程加强。涉及下调基因数目较多的代谢通路主要是代谢通路(metabolic pathways),其次是次级代谢产物的生物合成(biosynthesis of secondary metabolites)、抗生素生物合成(biosynthesis of antibiotics)以及星形孢菌素生物合成(staurosporine biosynthesis)。
3 讨论与结论
植物酸是一种纯天然杀菌药物,对植物病原菌、霉菌和细菌均有很好的生长抑制活性[11-14],本研究结果表明,植物酸能够改变烟曲霉菌的菌丝形态,减少或抑制孢子的生成和产率,从而抑制烟曲霉菌的生长。应用转录组测序技术对植物酸处理抑制烟曲霉菌生长的样品进行研究,差异表达基因GO功能分析结果显示,涉及上调基因数目较多的代谢通路主要包括氨基酸生物合成、核糖体、氧化磷酸化和氨酰tRNA生物合成。推測可能是植物酸的有效成分导致蛋白质受损,从而代偿性地促进烟曲霉菌蛋白质的合成过程以满足其生长需要。下调基因主要集中在生物学过程中的代谢过程、细胞过程和单一生物过程。涉及差异基因下调数目较多的生物通路主要集中在代谢通路、次级代谢产物的生物合成。推测植物酸中含有的酸类、酚类等活性物质可能是通过渗透的方式进入烟曲霉细胞内,干扰这些信号通路及相关基因的表达,从而抑制烟曲霉生长。同时发现星形孢菌素生物合成通路中相关基因明显下调,最终减少烟曲霉菌毒素的合成,这一结果解释了加入植物酸液体培养烟曲霉菌时,色素量明显下降的现象。
总之, 植物酸能抑制烟曲霉菌菌丝生长和分生孢子囊的形成,在烟曲霉生长过程中,植物酸通过干扰多个相关基因,致使多个信号通路受到影响,从而达到抑制烟曲霉菌的作用。植物酸的抑菌作用可能是乙酸、酚类和糠醛等多种成分共同作用的结果[15-17],具体机制还有待于进一步研究。
参考文献:
[1]施 琳. 山杏壳木醋液有效成分及生物活性研究[D]. 杨凌:西北农林科技大学,2013:2-8.
[2]寇 成,徐岩岩,于文清,等. 山杏壳木醋液的精制及抑菌活性研究[J]. 林业工程学报,2016,1(6):64-69.
[3]徐岩岩,刘晓光,彭艳芳,等. 精制山杏壳木醋液防治平菇细菌性褐斑病药效试验[J]. 北方园艺,2016(11):148-150.
[4]易允喻,马希汉,赵 忠,等. 苦杏壳木醋液最小抑菌浓度及其抑菌活性的稳定性[J]. 西北林学院学报,2014,29(6):127-131,135.
[5]王 鹏,周 艳,刘金辉,等. 四君子汤对烟曲霉菌毒性代谢产物的抑制作用[J]. 时珍国医国药,2011,22(6):1306-1308.
[6]高 磊. 天然药物小檗碱抑制烟曲霉作用机制的研究[D]. 长春:吉林大学,2012:47-69.
[7]沈 菲,陈艺杰,徐晓兰,等. 蜂胶对烟曲霉抑菌机制的体外研究[J]. 中国蜂业,2016,67(4):12-16,19.
[8]余克花,王 鹏,刘金辉,等. 四君子汤对烟曲霉菌体外生长的抑制作用[J]. 时珍国医国药,2010,21(10):2442-2444.
[9]洪奇阳,毕行建,王大宁,等. 转录组测序技术研究进展[J]. 中国生化药物杂志,2017,37(6):443-448.
[10]赵圣明,赵岩岩,马汉军,等. 转录组学在抑菌机制中的应用研究进展[J]. 食品与发酵工业,2017,43(7):259-264.
[11]Hisashi Y,Hisako W,Sadao Y,et al. Promoting effect of wood vinegar compounds on fruit body formation of Pleurotus ostreatus[J]. Mycoscience,1995,36(2):173-177.
[12]Jung K H. Growth inhibition effect of pyroligneous acid on pathogenic fungus,Alternaria mali,the agent of Alternaria blotch of Apple[J]. Biotechnology and Bioprocess Engineering,2007,12(3):318-322.
[13]Choi J Y,Shinde P L,Kwon I K,et al. Effect of wood vinegar on the performance,nutrient digestibility and intestinal microflora in weanling pigs[J]. Asian-Australasian Journal of Animal Sciences,2009,22(2):267-274.
[14]Marumoto S,Yamamoto S P,Nishimura H A,et al. Identification of a germicidal compound against picornavirus in bamboo pyroligneous acid[J]. Journal of Agricultural and Food Chemistry,2012,60(36):9106-9111.
[15]尉 芹,馬希汉,徐明霞. 杨树木醋液的化学成分分析及抑菌试验[J]. 林业科学,2008,44(10):98-102.
[16]毛巧芝,赵 忠,马希汉,等. 苦杏壳木醋液抑菌活性和化学成分分析[J]. 农业机械学报,2010,41(2):164-170.
[17]王海英,曹宏颖. 农林废弃物木醋液抑菌机制进展[J]. 安徽农业科学,2014,42(3):741-742,839.
