纳米金比色法在家蚕微孢子虫检测中的应用
2019-08-21戴卫江陈红丽张志林
戴卫江 陈红丽 张志林


摘要:家蚕微粒子病被列为蚕种生产的唯一检疫对象,母蛾镜检家蚕微孢子虫(Nosema bombycis,简称Nb)是目前最主要的检疫手段,但其准确性受到多种因素影响。建立一种简便、快捷、准确的Nb检测技术,对家蚕微粒子病的防治具有重要意义。基于纳米金(AuNPs)比色法原理,对AuNPs探针的制备及其标记的最佳抗体浓度和最佳pH值进行探究,以及探究AuNPs比色法检测Nb的灵敏度。结果表明,Nb抗体与AuNPs(20 nm)结合最佳浓度为每500 μL AuNPs溶液中添加5 μL 0.5 mg/mL抗体蛋白,标记最佳pH值为8.5。AuNPs比色法能够最低检测出Nb蛋白量为 10 ng。本研究成功建立一种基于AuNPs比色法检测Nb的新方法。
关键词:家蚕微孢子虫;多克隆抗体;纳米金;探针;比色法
中图分类号:S884.2+1 文献标志码: A 文章编号:1002-1302(2019)12-0208-04
家蚕微粒子病经常给蚕业生产带来巨大的经济损失,严重影响蚕丝产业的稳定,由于家蚕微孢子虫(Nosema bombycis,Nb)能经胚种传染,因此,Nb被列为蚕种生产的唯一法定检疫对象[1-3]。目前最主要的检疫手段母蛾镜检法主要依赖检验人员的判断,主观性强,其准确性受到多种因素的影响[2-4]。免疫学和分子生物学等检测技术在微孢子虫检测鉴定方面已有PCR技术[5]、酶联免疫吸附法[6]、胶体金免疫层析技术[7]、荧光抗体技术[8]、单抗体金银染色法[9]、酶标抗体检测法[10]、核酸分子杂交技术[11]等,这些检测技术对仪器设备和检测人员的技术水平有严格要求,检测成本高且不易操作。因此,建立一种简便、快捷、准确的Nb检测技术,对家蚕微粒子病的防治具有重要意义。
纳米金(AuNPs)比色法主要是利用AuNPs表面等离子体共振引起的颜色和吸光度发生变化,对目标物质进行检测的方法[12-13]。在溶液中,单分散的AuNPs(20 nm)呈现酒红色,并且具有相对较窄的表面等离子体吸收带,在紫外-可见光吸收光谱(UV-vis)光谱中最大吸收峰波长为523 nm[14]。相反,含有AuNPs聚集体的溶液则呈现紫色或者蓝色,这是由于AuNPs表面的等离子体共振吸收峰发生红移[12]。将蛋白质等物质作为形成AuNPs聚集体的连接点,导致检测体系颜色改变,从而达到了对目标物质有效检测[15-19]。Lee等发明了一种基于AuNPs比色检测Hg2+的方法,该方法的检测下限达到 100 nmol/L[20]。Cordray等发明了一种检测目标寡核苷酸浓度的AuNPs比色法,该方法在200 μL试验体积内可以定量检测出 50 amol~500 fmol 目标寡核苷酸[13]。Li等发明一种检测牛奶中β-酪蛋白的AuNPs比色法。该方法将抗体结合在AuNPs上,根据抗原抗体特异性结合,使分散的AuNPs聚集,胶体颜色由酒红色逐渐变成无色,检测限可低至 0.03 μg/mL[21]。由于AuNPs比色法具有简单、快速、成本低、肉眼可见等优点[23-26],因此本研究以Nb总蛋白为抗原制备多克隆抗体,从而制备抗体探针,以此来探究AuNPs比色法在Nb检测中应用的可行性,期望为AuNPs比色法今后在Nb检测上的应用打下基础。
1 材料与方法
试验于2017年8月至2018年3月在中国农业科学院蚕业研究所病理研究室完成。
1.1 材料与主要试剂
1.1.1 病原来源 Nb由中国农业科学院蚕业研究所家蚕生理与病理研究室保存,系利用纯化的家蚕微孢子悬液(浓度108个/mL)给家蚕品种菁松×皓月4龄起蚕添食感染后,从患病家蚕中分离提取获得。
1.1.2 主要仪器与试剂 玻璃珠(sigma-aldrich)购自于西格玛奥德里奇(上海)贸易有限公司,研磨器購自于美国Biospec公司,透射电子显微镜购自于荷兰Philips公司,Onedrop OD-1000紫外分光光度计购自于上海吉盛医学科技有限公司,柠檬酸三钠购自西陇化工股份有限公司,氯金酸购自国药集团化学试剂北京有限公司。
1.2 试验方法
1.2.1 纳米金(AuNPs)制备 对100 mL质量分数为0.01%的氯金酸溶液进行加热和搅拌(转速500 r/min),煮沸后,快速加入1.8 mL质量分数为1%的柠檬酸三钠溶液,持续煮沸,在溶液颜色稳定为酒红色后继续加热5 min,停止加热并持续搅拌30 min[27]。即合成了柠檬酸三钠包裹的纳米金溶胶,自然冷却至室温后,定容至100 mL,4 ℃保存备用。用透射电镜拍摄和紫外-可见光谱扫描对所制备的纳米金进行表征。
1.2.2 家蚕微孢子虫总蛋白提取及其抗体制备 在珠磨式研磨器专用管中加入经percoll纯化的1 mL Nb(109个/mL)。之后加入酸洗玻璃珠,并以转速为4 800 r/min进行破碎,每次1 min,破碎6次。之后,破碎液中加入0.3 mL样品裂解液(0.125 mol/l Tris-HCl、5% SDS、50%甘油、5% β-巯基乙醇),充分混匀,4 ℃孵育12 h,8 000 r/min离心10 min,之后将上清液进行超滤,将Nb总蛋白置换到PBS中,超滤条件为4 ℃、4 000 r/min离心30 min,重复操作将样品浓度调至 1 mg/mL。将所获得Nb总蛋白作为抗原进行抗体制备[德泰生物科技(南京)有限公司制备]。
1.2.3 抗体与AuNPs结合的最佳pH值 确定配置500 μL不同pH值(5.5、6、6.5、7、7.5、8、8.5、9、9.5、10)的纳米金溶液,之后分别加入10 μL 0.5 mg/mL Nb多抗溶液,振荡 20 min 后室温放置10 min;然后分别加入50 μL的10% NaCl溶液,振荡混合10 min,室温下放置2 h,于波长520 nm测定D值,绘制曲线[14,28]。
1.2.4 AuNPs与抗体结合的最佳浓度测定 将纳米金pH值调至最适值,各EP管中加入500 μL纳米金溶液,之后分别加入0、2.5、5.0、7.5、10.0、12.5 μL浓度为0.5 mg/mL的Nb抗体蛋白,振荡20 min后室温放置10 min;然后分别加入50 μL 的10% NaCl溶液,振荡混合10 min,室温下放置2 h,于波长520 nm测其D值,绘制曲线[14,28]。
1.2.5 AuNPs探针制备 将50 mL AuNPs溶液调至最适pH值,加入适量Nb抗体蛋白后缓慢摇匀30 min,室温静置 30 min;加入10% BSA至终浓度为1%,室温封闭30 min。12 000 r/min 离心30 min,弃上清,用5 mL稀释液(20 nmol/L Tris-HCl,1% BSA)将沉淀重悬,4 ℃保存备用。
1.2.6 纳米金探针活性及其特异性测定 取10 μL纳米探针溶液与5 μL 1 mg/mL Nb总蛋白溶液混合,37 ℃分别孵育30 min、1 h、2 h,观察各组颜色变化。各取10 μL纳米探针溶液,分别加入5 μL不同种类蛋白作为抗原(Nb总蛋白、BSA、BmN 细胞总蛋白),蛋白浓度为1 mg/mL,进行比色检测。
1.2.7 纳米金探针灵敏性测定确定最优反应条件,检测不同浓度的Nb蛋白样品(100.0、20.0、2.0、0.5、0.1、0.05、0 μg/mL)。
2 结果与分析
2.1 AuNPs的制备
应用柠檬酸钠还原法制备的AuNPs溶液呈现酒红色、透光性好、没有聚沉。由AuNPs的透射电镜照片(图1-A)可見,粒子呈较为规则的球形或近球形,分散均匀;图1-B为AuNPs的紫外-可见吸收光谱,在523 nm处出现了紫外特征吸收峰,根据纳米金最大吸收峰与粒径存在的线性关系式[29](y=0.427 1x+514.56,y表示最大吸收峰,x表示纳米金粒径),计算出所制备纳米金粒径约为20 nm。
2.2 Nb总蛋白抗体制备
纯化后的Nb多克隆抗体通过ELISA法测定其效价>1 ∶ 512 000,SDS-PAGE检测显示,抗体纯度在95%以上。Western blot试验结果(图2)显示,Nb总蛋白抗体能够特异性识别Nb,并且可以同时检测到Nb的多种蛋白。
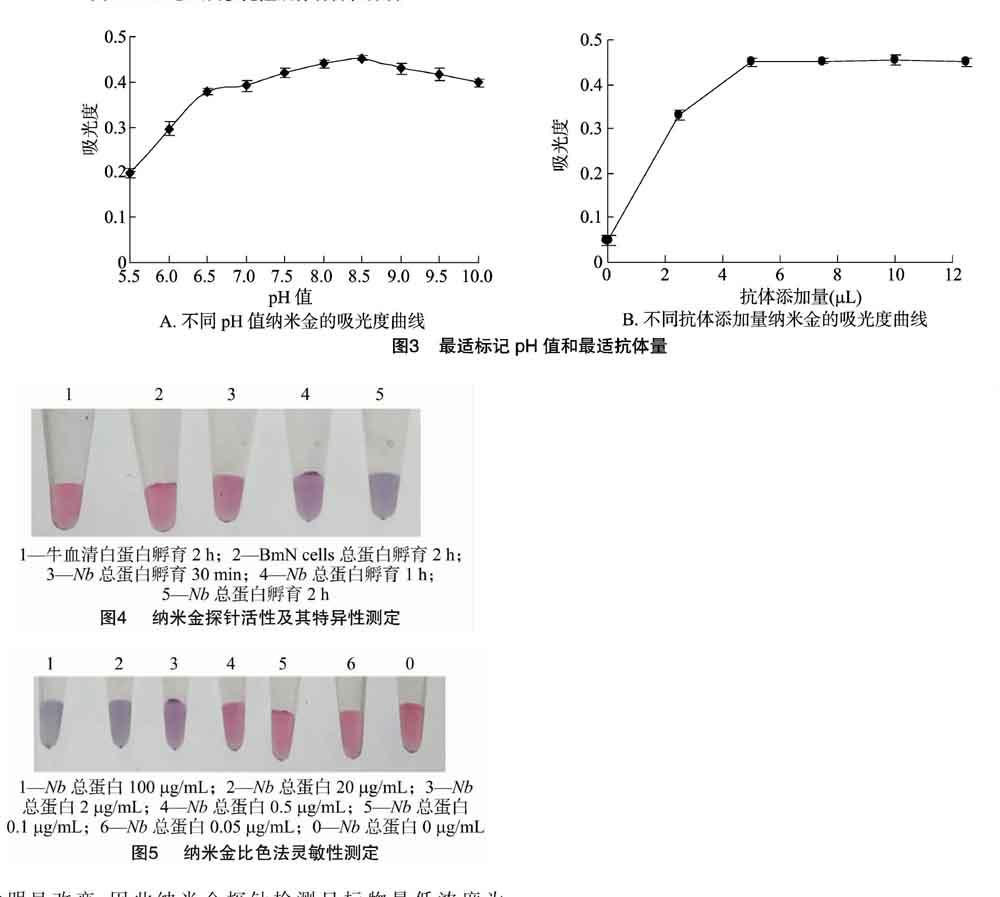
2.3 最适标记pH值和最适抗体量
由图3-A可知,在pH值为8.5时纳米金和Nb总蛋白抗体结合情况最佳。由图3-B可知,500 μL纳米金溶液中添加≥5 μL质量浓度为0.5 mg/mL的Nb抗体溶液后的趋势无明显变化,表明此时的抗体蛋白已经足够与AuNPs形成稳定的复合物。
2.4 AuNPs探针活性及其特异性测定
由图4可知,AuNPs探针检测Nb总蛋白,混合1 h后,检测溶液颜色出现明显变化(由红色变为紫色),2 h后,检测溶液颜色逐渐变为蓝色。当加入BSA和BmN细胞蛋白时,检测溶液颜色保持不变。只有检测物为Nb蛋白时,检测溶液中纳米金才会聚集变色。
2.5 AuNPs比色法灵敏性测定
不同浓度的Nb蛋白样品(100.0、20.0、2.0、0.5、0.1、0.05、0.0 μg/mL) 与纳米金探针混合后,37 ℃下孵育2 h。由图5可知,当目标检测物浓度低于2 μg/mL时,检测液颜色不会明显改变,因此纳米金探针检测目标物最低浓度为 2 μg/mL,即检测量为10 ng。
3 讨论与结论
在弱碱环境下,AuNPs带负电荷,易与蛋白质分子的正电荷基团结合。由于这种静电结合方式不会改变蛋白质的生物活性,因而被广泛应用到生物检测领域内[14]。本试验利用柠檬酸三钠还原法制备的AuNPs分散均匀,形状规则,平均粒径为20 nm,适合进行标记[14,22]。本试验确定的最佳标记pH值为8.5,这与之前研究报道IgG标记时,AuNPs所用pH值为8.5[14,22]相一致。 AuNPs溶液pH值会显著影响纳米金颗粒与抗体蛋白之间的结合。当AuNPs溶液的pH值等于或略高于蛋白质的等电点时,蛋白质呈中性,此时蛋白质与AuNPs相互间静电作用力最小,但蛋白质分子表面张力却最大,处于微水化状态,易吸附在AuNPs表面,形成蛋白层,阻止AuNPs聚集,从而达到稳定状态[14,29]。
根据Li等研究报道,AuNPs比色法要求将抗体结合在AuNPs,根据抗原抗体特异性结合,使分散的AuNPs聚集,这表明至少需要2种探针才能确保在检测单一目标蛋白时AuNPs会聚集[21]。由于本试验所制备的Nb抗体能够检测出多种Nb蛋白,所以在AuNPs比色检测Nb时就无须制备2种探针,大大降低检测成本。之前文献报道,胶体金免疫层析法用于检测微孢子虫时会遇到检测时部分微孢子虫沉附于样品垫及结合垫表面,只有悬浮的微孢子到达检测区[30]。纳米金比色法避免以上问题出现,因为此方法检测样品为可溶性蛋白,但是纳米金比色法也存在Nb蛋白提取费时、损耗问题。本试验的AuNPs比色法能够检测出最低Nb蛋白量为10 ng,须要耗时2 h,这2项指标与Li等的研究报道纳米金比色法检测β-酪蛋白的检测所需要的最低蛋白量和检测时间[21]有一定差距,可能是由于目标检测物不同及靶向蛋白提取时损耗等所致。本试验为AuNPs比色法在家蚕微孢子虫检测中的应用提供了理论基础,但要在实际检验工作中应用,还须要进一步优化试验条件和试验方法。
试验所制备的AuNPs分散均匀,形状规则,适合进行标记。Nb抗体与AuNPs(20 nm)结合最佳浓度为每500 μL AuNPs溶液中添加5 μL 0.5 mg/mL抗体蛋白,标记最佳pH值为8.5。AuNPs比色法能够最低检测出Nb蛋白量为10 ng。
參考文献:
[1]Weiss L M. The first united workshop on Microsporidia from invertebrate and vertebrate hosts[J]. Folia Parasitologica,2005,52(1/2):1-7.
[2]戴卫江,陈 功,彭祥然,等. 应用荧光染色剂Fluorescent Brightener 28和Propidium Iodide染色识别家蚕微孢子虫[J]. 蚕业科学,2017,43(1):62-67.
[3]周泽扬,潘国庆,向仲怀. 家蚕微孢子虫研究10年回眸[J]. 蚕业科学,2014,40(6):949-956.
[4]芦 琨,党晓群,潘国庆,等. 家蚕微孢子虫诊断方法研究进展[J]. 蚕学通讯,2008,28(4):35-38.
[5]刘吉平,曹 阳,Smith J E,等. 模拟感染家蚕微粒子病的PCR分子诊断技术研究[J]. 中国农业科学,2004,37(12):1925-1931.
[6]万 淼,何永强,张海燕,等. 家蚕成品卵微粒子病McAb-ELISA检测方法的研究[J]. 蚕桑通报,2008,39(4):13-16.
[7]芦 琨. 家蚕微粒子病免疫学快速检测试纸条的研制[D]. 重庆:西南大学,2009:35-43.
[8]李艳红,谢 俪,潘国庆,等. 家蚕微孢子虫抗体免疫荧光检测方法的建立及应用[J]. 西南大学学报(自然科学版),2006,28(6):990-993.
[9]Awadalla H N,Naga I E,Eltemsahi M M,et al. Detection of microsporidia by different staining techniques[J]. Parasitology International,1998,47(28):729-738.
[10]万嘉群. 用酶标抗体法检测蚕微粒子孢子[J]. 中国动物检疫,1998,15(1):6-7.
[11]韦亚东,张国政,陆长德. 家蚕微孢子虫原位杂交诊断技术研究[J]. 蚕业科学,2005,31(1):64-68.
[12]凌 凯. 纳米金比色法测定大分子分子量[D]. 北京:北京协和医学院中国医学科学院北京协和医学院中国医学科学院清华大学医学部,2013:20-23.
[13]Cordray M S,Amdahl M,Richards-Kortum R R . Gold nanoparticle aggregation for quantification of oligonucleotides:Optimization and increased dynamic range[J]. Analytical Biochemistry,2012,431(2):99-105.
[14]孙素玲,张忠诚,许贝贝,等. 恩诺沙星抗体与胶体金结合的最佳浓度和最佳pH的确定[J]. 动物医学进展,2014,35(4):59-62.
[15]Techathuvanan C,Draughon F A,Dsouza D H. Loop-mediated isothermal amplification (LAMP) for the rapid and sensitive detection of salmonella typhimurium from pork[J]. Journal of Food Science,2010,75(3):165-172.
[16]Jaroenram W,Arunrut N,Kiatpathomchai W. Rapid and sensitive detection of shrimp yellow head virus using loop-mediated isothermal amplification and a colorogenicnanogold hybridization probe
