中华沙鳅的两性异形和雌性繁殖能力
2019-08-21李柯王志刚毛丽盈
李柯 王志刚 毛丽盈

摘要:为研究中华沙鳅两性异形状况,检测中华沙鳅(Botia superciliaris)16个形态特征的两性异形及雌性个体生育力。t检验显示,沙鳅雌性个体体长和体质量显著大于雄性个体。以体长为协变量的One-way ANCOVA和Tukeys检验显示,中华沙鳅的雌性个体头长、头宽、头高、吻长、眼后头长、体高、尾柄高、背鳍基前距、背鳍基长、腹鳍基前距显著大于雄性个体(P<0.05)。对全部样本的16个指标形态特征经标准化后进行主成分分析(Eigenvalue>1)发现,第一主成分和第二主成分共解释形态变异69.044%。回归分析表明,中华沙鳅的怀卵数量与体长、体质量等特征正相关。对所有测量的形态特征与体长进行一元线性回归分析表明,雌性中华沙鳅局部形态特征的生长速率明显大于雄性。生育能力影响雌性中华沙鳅腹腔容量。
关键词:中华沙鳅;两性异形;生育力;主成分分析
中图分类号: Q954 文献标志码: A 文章编号:1002-1302(2019)12-0204-04
两性异形又称性别二态或性差,一般指某种动物雌雄两性在身体的某些部位有着显著的差异,这种现象普遍存在于脊椎动物界[1],研究证实其具有重要的进化生物学意义及生态适应意义[2]。近年来,生物学家提出了个体大小两性异形进化的3种主要适应机制:性选择、生育力选择和生态位分化选择[3]。根据选择特征的不同,性选择可以分为性别内选择和性别间选择。性别内选择主要通过雄性之间为得到配偶的相互竞争得以进行,性别间选择则通过产生增加性吸引力特征的方式来进行[4]。根据生育力选择学说,较大的雌性个体提高生育力的方法之一是通过贮存和产出更多的卵细胞。外部的生态压力(如捕食压力、食物可得性、生境选择等)也是作用于生物个体大小进化的力量[5-8]。根据生态位分化假说,生物雌雄个体选择不同的生态位使两性异形不断进化,进而造成营养结构上的性二态。鱼类普遍存在个体大小、体色和局部特征的两性异形,受性选择、生育力选择、生长过程物质和能量的分配等多种选择压力的作用[9-12]。
中华沙鳅隶属于鲤形目(Cypriniformes)、鳅科(Cobitidae)、沙鳅亚科(Botiinae)、沙鳅属(Botia),是浙江省钱塘江流域及其山区溪流中的常见野生鳅类。中华沙鳅有成对的精巢,卵巢单个,产漂流性卵,受精卵无黏性。中华沙鳅的产卵类型为1年1次,繁殖高峰期在每年5—6月份[13]。中华沙鳅属于底栖肉食性鱼类,主要吃甲壳动物、幼虫、藻类、原生动物和植物碎片[14]。
目前已有学者对中华沙鳅的肌肉营养[15-16]、胚胎发育[17]、人工驯养繁育技术[18]等方面进行了广泛研究,为其两性间形态差异的定量研究提供了基础数据。本研究旨在通过比较中华沙鳅形态特征的两性异形程度及雌性个体生育力的差异,探讨两性异形的原因及其进化机制。
1 材料与方法
1.1 试验材料
2018年9月2日,于浙江省衢州市华埠县捕捉野生中华沙鳅44尾,带回浙江师范大学生化学院水产特种实验室,将沙鳅用塑料袋密封包装后冰冻处死并保存,1周内进行解冻、测量和解剖。
1.2 试验方法
1.2.1 体态特征测量 用数显游标卡尺测定样本的体长、头长、头宽、头高、吻长、眼后头长、眼径、眼间距、体高、臀鳍基长、尾柄高、尾鳍长、背鳍基前距、背鳍基长、腹鳍基前距、腹鳍臀鳍间距等形态指标(±0.01 mm),用Mettler电子天平称沙鳅体质量和去内脏体质量(±0.000 1 g)。
1.2.2 雌性个体生育力 用倒置显微镜对中华沙鳅的卵巢进行观察和计数,用雌鱼怀卵黄沉积的卵数量来表示沙鳅个体生育能力。雌鱼怀卵数测量方法:取出雌鱼卵巢称质量(m),取随机一部分卵巢(N),并在倒置显微镜下计算出怀卵数量(n),然后按公式:怀卵数量=n×m/N。每个卵巢测定3次后取平均值。
1.3 数据处理
数据的统计由SPSS 23.0统计软件包完成,在作进一步统计分析前检验其正态性(Kolmogorov-Smirnov)和方差同质性(Levene),若不服从正态分布,则将数据进行自然对数转化。通过t-检验、主成分分析、单因素方差分析(One-way ANOVA)、协方差分析(One-way ANCOVA)、Tukeys检验等处理和检验数据,描述性统计值用“平均值±标准误(范围)”表示,显著性水平设置为α=0.05。
2 结果与分析
2.1 中华沙鳅形态特征的两性异形
本次试验共检测中华沙鳅个体44尾,雄性个体27尾,雌性个体17尾。本次试验最小性成熟的雌性个体为 112.43 mm,以此为标准,大于112.43 mm者为成熟个体。沙鳅的基本描述性统计见表1。通过正态分布检验,发现头长、眼间距、尾鳍基长、尾鳍长、腹鳍臀鳍间距不符合正态分布(P<0.05),将它们进行对数转化再次正态分布检验,发现眼间距、尾鳍基长、尾鳍长符合正态分布(P>0.05),上述数据均符合方差同质性(P>0.05)。根据t检验发现两性之间体长、体质量存在显著差异,雌性个体的体质量和体长显著大于雄性个体。以体长为协变量的One-way ANCOVA和Tukeys檢验显示,中华沙鳅的雌性个体头长、头宽、头高、吻长、眼后头长、体高、尾柄高、背鳍基前距、背鳍基长、腹鳍基前距显著大于雄性个体(P<0.05),两性间其他局部特征不存在显著的两性差异,雄性个体除了眼径和尾鳍长大于雌性个体外,其余特征均小于雌性个体(表1)。
2.2 主成分分析
对全部样本的16个形态指标经标准化后进行主成分分析,共得4个主成分(Eigenvalue>1)。由表2可知,第一、第二、第三、第四主成分共解释形态变异83.739%。体长、头长、头宽、头高、吻长、眼后头长、体高、背鳍基前距、腹鳍基前距在第一主成分有较高的正负载系数(解释57.626%变异);腹鳍臀鳍间距在第二主成分、第三主成分有较高的正负载系数(分别解释11.418%、7.778%变异);尾鳍长在第四主成分有较高的正负载系数(解释 6.917% 变异)。
2.3 雌体繁殖输出与相关形态分析
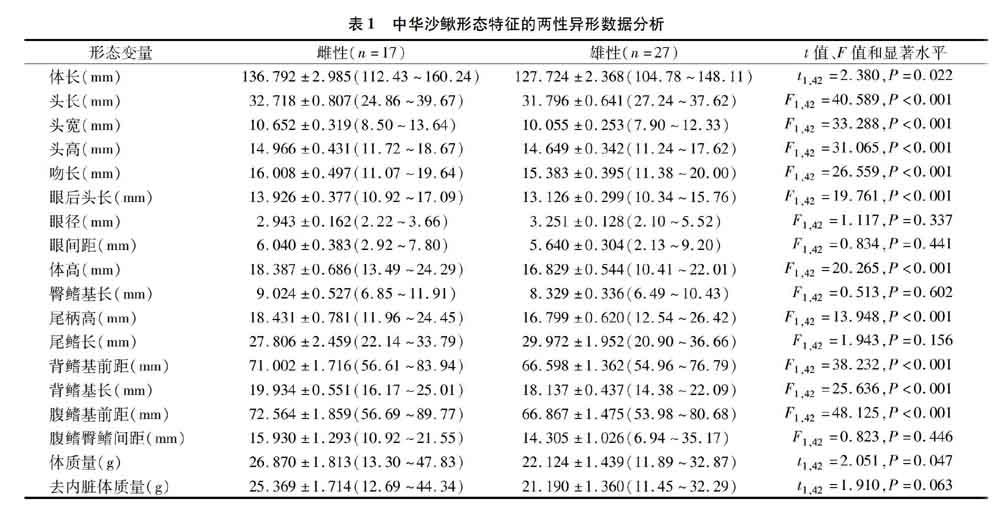
本研究检测的中华沙鳅雌性个体17尾,怀卵数量在 8 713~36 721粒之间,平均为24 700粒。回归分析表明,中华沙鳅的怀卵数量与体长(r2=0.667,F1,15=29.99,P<0.05)、体质量(r2=0.615,F1,15=24.01,P<0.05)、体高(r2=0.689,F1,15=33.20,P<0.05)、头长(r2=0.589,F1,15=21.476,P<0.05)、头宽(r2=0.456,F1,15=12.59,P<0.05)、头高(r2=0.520,F1,15=16.282,P<0.05)、臀鳍基长(r2=0.587,F1,15=21.361,P<0.05)、尾柄高(r2=0.493,F1,15=14.593,P<0.05)、尾鳍长(r2=0.514,F1,15=15.84,P<0.05)、眼后头长(r2=0.667,F1,15=29.99,P<0.05)、背鳍基前距(r2=0.514,F1,15=15.868,P<0.05)和腹鳍基前距(r2=0.649, F1,15=27.705,P<0.05)显著正相关, 和其他局部特征不存在显著正相关。图1表明,中华沙鳅雌性个体体长越长,个体怀卵数越多。图2表明,中华沙鳅雌性个体体质量越大,个体怀卵数越多。
2.4 形态特征的异速增长分析
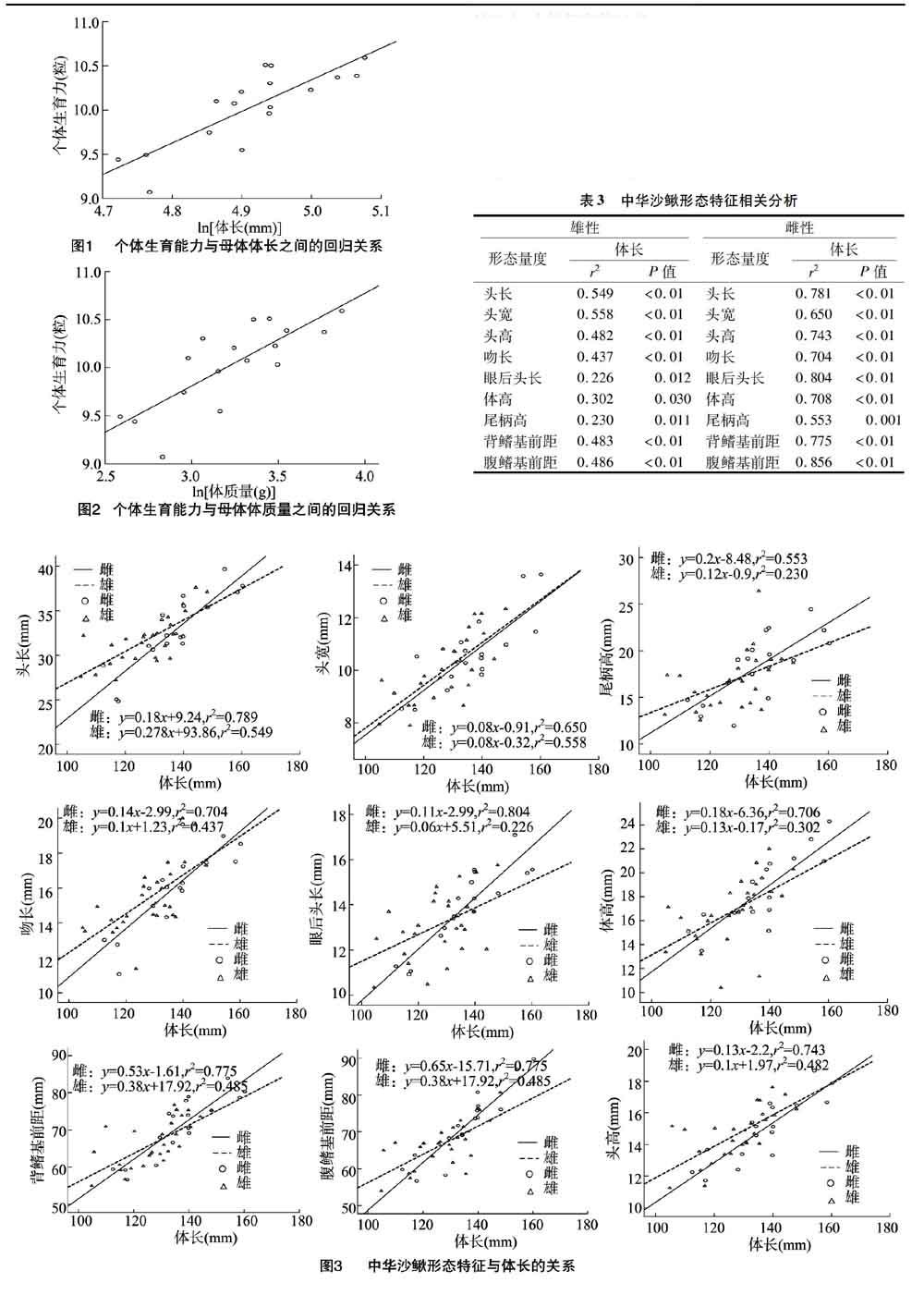
一元线性回归分析表明,雌、雄中华沙鳅的头长、头宽、头高、吻长、眼后头长、体高、尾柄高、背鳍基前距、尾鳍基前距与体长有较明显的线性关系(P<0.05)(表3),且除头长、头宽外,雌性这些局部特征的斜率均大于雄性。表明雌性中华沙鳅这些局部特征增长速率大于雄性个体(图3)。
3 讨论与结论
3.1 两性异形
动物个体大小的两性异形一般解释为性选择[19]和生育力选择[20]等综合作用的结果。性选择主要是由于交配体制[21]。当性选择作用于雄性个体时,会通过放大雄性个体局部特征来提高交配的成功率,当存在雄性格斗、精子竞争影响交配成功率时,就会出现雄性大个体的进化机制[9,22],与此同时还会表现出雄性对后代的保护[21]。如黄颡鱼(Pelteobagrus fulvidraco)[12],雄性个体较大,进而有雄鱼筑巢和保护后代的习性[23]。而雌性大个体进化机制则依赖于生育能力[22],此时大个体雄性对于交配和后代的保护并不是必需的,雌性个体会大于雄性个体。淇河鲫鱼(Carassius auratus)[24]为雌性个体显著大于雄性个体,通过增大腹腔容积相关的形态特征,提高繁殖输出力。本研究结果表明,中华沙鳅雌性的体长和部分局部特征显著大于雄性,并且雌性个体的头长、背鳍基前距和体高均显著大于雄性个体,使雌性个体具有较大的头部和较高的躯体,有利于其在繁殖期间抢夺更多的食物以满足自身在繁殖期中的能量消耗[25]。同时也表现出雌性个体有较大的腹腔容量,从而增加繁殖输出。该现象也反映出生育能力选择更多地影响中华沙鳅的腹腔容量相关的形态特征变异。另外,中华沙鳅雄性个体眼径和尾鳍长均大于雌性个体,较长的尾鳍可能在鱼类交配竞争中能够起到炫耀警示作用[26],还有利于追逐排卵的雌性个体增加受精率。较大的眼径可能有利于雄性个体获得食物资源。但要明确解释这一结果,需要进一步的证据,如两性个体视力差异、游泳能力差异等。生态因子在一定程度上影响了两性异形的产生[27],中华沙鳅属于典型的底栖肉食性鱼类,主要分布于食物丰富的南方地区,食性比较广[15]。这一现象很好地促进了两性异形的产生。
3.2 繁殖输出能力
线性回归表明,雌体个体(体长和体质量)与繁殖输出呈显著的正相关,表明雌性个体越大,繁殖输出越高,这与同类研究结果[28]相似。同时,中华沙鳅雌性个体大于雄性个体,线性回归还表明了繁殖输出与体高、臀鳍基长、尾柄高、眼后头长、背鳍基前距和腹鳍基前距存在显著的正相关。有理由认为,中华沙鳅雌体通过个体大小的增加和腹腔容量的改变,提高雌体的繁殖输出,提高繁殖能力,表明生育力选择有利于中华沙鳅形成较大的雌鱼[29-30]。
3.3 异速增长
在个体生长发育过程中,雌雄个体的各形态特征都会随着个体大小的增大而呈现出不同的生长速率。相关研究表明,异速增长与两性异形之间存在相关性[31-33]。回归分析显示,成体雌性中华沙鳅头长、头宽、头高、吻长、眼后头长、体高、尾柄高、背鳍基前距、尾鳍基前距的生长速率均高于雌性,存在异速增长现象。同时雌雄性个体这些特征存在显著差异,表明两性间这些差异可能在成体之后形成的,也表明了雌雄两性个体用于生长和繁殖的物质和能量分配上的差异,雌性更多地用于个体的生长。
综上所述,通过对中华沙鳅的形态特征进行测量,中华沙鳅存在体长和局部特征显著的两性异形差异,中华沙鳅雌性成体大于雄性成体,部分局部差异是在中华沙鳅成体阶段形成的。生育能力選择更多地影响中华沙鳅雌性大个体的形成。
参考文献:
[1]Shine R. Ecological causes for the evolution of sexual dimorphism:a review of the evidence[J]. The Quarterly Review of Biology,1989,64(4):419-461.
[2]Estlander S,Kahilainen K K,Horppila J,et al. Latitudinal variation in sexual dimorphism in life-history traits of a freshwater fish[J]. Ecology and Evolution,2017,7(2):665-673.
[3]金锦锦,张方方,仇玉萍,等. 小黄黝鱼繁殖期与非繁殖期的两性异形[J]. 四川动物,2018,37(5):507-518.
[4]张建军,张知彬. 动物的性选择[J]. 生态学杂志,2003,22(4):60-64.
[5]Jonsson B,Jonsson N,Bredtkorb E,et al. Life-history traits of Brown trout vary with the size of small stroams[J]. Functional Ecology,2001,15(3):310-317.
[6]Reznick D N,Ghalambor C K. Can commercial fishing cause evolution? Answers from guppies (Poecilia reticulata)[J]. Canadian Journal of Fisheries and Aquatic Sciences,2005,62(4):791-801.
[7]Hendry A P,Kelly M L,Kinnison M T,et al. Parallel evolution of the sexes? Effects of predation and habitat features on the size and shape of wild guppies[J]. Journal of Evolutionary Biology,2006,19(3):741-754.
[8]Walsh M R,Reznick D N. Interactions between the direct and indirect effects of predators determine life history evolution in a killifish[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(2):594-599.
[9]Snelson F F . Systematics of the subgenus Lythrurus,genus Notropis (Pisces:Cyprinidae).[J]Bulletin of the Florida State Museum,Biological Science,1972,17(1):1-92.
[10]Pyron M. Sexual size dimorphism and phylogeny in North American minnows[J]. Biological Journal of the Linnean Society,1996,57(4):327-341.
[11]Henderson B A,Collins N C,Morgan G E,et al. Sexual size dimorphism of walleye (Stizostedion vitreum vitreum)[J]. Canadian Journal of Fisheries and Aquatic Science,2003,60(11):1345-1352.
[12]林植華,雷焕宗. 黄颡鱼的两性异形和雌性繁殖特征[J]. 动物学杂志,2004,39(6):13-17.
[13]温 涛,何 斌. 金沙江下游中华沙鳅的资源现状、繁殖特性及人工繁育的初步研究[J]. 淡水渔业,2012,42(4):94-96.
[14]普 炯,贾 砾,苏胜齐,等. 中华沙鳅含肉率及肌肉营养成分分析[J]. 西南大学学报(自然科学版),2014,36(3):42-48.
[15]普 炯,贾 砾,苏胜齐,等. 中华沙鳅食性研究[J]. 西南大学学报(自然科学版),2014,36(1):41-46.
[16]邹远超,文正勇,覃川杰,等. 野生和养殖中华沙鳅肌肉营养成分比较分析[J]. 营养学报,2018,40(3):304-306.
[17]何 斌,陈先均,温 涛,等. 中华沙鳅的胚胎发育[J]. 西南农业学报,2014,27(3):1332-1336.
[18]李 强,姚明予,周 波,等. 中华沙鳅人工繁殖技术初探[J]. 淡水渔业,2016,41(5):92-95.
[19]Legrand R S,Morse D H. Factors driving extreme sexual size dimorphism of a sit-and-wait predator under low density[J]. Biological Journal of the Linnean Society,2000,71(4):643-664.
[20]Székely T,Reynolds J D,Figuerola J. Sexual dimorphism in size in
shorebirds,gulls and alcids:the influence of sexual and natural selection[J]. Evolution,2000,54(4):1404-1413.
[21]Alonzo S H,Warner R R. Male and female alternative reproductive behaviors in fishes:a new approach using Intersexual dynamics[J]. Annual Review of Ecology & Systematics,1997,9(28):571-592.
[22]Parker G A. The evolution of sexual size dimorphism in fish[J]. Journal of Fish Biology,1992,41(sB):1-20.
[23]余祥胜,邱丛芳,周明华. 黄颡鱼大规格苗种培育[J]. 水产养殖,2016,37(9):37-38.
[24]胡凤霞,胡海洋,田华香,等. 淇河鲫鱼形态学两性异形研究[J]. 水产科学,2016,35(1):43-48.
[25]Lu H L,Lin Z H,Li H,et al. Geographic variation in hatchling size in an oviparous skink:effects of maternal investment and incubation thermal environment[J]. Biological Journal of the Linnean Society,2014,113(1):283-296.
[26]Emlen S T,Oring L W. Ecology,sexual selection,and the evolution of mating systems[J]. Science,1977,197(4300):215-223.
[27]Spoljaric M A,Reimchen T E. Habitat-dependent reduction of sexual dimorphism in geometric body shape of Haida Gwaii threespine stickleback[J]. Biological Journal of the Linnean Society,2008,95(3):505-516.
[28]樊曉丽,林植华,丁先龙,等.鲇鱼和胡子鲇的两性异形与雌性个体生育力[J]. 生态学报,2014,34(3):555-563.
[29]林植华,雷焕宗,陈利丽,等. 棒花鱼形态特征的两性异形和雌性个体生育力[J]. 四川动物,2007,26(4):910-913.
[30]徐德钦,林植华,雷焕宗. 温州厚唇鱼形态特征的两性异形和雌性个体生育力[J]. 上海交通大学学报(农业科学版),2006,24(4):335-340.
[31]郑荣泉,杜卫国,寿 鹿. 黑斑侧褶蛙的两性异形和雌性繁殖特征[J]. 动物学杂志,2002,37(4):14-18.
[32]黄棨通,龚大洁. 康县隆肛蛙的两性异形[J]. 四川动物,2018,37(2):149-155.
[33]万丽霞,张海军,李海娇. 甘肃密点麻蜥三个地理种群的两性异形研究[J]. 四川动物,2018,37(2):139-148.戴卫江,陈红丽,张志林,等. 纳米金比色法在家蚕微孢子虫检测中的应用[J]. 江苏农业科学,2019,47(12):208-211.
